Gebruik van de Ramsay Assay Fluid Afscheiding en Ion Flux tarieven in de Meet<em> Drosophila melanogaster</em> Malpighian buisje
Summary
Dit protocol beschrijft het gebruik van de Ramsay assay vloeistofsecretie tarieven van geïsoleerde Malpighian (renale) tubuli van Drosophila melanogaster gemeten. Bovendien, het gebruik van een ionen-specifieke elektrode natrium en kalium concentraties te meten in de afgescheiden vloeistof, zodat berekening van transepitheliale ionenflux, wordt beschreven.
Abstract
Modulatie van renale epitheliale ionentransport maakt organismen en osmotische ionische homeostase in aanwezigheid van verschillende externe omstandigheden. De Drosophila melanogaster Malpighian (renale) tubulus biedt een unieke gelegenheid om de moleculaire mechanismen van epitheel ionentransport bestuderen, vanwege de krachtige genetica van dit organisme en de toegankelijkheid van de renale tubuli fysiologische onderzoek. Hier beschrijven we het gebruik van Ramsay assay vloeistofsecretie tarieven van geïsoleerde fly niertubuli meten met gebruik van een ionen-specifieke elektrode natrium en kalium concentraties te meten in de afgescheiden vloeistof. Deze test maakt onderzoek transepitheliaal vocht en ionen stromen van ~ 20 tubules tegelijk, zonder dat de afgescheiden vloeistof te dragen aan een afzonderlijke inrichting te ion concentraties te meten. Genetisch verschillende buisjes kunnen worden geanalyseerd om de functie van specifieke genen beoordelen transportprocessen. Bovendien, de bathing zout kan worden aangepast om de effecten van de chemische eigenschappen of geneesmiddelen of hormonen toegevoegd onderzoeken. Samengevat, deze techniek kan de moleculaire karakterisatie van de basismechanismen van epitheel ionentransport in Drosophila tubulus, evenals regulering van deze transportmechanismen.
Introduction
Nierepitheel ionentransport grondslag organismal iono- en osmoregulatie. De Drosophila melanogaster Malpighian (nier) buisje biedt een unieke kans om de moleculaire mechanismen van epitheliale ionentransport bestuderen. Dit komt door de combinatie van de krachtige genetica van Drosophila, gekoppeld aan de toegankelijkheid van de renale tubuli fysiologische onderzoek. De Ramsay test, genoemd naar de onderzoeker die de techniek 1 pionier, meet vloeistof secretie tarieven van geïsoleerde Malpighian buisjes, en werd opgericht in Drosophila in 1994 door Dow en collega's 2. Dit maakte de weg vrij voor verdere studies met behulp van Drosophila genetische instrumenten, zoals het GAL4 UAS-systeem 3,4 tot cel-specifieke signaalwegen reguleren vloeistof secretie te definiëren. Een voorbeeld omvat calciumsignalen in reactie op een peptide hormoon 5, onder vele anderen 6,7.
ve_content "> Een combinatie van genetische technieken en klassieke fysiologische studie heeft aangetoond dat urine generatie treedt de vlieg door de afscheiding van een kaliumchloride-rijke vloeistof uit het hoofdsegment van de tubulus. Dit gebeurt door de parallelle transepitheliale afscheiding van kationen, vooral K + maar ook Na +, door middel van de belangrijkste cel en Cl -. secretie door de stellaatcel 12/08 De mogelijkheid om transepitheliaal K + en Na + fluxen afzonderlijk te meten maakt een meer gedetailleerde karakterisering van de mechanismen vervoer dan het meten van de vloeistof secretie alone. Bijvoorbeeld in ongestimuleerde Drosophila buisjes, de Na + / K + -ATPase-remmer ouabaïne heeft geen invloed op vloeistofsecretie 2, zelfs wanneer de opname in belangrijkste cellen wordt geremd door organische anion transporter inhibitor taurocholaat 13. Echter, Linton en O'Donnell toonde aan dat ouabain depolariseertde basolaterale membraanpotentiaal en verhoogt Na + flux 9. Zoals getoond in de representatieve resultaten gerepliceerde we deze bevindingen, en toonden aan dat K + flux gelijktijdig afgenomen 14; de verhoogde Na + flux en verminderde K + flux hebben tegengestelde effecten op de vloeistof secretie, wat resulteert in geen netto verandering in de afscheiding. Er zijn dus twee oplossingen voor dit "ouabain paradox", dwz de aanvankelijke waarneming dat ouabaïne geen effect heeft op vloeistofsecretie in Drosophila tubulus. Eerst, in gestimuleerde buisjes het effect van ouabaïne op vloeistofsecretie blijkt niet te wijten aan de opname door het organische anion transporter 13; en ten tweede, in gestimuleerde buisjes, ouabain heeft tegengestelde effecten op transepitheliaal Na + en K + stroom, waardoor er geen netto verandering in de vloeistof secretie (zie Representatieve resultaten en ref. 9). Daarom is de primaire rol van de Na + / K + -ATPase in gestimuleerde buisjes is om intracellulaire Na + concentratie te verlagen tot een gunstige concentratiegradiënt genereren voor Na + -gekoppelde transport processen in de basolaterale membraan. Immers, door het afzonderlijk meten van Na + en K + fluxen we aangetoond dat tubules zonder de fly natrium-kalium-2-chloride cotransporter (NKCC) gedaald transepitheliaal K + flux, zonder verdere afname na ouabain toevoeging en geen verandering in epitheel Na + flux 14. Deze bevindingen ondersteunden conclusie dat Na + het invoeren van de cel door de NKCC wordt gerecycled via de Na + / K + -ATPase. In een ander voorbeeld Ianowski et al. Vastgesteld dat het verlagen bath K + concentratie van 10 mM tot 6 mM verminderde transepitheliaal K + flux en verhoogde transepitheliaal Na + flux in buisjes van Rhodnius prolixus, zonder netto verandering in vloeistofsecretie <sup> 15. Differentiële effecten van Na + en K + flux flux over larvale buisjes Ook in Drosophila buisjes waargenomen als reactie op variërende zout diëten 16 en twee soorten muggen in reactie op fokken zoutgehalte 17.De grootste uitdaging bij het meten van transepitheliale ion flux in de Ramsay assay preparaat is het bepalen van ion concentraties in de afgescheiden vloeistof. Deze uitdaging is voldaan met verschillende oplossingen, waaronder vlam photometery 18, het gebruik van radioactieve ionen 19 en elektronen probe golflengte dispersieve spectroscopie 20. Deze technieken vereisen de overdracht van de afgescheiden vloeistof druppel een instrument voor het meten van ionenconcentraties. Omdat de hoeveelheid vloeistof afgescheiden door de gestimuleerde Drosophila tubulus is klein, kenmerkend ~ 0,5 nl / min, dit vormt een technische uitdaging en introduceert ook fout als een deel van de afgescheiden vloeistofverloren bij de overdracht. In tegenstelling, het gebruik van een ionen-specifieke elektrode maakt de meting van de ionen-activiteit (waarvan ionen berekend kan worden) in situ. Het huidige protocol werd aangepast van die welke door Maddrell en collega's transepitheliaal K + flux over de Rhodnius tubulus meten met behulp valinomycine als K + ionofoor 21, en beschrijft ook de toepassing van een 4-tert -butylcalix [4] areen-azijnzuur tetraethyl-ester gebaseerde Na * -specifieke ionen-specifieke elektrode kenmerk Messerli et. al. 22. Ion-specifieke elektroden zijn ook gebruikt om ionenconcentraties in vloeistof afgescheiden door Malpighian tubuli in de Ramsay assay bij volwassen en larven 9,23 16 Drosophila melanogaster gemeten, de Nieuw-Zeelandse Alpine Weta (Hemideina maori) 24 en 17 muggen.
Hier beschrijven we in detail de toepassing van de Ramsay alszeg vloeistofsecretie prijzen Malpighi buisjes uit Drosophila melanogaster, evenals het gebruik van een ionen-specifieke elektrode om de concentratie van K + en Na + in de afgescheiden vloeistof te bepalen en dus de berekening van transepitheliale ionfluxen meten. Een overzicht van de assay wordt gegeven in figuur 1.
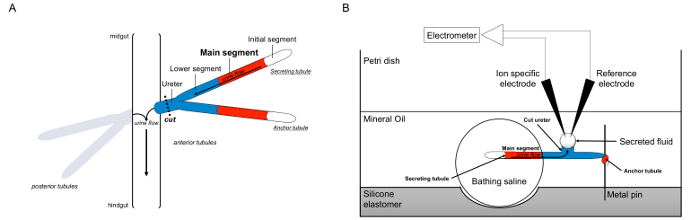
Figuur 1. Schematische voorstelling van de Malpighian Buisjes en Ramsay Assay met gebruik van Ion-specifieke elektroden te meten Ion Concentraties. Dit cijfer illustreert de setup voor de Ramsay test. (A) Elk fly vier tubules, een paar voorste tubuli en een paar achterste tubuli, die zweven in de buikholte omgeven door hemolymfe. In elk paar zijn de twee buisjes mee in de urineleider, die vervolgens leegt de urine op de kruising van de middendarm en hindgut. De buisjes zijn blind-geëindigd. Urine wordt gegenereerd door de fluïdum uitscheidende hoofdsegment (getoond in rood), en stroomt naar de ureter en buiten in de darm. Na dissectie, is het buisje paar losgekoppeld van de darm door transecting de urineleider. (B) Het paar buisjes wordt vervolgens overgebracht in een druppel baden saline binnen een putje van de assay schotel. Een van de twee tubuli, hier aangeduid als de "anchor tubulus," is rond een metalen pen en inert. Het andere buisje is het afscheidende buisje. De eerste segment (die niet uitscheiden vloeistof) en hoofdsegment van het afscheidende tubulus blijven binnen de druppel baden zoutoplossing. Ionen en water beweging van de baden zoutoplossing en in de tubulus lumen van de belangrijkste segment, en ga dan verder in de richting van de urineleider, zoals zou optreden in vivo. Het lagere segment (blauw) is buiten het bad zoute en dus inert. Aangezien de ureter wordt gesneden, de afgescheiden vloeistof naar voren als een druppel van het afgesneden uiteinde van de ureter. Thij afgescheiden vloeistof druppel vergroot in de tijd als afscheiding blijft, en de diameter wordt gemeten met behulp van een oculaire micrometer. Een laag minerale olie voorkomt verdamping van de vloeistof afgescheiden. De referentie en ion specifieke elektroden meten van de ion concentratie van de afgescheiden vloeistof. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Het gebruik van Ramsay assay, samen met ion-specifieke elektroden, maakt de meting van vloeistofsecretie prijzen en ionfluxen in geïsoleerde insecten Malpighi (renale) tubuli. Twintig of meer buisjes kunnen worden getest tegelijk, waardoor hogere doorvoercapaciteit in vergelijking met de test van afzonderlijke in vitro microperfused tubuli. Bovendien ionen-specifieke elektrode maken de bepaling van de ionenconcentraties in de afgescheiden vloeistof in situ, dat fouten bij de overdracht van kl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

