L'utilisation du test Ramsay mesurer la sécrétion de liquide et de flux d'ions dans le Tarifs<em> Drosophila melanogaster</em> Tubule Malpighian
Summary
Ce protocole décrit l'utilisation de l'essai Ramsay pour mesurer les taux de sécrétion de liquide de isolés Malpighian (rénale) tubules de Drosophila melanogaster. En outre, l'utilisation d'électrodes spécifiques des ions pour mesurer les concentrations de sodium et de potassium dans le fluide sécrété, permettant le calcul de flux transépithélial d'ions, est décrit.
Abstract
Modulation de transport d'ions rénale épithéliale organismes permet de maintenir l'homéostasie ionique et osmotique dans la face de la variation des conditions extérieures. Le Drosophila melanogaster Malpighian (rénale) tubule offre une occasion unique d'étudier les mécanismes moléculaires de transport d'ions épithéliale, en raison de la génétique puissants de cet organisme et de l'accessibilité de ses tubules rénaux à l'étude physiologique. Ici, nous décrivons l'utilisation de l'essai Ramsay pour mesurer les taux de sécrétion de liquide de mouche isolé tubules rénaux, avec l'utilisation d'électrodes spécifiques des ions pour mesurer les concentrations de sodium et de potassium dans le liquide sécrété. Ce test permet d'étudier des liquides ioniques et transépithélial flux de ~ 20 tubes à la fois, sans la nécessité de transférer le fluide sécrété à un appareil séparé pour mesurer les concentrations d'ions. Génétiquement tubules distinctes peuvent être analysées pour évaluer le rôle des gènes spécifiques dans les processus de transport. En outre, le bsaline athing peut être modifié pour examiner les effets de ses caractéristiques chimiques, ou des médicaments ou des hormones ajoutées. En résumé, cette technique permet la caractérisation moléculaire des mécanismes de base de transport epithelial d'ions dans le tubule Drosophila, ainsi que la régulation de ces mécanismes de transport.
Introduction
Rénale transport ionique épithéliale sous-tend organismal ionosphère et osmorégulation. Le Drosophila melanogaster Malpighian (rénale) tubule offre une occasion unique d'étudier les mécanismes moléculaires de transport d'ions épithéliale. Cela est dû à la combinaison de la génétique de la drosophile puissants, associé à l'accessibilité de ses tubules rénaux à l'étude physiologique. Le dosage Ramsay, nommé d'après le chercheur pionnier de la technique 1, mesure les taux de sécrétion de fluides à partir de tubes de Malpighi isolées, et a été établie chez la drosophile en 1994 par Dow et ses collègues 2. Cela a ouvert la voie à d'autres études utilisant la drosophile outils génétiques, telles que le système GAL4 UAS 3,4, pour définir les voies de signalisation cellulaires spécifiques régissant la sécrétion de fluide. Un exemple comprend la signalisation du calcium en réponse à une hormone peptidique 5, parmi beaucoup d'autres 6,7.
ve_content "> Une combinaison de techniques génétiques et étude physiologique classique a montré que la production d'urine chez la mouche se produit par la sécrétion d'un chlorure de potassium riche en fluide à partir du segment principal du tube. Ceci se produit par l'intermédiaire du transépithélial sécrétion parallèle de cations, principalement K + mais aussi Na +, à travers la cellule principale, et Cl -. sécrétion à travers la cellule stellaire 8-12 La capacité de mesurer séparément transépithéliaux flux K + et Na + permet une caractérisation plus détaillée des mécanismes de transport que la mesure de la sécrétion de fluide seul. Par exemple, dans les tubules Drosophila non stimulées, la Na + / K + -ATPase ouabaïne n'a aucun effet sur la sécrétion de fluide 2, même lorsque son absorption dans les cellules principales est inhibée par l'inhibiteur de transport anionique organique taurocholate 13. Cependant, Linton et O'Donnell a montré que l'ouabaïne dépolarisele potentiel de la membrane basolatérale, Na + et augmente le flux 9. Comme le montrent les résultats représentatifs, nous avons reproduit ces résultats, et montré que flux de K + est concomitante diminué de 14; l'augmentation du flux de Na + et K + a diminué flux des effets opposés sur la sécrétion de fluide, de sorte qu'aucun changement net de la sécrétion. Ainsi, il ya deux résolutions au «paradoxe ouabaïne», à savoir l'observation initiale que ouabaïne n'a aucun effet sur la sécrétion de fluide dans le tubule Drosophila:. La première, dans les tubules stimulés, l'effet de la ouabaïne sur la sécrétion de fluide est pas évident en raison de son absorption par le système de transport anionique organique 13; et la seconde, dans les tubules non stimulées, ouabaïne a des effets sur transepithelial Na + et K + flux opposés, entraînant aucun changement net de la sécrétion de fluide (voir résultats représentatifs et réf. 9). Par conséquent, le rôle principal de la Na + / K + ATPase dans les tubules non stimulées est de réduire la concentration intracellulaire de Na + à générer un gradient de concentration favorable pour Na + -coupled processus de transport à travers la membrane basolatérale. En effet, en mesurant séparément Na + et K + flux, nous avons démontré que les tubules manque la volée sodium-potassium-2-chlorure cotransporteur (NKCC) ont diminué K transepithelial + flux, sans diminution supplémentaire après addition ouabaïne, et aucun changement dans transepithelial Na + flux 14. Ces résultats ont appuyé notre conclusion que Na + entrant dans la cellule par l'intermédiaire du NKCC est recyclée à travers la Na + / K + -ATPase. Dans un autre exemple, Ianowski et al. Observe que l'abaissement de bain concentration de K + de 10 à 6 mm diminué transepithelial flux de K + et une augmentation transepithelial Na + flux dans les tubules de Rhodnius prolixus, avec aucun changement net de la sécrétion de fluide <sup> 15. Les effets différentiels sur Na + et K + flux flux à travers les tubules larvaires ont également été observés dans les tubules de drosophile en réponse à divers régimes de sel 16 et dans deux espèces de moustiques en réponse à l'élevage de la salinité 17.La plus grande difficulté dans la mesure de flux transépithélial d'ions dans la préparation d'essai Ramsay est la détermination des concentrations des ions dans le fluide sécrété. Ce défi a été relevé avec différentes solutions, y compris la flamme photometery 18, l'utilisation d'ions radioactifs 19 et sonde électronique longueur d'onde de la spectroscopie à dispersion 20. Ces techniques nécessitent le transfert de la goutte de fluide sécrété à un instrument de mesure des concentrations d'ions. Etant donné que le volume de fluide sécrété par les tubules Drosophila non stimulé est petite, typiquement environ 0,5 nl / min, ce qui pose un défi technique et introduit également erreur si une partie du fluide est sécrétéperdu au moment du transfert. En revanche, l'utilisation d'électrodes spécifiques des ions permet la mesure de l'activité ionique (à partir de laquelle la concentration en ions peut être calculée) in situ. Le protocole actuel a été adaptée à partir de celle utilisée par les Maddrell et collègues pour mesurer transépithélial flux de K + à travers le tube Rhodnius utilisant la valinomycine comme K + ionophore 21, et décrit également l'utilisation d'un -butylcalix 4- tert [4] d'acides arène-tétraacétique Na tétraéthyle à base d'ester + électrode spécifique-ion spécifique de caractérisé par Messerli et. . 22 al. Électrodes ions spécifiques ont également été utilisés pour mesurer les concentrations d'ions dans le liquide sécrété par les tubules de Malpighi dans le dosage Ramsay chez l'adulte et larvaire 9,23 16 Drosophila melanogaster, la Nouvelle-Zélande Alpine Weta (Hemideina maori) 24 et 17 chez les moustiques.
Ici, nous décrivons en détail l'utilisation de la Ramsay commedire pour mesurer les taux de sécrétion de fluide dans les tubes de Malpighi de Drosophila melanogaster, ainsi que l'utilisation d'électrodes spécifiques des ions afin de déterminer les concentrations de K + et Na + dans le fluide sécrété, et donc le calcul des flux transépithélial d'ions. Une vue d'ensemble de l'essai est fourni à la figure 1.
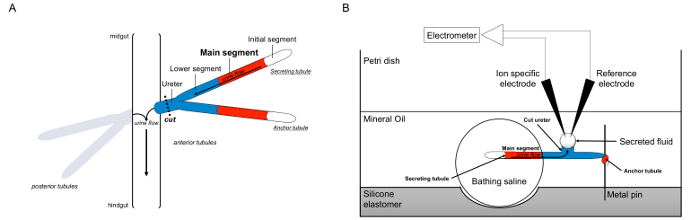
Figure 1. Schéma de l'Malpighian Pailles et le test Ramsay avec utilisation de l'ion-spécifiques électrodes pour mesurer les concentrations d'ions. Cette figure illustre la configuration pour le dosage Ramsay. (A) Pour chaque volée comporte quatre tubes, une paire de tubules antérieure et une paire de tubules postérieures, qui flottent dans la cavité abdominale entouré d'hémolymphe. Dans chaque paire, les deux tubes se rejoignent à l'uretère, qui se jette ensuite l'urine à la jonction de l'intestin moyen et hindgut. Les tubules sont aveugles-clos. L'urine est généré par le segment principal de fluide sécrétant (en rouge), et coule vers l'uretère et sortir dans l'intestin. Après dissection, la paire de tubule est dissocié à partir de l'intestin par transection l'uretère. (B) La paire de tubes est ensuite transféré dans une gouttelette de solution saline dans un bain bien du plat de dosage. L'un des deux tubes, appelé ici le "tube d'ancrage», est enroulé autour d'une tige de métal et est inerte. L'autre tube est le tube de sécrétion. Le segment initial (qui ne sécrètent pas fluide) et le segment principal de la tubule sécrétant restent dans la gouttelette de solution saline de baignade. Ions et mouvement de l'eau de la solution saline de bain et dans la lumière des tubules du segment principal, puis se déplacent vers l'uretère, comme cela se produirait in vivo. Le segment inférieur (bleu) est en dehors de la solution saline de baignade et donc inerte. Depuis l'uretère est coupé, le fluide sécrété apparaît comme une gouttelette à partir de la fin de l'uretère de coupe. Til agrandit gouttelette de fluide sécrété dans le temps comme la sécrétion continue, et son diamètre est mesuré en utilisant un micromètre oculaire. Une couche d'huile minérale empêche l'évaporation du fluide sécrété. Les électrodes spécifiques référence et d'ions de mesurer la concentration en ions du fluide sécrété. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
L'utilisation du test Ramsay, avec électrodes spécifiques des ions, permet de mesurer les taux de sécrétion des fluides et des flux d'ions dans insecte isolé Malpighi (rénales) tubules. Vingt ou plusieurs tubes peuvent être testés à la fois, ce qui permet un débit plus élevé par rapport au dosage de l'individu dans les tubules in vitro microperfused. En outre, des électrodes spécifiques des ions permettent la détermination des concentrations ioniques dans le fluide sécrété in s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

