Bruk av Ramsay analysen å måle fluidsekresjon og Ion Flux priser i<em> Drosophila melanogaster</em> Malpighian tubule
Summary
Denne protokollen beskriver bruken av den Ramsay assay for å måle fluid sekresjon av priser fra isolerte Malpighian (nyre) rørelementene fra Drosophila melanogaster. I tillegg til bruken av ione-spesifikke elektroder måler natrium- og kaliumkonsentrasjoner i den utskilte væske, slik at beregningen av transepitelial ionefluks, er beskrevet.
Abstract
Modulering av renal epitel ionetransport tillater organismer for å opprettholde ionisk og osmotisk homeostase i møte med varierende ytre forhold. Drosophila melanogaster Malpighian (nedsatt) tubuli tilbyr en enestående mulighet til å studere de molekylære mekanismene for epitel ion transport, på grunn av den kraftige genetikk av denne organismen og tilgjengeligheten av sine nyretubuli til fysiologisk undersøkelse. Her beskriver vi bruken av Ramsay assay for å måle fluid sekresjon av priser fra isolerte flue renale tubuli, ved anvendelse av ione-spesifikke elektroder for å måle natrium- og kalium-konsentrasjoner i den utskilte væske. Denne analyse tillater studium av transepitelial fluid og Ion fluksene av ~ 20 rørelementer på en gang, uten behov for å overføre utskilte væske til en separat anordning for å måle ion-konsentrasjoner. Genetisk distinkte tubuli kan analyseres for å vurdere rollen til spesifikke gener i transportprosesser. I tillegg, bathing saltvann kan endres for å undersøke effekten av sine kjemiske egenskaper, eller medisiner eller hormoner lagt til. I sammendrag, tillater denne teknikken den molekylære karakterisering av grunnleggende mekanismer for epitel ionetransport i Drosophila tubuli, samt regulering av disse transportmekanismer.
Introduction
Nedsatt epitel ion transport til grunn organisme ione- og osmoregulering. Drosophila melanogaster Malpighian (nedsatt) tubuli tilbyr en enestående mulighet til å studere de molekylære mekanismene for epitel ion transport. Dette skyldes kombinasjonen av kraftige genetikk av Drosophila, sammen med tilgjengeligheten av sine nyretubuli til fysiologisk undersøkelse. The Ramsay analysen, oppkalt etter etterforsker som pioner teknikken en måler fluidsekresjon priser fra isolerte Malpighian tubuli, og ble etablert i Drosophila i 1994 av Dow og kolleger 2. Dette banet vei for videre studier ved hjelp Drosophila genetiske verktøy, for eksempel GAL4-UAS system 3,4, for å definere celle-spesifikke signalveier som regulerer fluidsekresjon. Et eksempel inkluderer kalsiumsignalisering i respons til et peptidhormon 5, blant mange andre 6,7.
ve_content "> En kombinasjon av genetiske teknikker og klassiske fysiologiske studium har vist at urinproduksjonen i fore fly gjennom sekresjon av et kaliumklorid-rik væske fra den største delen av rørelementet. Dette skjer gjennom parallell transepitelial sekresjon av kationer, i første rekke K + Na +, men også gjennom hovedcellen, og Cl -. sekresjon gjennom stel cellen 8-12 Muligheten for separat å måle transepitelial K + og Na + fluks gir en mer detaljert karakterisering av transportmekanismer enn måling av fluidsekresjon alene. For eksempel, i ikke-stimulerte Drosophila tubuli, Na + / K + -ATPase-inhibitoren ouabain har ingen virkning på væske sekresjon 2, selv når dens opptak i primære celler inhiberes av det organiske anion transporter inhibitor taurocholat 13. Imidlertid, og Linton O'Donnell viste at ouabain depolarisererden basolaterale membran potensial, og øker Na + fluks 9. Som vist i de representative resultater, vi kopiert disse funnene, og viste at K + flux er samtidig redusert 14; økt Na + flux og redusert K + flux har motstridende effekter på fluidsekresjon, noe som resulterer i ingen netto endring i sekret. Således er det to oppløsninger til de "ouabain paradoks", dvs. den opprinnelige observasjonen som ouabain har noen effekt på fluidsekresjon i Drosophila tubuli. Første, i stimulerte tubuli, er ikke tydelig effekten av ouabain på fluidsekresjon grunn dens opptak i det organiske anion transporter 13; og andre, i unstimulated tubuli, ouabain har motstridende effekter på transepitelial Na + og K + flux, som resulterer i ingen netto endring i fluidsekresjon (se Representative Resultater og ref. 9). Derfor den primære rolle Na + / K + -ATPase i ustimulerte tubuli er å senke intracellulær Na + -konsentrasjon å generere en gunstig konsentrasjonsgradient for Na + -koblet transportprosesser over basolaterale membran. Faktisk, ved separat måling Na + og K + flukser, viste vi at tubuli mangler fly natrium-kalium-to-klorid kotransporter (NKCC) har sunket transepitelial K + flux, uten ytterligere nedgang etter ouabain tillegg og ingen endring i transepitelial Na + flux 14. Disse funnene støtter vårt konklusjon at Na + inn i cellen gjennom NKCC resirkuleres via Na + / K + -ATPase. I et annet eksempel Ianowski et al., Observert at senking bad K + konsentrasjon fra 10 mM til 6 mM redusert transepitelial K + fluks og øket transepitelial Na + fluksen i tubuli fra Rhodnius prolixus, med ingen netto endring i fluidsekresjon <sup> 15. Forskjellige effekter på Na + flux og K + flux over larve tubuli har også blitt observert i Drosophila tubuli i respons til varierende salt dietter 16 og i to myggarter som svar på stell saltholdighet 17.Den største utfordringen i målingen av transepitelial ionefluks i Ramsay analysen forberedelse er bestemmelse av ionekonsentrasjoner innenfor utskilt væske. Denne utfordringen har blitt møtt med varierende løsninger, inkludert flamme photometery 18, bruk av radioaktive ioner 19, og elektron probe bølgelengde spredning spektroskopi 20. Disse teknikkene krever overføring av det utskilte fluid fallet til et instrument for måling av ion-konsentrasjoner. Siden volumet av væske som utskilles av den ustimulerte Drosophila tubuli er liten, typisk ~ 0,5 nl / min, utgjør dette en teknisk utfordring og også introduserer feil hvis noe av det utskilte fluid ertapt ved overføring. I motsetning til dette tillater bruken av ione-spesifikke elektroder til måling av ioneaktivitet (som ion-konsentrasjon kan beregnes) in situ. Den nåværende protokoll ble tilpasset fra det som brukes av Maddrell og kolleger til å måle transepitelial K + fluks over Rhodnius tubuli ved hjelp valinomycin som ionofor K + 21, og også beskriver bruk av en 4-tert–butylcalix [4] aren-tetraeddiksyre tetraetyl-ester-baserte Na + -spesifikk ione-spesifikke elektroder kjennetegnet ved Messerli et. al. 22. Ion-spesifikke elektroder har også blitt brukt til å måle ionekonsentrasjoner i væske som skilles ut av Malpighian tubuli i Ramsay analysen i voksen 9,23 og larve 16 Drosophila melanogaster, New Zealand Alpine Weta (Hemideina maori) 24 og mygg 17.
Her beskriver vi i detalj ved bruk av Ramsay såsi å måle fluid sekresjon priser i Malpighian tubuli fra Drosophila melanogaster, samt anvendelse av ione-spesifikke elektroder for å bestemme konsentrasjonene av K + og Na + i den utskilte væske og dermed beregningen av transepitelial ion flukser. En oversikt av analysen er gitt i figur 1.
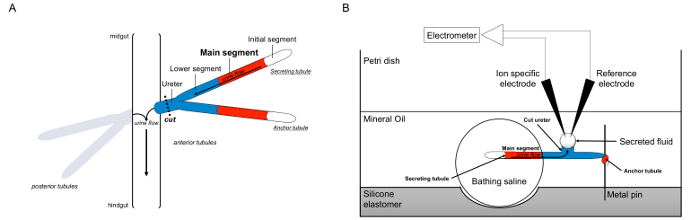
Figur 1. Skjematisk av Malpighian Drikkerør og Ramsay analysen med bruk av Ion-spesifikke Elektroder måle ionekonsentrasjoner. Denne figuren illustrerer oppsettet for Ramsay analysen. (A) Hver flue har fire rør, et par av fremre tubuli og et par bakre rør, som flyter i bukhulen omgitt av hemolymph. I hvert par, de to tubuli delta på ureter, som munner da urinen i krysset midgut og hindgut. Rørelementene er blind-avsluttet. Urin genereres av fluid-sekresjon hovedsegmentet (vist i rødt), og strømmer mot ureter og ut i tarmen. Etter disseksjon, er tubule paret skilt fra tarmen ved transecting ureter. (B) De to rørelementene blir deretter overført til en dråpe av badesaltløsning inne i en brønn av analysen fatet. En av de to rørelementene, referert til her som "anker tubuli," er viklet rundt en metallstift, og er inert. Den andre tubuli er sekresjon tubuli. Den innledende segment (som ikke skiller ut væske) og hovedsegmentet av de som utskiller tubuli forblir i dråpen av badesaltløsning. Ioner og vann flytte fra bade saltvann og inn i tubulære lumen av hovedsegmentet, og deretter bevege seg mot ureter, som ville oppstå in vivo. Den nedre segment (blå) er utenfor bade saltvann og derfor inert. Siden ureter er kuttet, framgår det utskilte fluid som en dråpe fra den kappede enden av ureter. THan utskilt væske dråpe forstørrer over tid som sekresjon fortsetter, og dens diameter er målt ved hjelp av et okular mikrometer. Et lag av mineralolje hindrer fordampning av det utskilte fluid. Referanse- og ion spesifikke elektroder måler ion konsentrasjonen av utskilt væske. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Bruken av Ramsay analysen sammen med ione-spesifikke elektroder, muliggjør målingen av fluidsekresjon rater og ion flukser i isolert insekt Malpighian (renale tubuli). Tyve eller flere av rørelementene kan analyseres på en gang, slik at høyere gjennomstrømning i forhold til analysen av individuelle in vitro microperfused tubuli. I tillegg, ione-spesifikke elektroder tillater bestemmelse av ionekonsentrasjoner i den utskilte væske in situ, noe som begrenser feil som kan innføres i overføringen …
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

