A utilização do Ramsay ensaio para medir secreção de fluidos e Ion Flux Preços no<em> Drosophila melanogaster</em> Tubule Malpighian
Summary
Este protocolo descreve a utilização do ensaio de Ramsay para medir as taxas de secreção de fluidos de Malpighi (túbulos renais) isolado a partir de Drosophila melanogaster. Além disso, a utilização de eléctrodos específicos de iões para medir as concentrações de sódio e potássio no líquido segregado, que permite o cálculo do fluxo de iões transepitelial, é descrito.
Abstract
Modulação de transporte iónico epitelial renal permite que os organismos para manter a homeostase iónica e osmótica na face da variação das condições externas. A Drosophila melanogaster Malpighian (renal) túbulo oferece uma oportunidade única para estudar os mecanismos moleculares de transporte de íons epitelial, devido à genética poderosas deste organismo e da acessibilidade dos seus túbulos renais para estudo fisiológico. Aqui, nós descrevemos o uso do ensaio de Ramsay para medir as taxas de secreção de fluidos a partir de isolado de moscas túbulos renais, com a utilização de eléctrodos específicos de iões para medir as concentrações de sódio e potássio em que o fluido segregado. Este ensaio permite o estudo de fluidos e de iões transepitelial fluxos de ~ 20 túbulos de cada vez, sem a necessidade de transferir o fluido segregado a um aparelho separado para medir as concentrações de iões. Túbulos geneticamente distintas podem ser analisados para avaliar o papel de genes específicos em processos de transporte. Além disso, o bathing salina pode ser modificado para analisar os efeitos das suas características químicas, ou drogas ou hormonas acrescentados. Em resumo, esta técnica permite a caracterização molecular dos mecanismos básicos de transporte epitelial de iões no túbulo Drosophila, bem como a regulação destes mecanismos de transporte.
Introduction
Transporte de íons epitelial renal subjacente iono- organismal e osmoregulation. A Drosophila melanogaster Malpighian (renal) túbulo oferece uma oportunidade única para estudar os mecanismos moleculares de transporte de íons epitelial. Isto é devido à combinação dos poderosas da genética de Drosophila, emparelhado com a acessibilidade dos seus túbulos renais para estudo fisiológico. O ensaio de Ramsay, em homenagem ao pesquisador que foi pioneiro na técnica 1, mede as taxas de secreção de fluidos de túbulos de Malpighi isolados, e foi criada em Drosophila em 1994 pela Dow e colegas 2. Isso pavimentou o caminho para novos estudos utilizando Drosophila ferramentas genéticas, tais como o sistema GAL4-UAS 3,4, para definir específico de células vias de sinalização que regulam a secreção de fluidos. Um exemplo inclui a sinalização de cálcio, em resposta a uma hormona peptídica, 5, 6,7, entre muitos outros.
ve_content "> uma combinação de técnicas genéticas e estudo fisiológico clássica demonstrou que a geração de urina na mosca ocorre através da secreção de um líquido rico em cloreto de potássio a partir do segmento principal do túbulo. Isto ocorre através da secreção transepitelial paralelo de catiões, principalmente K + Na +, mas também, através da célula principal, e Cl -. através da secreção de células estreladas 8-12 A capacidade de medir separadamente transepiteliais K + e Na + fluxos permite uma caracterização mais detalhada dos mecanismos de transporte do que a medição da secreção de fluido sozinho. Por exemplo, nos túbulos de Drosophila não estimuladas, a Na + / K + -ATPase ouabaína não tem efeito sobre a secreção de fluido 2, mesmo quando a sua absorção em células principais é inibida pelo inibidor de transportador aniónico taurocolato orgânica 13. No entanto, e Linton O'Donnell mostrou que a ouabaína despolarizao potencial da membrana basolateral, e aumenta o fluxo de Na + 9. Como mostrado nos resultados representativos, nós replicado estes achados, e mostrou que K + fluxo é concomitantemente diminuiu 14; o aumento do fluxo de Na + e diminuição do K + fluxo têm efeitos opostos sobre a secreção de fluido, resultando em nenhuma alteração na secreção de líquido. Assim, existem duas resoluções para o "paradoxo ouabaína," ou seja, a observação inicial de que a ouabaína não tem efeito sobre a secreção de fluido no túbulo Drosophila:. Em primeiro lugar, nos túbulos estimulada, o efeito de ouabaína na secreção de fluido não é aparente devido à sua absorção pelo transportador de aniões orgânicos 13; e, segundo, nos túbulos não estimuladas, ouabaína tem efeitos sobre transepithelial Na + e K + fluxo opostas, resultando em nenhuma alteração líquida na secreção de fluidos (ver resultados representativos e ref. 9). Portanto, o principal papel do Na + / K + -ATPase nos túbulos não estimuladas é o de diminuir a concentração intracelular de Na + para gerar um gradiente de concentração de Na + para o favorável -coupled processos de transporte através da membrana basolateral. Com efeito, medindo em separado de Na + e K + fluxos, nós demonstramos que túbulos que falta o co-transportador de mosca de sódio-potássio-2-cloreto de (CCAN) diminuíram K transepitelial + fluxo, sem diminuição adicional após a adição de ouabaína, e nenhuma alteração em transepitelial Na + fluxo 14. Estes resultados suportada nossa conclusão de que o Na + que entra na célula através da CCAN é reciclado através do Na + / K + -ATPase. Em outro exemplo, Ianowski et al., Observaram que a redução da concentração do banho de K + de 10 mM a 6 mM de K + diminuiu transepitelial fluxo transepitelial e aumentou o fluxo de Na + nos túbulos de Rhodnius prolixus, sem alteração líquida no fluido de secreção <sup> 15. Efeitos diferenciais de fluxo de Na + e K + fluxo através dos túbulos de larvas também têm sido observadas em túbulos de Drosophila em resposta a diferentes dietas de sal 16 e em duas espécies de mosquitos em resposta à criação de salinidade 17.O maior desafio na medição de fluxo de iões transepitelial na preparação de ensaio Ramsay é a determinação das concentrações de iões dentro do fluido segregado. Este desafio foi cumprido com soluções diferentes, incluindo photometery chama 18, o uso de íons radioativos 19, e eletrônica sonda comprimento de onda espectroscopia por dispersão de 20. Estas técnicas exigem transferência da gota líquido secretado a um instrumento para a medição de concentrações de íons. Uma vez que o volume de fluido que é segregado pelo túbulo Drosophila não estimulado é pequena, tipicamente ~ 0,5 nl / min, isto representa um desafio técnico e também introduz erro se algum do fluido é segregadaperdeu por ocasião da transferência. Em contraste, a utilização de eléctrodos específicos de iões permite a medição da actividade de iões (a partir do qual a concentração de iões pode ser calculado) in situ. O protocolo corrente foi adaptada da utilizada por Maddrell e colegas para medir transepitelial K + fluxo através do túbulo Rhodnius usando valinomicina como o K + ionóforo 21, e também descreve a utilização de um -butylcalix 4- terc [4] areno-ácido tetraacético tetraetil éster à base de Na + eléctrodo específico de iões espec�ico caracterizado por Messerli et. al. 22. Eletrodos íon-específicas também têm sido usados para medir concentrações de íons no líquido secretado por túbulos de Malpighi no ensaio Ramsay em 9,23 adulto e 16 larval Drosophila melanogaster, a Nova Zelândia Alpine Weta (Hemideina maori) 24 e 17 em mosquitos.
Aqui, descrevemos em detalhes o uso do Ramsay comodizer para medir as taxas de secreção de fluidos em túbulos de Malpighi de Drosophila melanogaster, bem como o uso de eletrodos de íon-específico para determinar as concentrações de K + e Na + dentro do fluido secretado e, portanto, o cálculo dos fluxos de iões transepithelial. Uma visão geral do ensaio é fornecida na Figura 1.
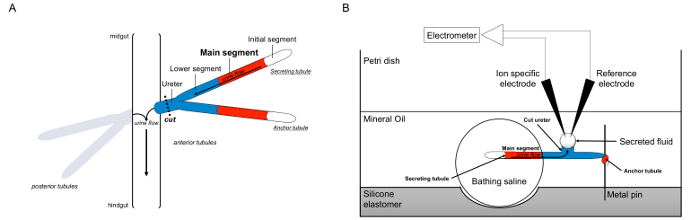
Figura 1. Esquema do Malpighian Palhinha eo Ramsay Ensaio com uso de íon-específicas eletrodos para medir concentrações de iões. Esta figura ilustra a configuração para o ensaio Ramsay. (A) Cada mosca tem quatro túbulos, um par de túbulos anterior e um par de túbulos posteriores, que flutuam na cavidade abdominal cercado por hemolinfa. Em cada par, as duas túbulos juntar-se no ureter, que, em seguida, esvazia-se a urina na junção do intestino médio e hindgut. Os túbulos são cegos-ended. A urina é gerado pelo segmento principal secretor de fluido (representado em vermelho), e flui para fora do ureter e no intestino. Após dissecção, a par dos túbulos é dissociada do intestino, ao seccionar o ureter. (B) A par dos túbulos é então transferida para uma gota de solução salina de banho dentro de uma cavidade do prato de ensaio. Um dos dois túbulos, referido aqui como o "túbulo âncora", é enrolado em torno de um pino de metal e é inerte. A outra é o túbulo túbulo secretora. O segmento inicial (que não secretam fluido) e segmento principal do túbulo segregam permanecer dentro da gotícula de solução salina de banho. Íons e movimento de água da salina de banho e para o lúmen do túbulo do segmento principal, em seguida, avançar em direção ao ureter, como ocorreria in vivo. O segmento inferior (azul) está fora da salina de banho e, portanto, inertes. Uma vez que o ureter é cortado, o fluido segregado surge como uma gota a partir da extremidade de corte do ureter. Tele secretada gota de fluido aumenta ao longo do tempo como a secreção continua, e o seu diâmetro é medido usando um micrómetro ocular. Uma camada de óleo mineral evita a evaporação do fluido que é segregado. Os eletrodos de referência específicas e de iões de medir a concentração de íons do fluido secretado. Por favor clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A utilização do ensaio de Ramsay, em conjunto com eletrodos íon-específico, permite a medição das taxas de secreção de fluidos e fluxos de iões em insetos isolado Malpighi (renais) túbulos. Vinte ou mais túbulos pode ser ensaiada de cada vez, permitindo que um maior rendimento em comparação com o ensaio in vitro de indivíduo microperfused túbulos. Além disso, os eléctrodos específicos de iões permitir a determinação das concentrações de iões dentro do fluido que é segregado in situ,…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

