Synthèse hautement stéréosélective de 1,6-cétoesters médiée par des liquides ioniques: une réaction à trois composantes permettant l'accès rapide à une nouvelle classe de faible poids moléculaire Gelators
Summary
Ionic liquids (ILs) mediate fast, simple and cheap access to 1,6-ketoesters in high diastereoselectivities and good yields. The reaction protocol is robust and the 1,6-ketoesters can be obtained in gram scale after a simple filtration protocol. Moreover, the 1,6-ketoesters are potent gelators in hydrocarbon solvents.
Abstract
In organic chemistry ionic liquids (ILs) have emerged as safe and recyclable reaction solvents. In the presence of a base ILs can be deprotonated to form catalytically active N-Heterocyclic Carbenes (NHCs). Here we have used ILs as precatalysts in the addition of α,β-unsaturated aldehydes to chalcones to form 1,6-ketoesters, incorporating an anti-diphenyl moiety in a highly stereoselective fashion. The reaction has a broad substrate scope and several functional groups and heteroaromatics can be integrated into the ketoester backbone in generally good yields with maintained stereoselectivity. The reaction protocol is robust and scalable. The starting materials are inexpensive and the products can be obtained after simple filtration, avoiding solvent-demanding chromatography. Furthermore, the IL can be recycled up to 5 times without any loss of reactivity. Moreover, the 1,6-ketoester end product is a potent gelator in several hydrocarbon based solvents. The method enables rapid access to and evaluation of a new class of low molecular weight gelators (LMWGs) from recyclable and inexpensive starting materials.
Introduction
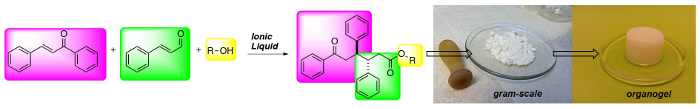
(Ci-dessus) de la synthèse à trois composants de 1,6-cétoesters: une nouvelle classe de gelators de faible poids moléculaire.
Les liquides ioniques (ILS) ont une stabilité élevée, une faible volatilité, ininflammabilité et ont donc rendu l'attention que les médias de réaction sûrs et solvants idéaux pour le recyclage. 1-3 imidazoliums dialkyle sont un certain type de liquides ioniques qui, en présence d'une base , peut être déprotoné de rendre un carbène N-hétérocyclique (NHC). 4 Dans le domaine de organocatalyse, NHC, opérant sous les chemins de réaction distinctes, ont trouvé l'utilisation répandue dans un large éventail de réactions génériques. 5-11
Malgré cela, la connexion entre ILS et liaison CC forming NHC-catalyse est relativement inexploré. Néanmoins, NHC dérivé de ILs ont été rapportés pour catalyser les réactions de formation de liaison CC tels que la condensation de la benzoïne et le mélange réactionnel 12 à 22 Stetter Par exemple., Davis et al. Ont montré que les dérivés de LMG thiazoliums N-alkyl servent de pré-catalyseurs dans la formation de benjoin du benzaldéhyde. 12
Plus récemment, Chen et coll ce concept élargi au moyen d'un imidazolium basé IL, 1-éthyl-3-méthyl imidazolium acétate (EMIMAc), pour effectuer la condensation de la benzoïne, le 5-hydroxyméthylfurfural (HMF) pour produire 5,5 '-di (hydroxyméthyl) furoin (DHMF). Étant donné que 23 ILs sont commercialement disponibles et offrent un moyen peu coûteux de générer NHC, nous nous sommes intéressés à enquêter sur ce que les autres types de réactions ILs peuvent accomplir. À cette fin, nous avons constaté que les imidazoliums dialkyle peuvent être utilisés efficacement en tant que pré-catalyseurs dans le conjugué formel additisur des aldéhydes insaturés à chalcones (figure 1) en donnant 1,6-cétoesters. L'IL plus efficace, EMIMAc, favorise une réaction très stéréosélective entre cinnamaldehyde et chalcone. La réaction se produit avec une forte préférence pour la lutte contre les diastéréo-isomère et 1,6-cétoesters peut être isolé avec des rendements allant jusqu'à 92%. 24,25,26
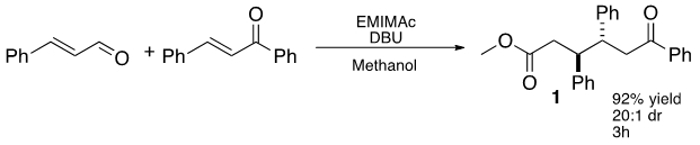
Figure 1: IL-médiée à trois composants, l'addition stéréosélective d'aldéhyde cinnamique pour la chalcone.
Protocol
Representative Results
Discussion
Sur la base de l'anticorps anti configuration a déterminé par analyse aux rayons X de cétoester 3 et sur l'enquête mécaniste proposé par Bode et ses collaborateurs 30 le chemin réactionnel suivant est proposé (Figure 5). Déprotonation de l'IL génère espèces NHC; le NHC réagit avec l'aldéhyde insaturé pour former l'intermédiaire Breslow Breslow I. L'intermédiaire et le chalcone réagir dans une réaction croisée benjoin pour former dièn…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We gratefully acknowledge the Swedish Research Council Formas for generous financial support.
Materials
| 1-ethyl-3-methyl imidazolium acetate | Aldrich | 51053-100G-F | Produced by BASF ≥90%, dried on a rotary evaporated before use (10 mBar, 40 °C, 1h) CAS NUMBER: 143314-17-4 |
| 1,3-diphenyl-2-propen-1-one | Aldrich | 11970-100G | 98.0% CAS NUMBER: 94-41-7 |
| trans-cinnamaldehyde | Aldrich | C80687-25G | 99%, stored under nitrogen prior to use CAS NUMBER: 14371-10-9 |
| 1,8-Diazobicyclo[5.4.0]undec-7-ene | Aldrich | 139009-25G | 98% CAS NUMBER: 6674-22-2 |
| Methanol | Sigma-Aldrich | 32213N-2.5L | puriss. P.a., ACS reagent, reag. ISO, reag. Ph. Eur. ≥99.8% (GC) CAS NUMBER: 67-56-1 |
| Dichloromethane | Fischer Chemical | D/1852/17X | Analytic reagent grade, stabilized with amylene CAS NUMBER:9/2/1975 |
| n-Heptane | Fischer Chemical | H/0160/17X | Analytic reagent grade CAS NUMBER: 142-82-5 |
References
- Hallett, J. P., Welton, T. Room-Temperature Ionic Liquids: Solvents for Synthesis and Catalysis. 2. Chem. Rev. 111, 3508-3576 (2011).
- Welton, T. Room-Temperature Ionic Liquids. Solvents for Synthesis and Catalysis. Chem. Rev. 99, 2071-2084 (1999).
- Vora, H. U., Wheeler, P., Rovis, T. Exploiting acyl and enol azolium intermediates via N-hetero- cyclic carbene-catalyzed reactions of α-reducible aldehydes. Adv. Synth. Catal. 354, 1617-1639 (2012).
- Holloczki, O., et al. Carbenes in ionic liquids. New J. Chem. 34, 3004-3009 (2010).
- Enders, D., Balensiefer, T. Nucleophilic Carbenes in Asymmetric Organocatalysis. Acc. Chem. Res. 37, 534-541 (2004).
- Enders, D., Niemeier, O., Henseler, A. Organocatalysis by N-Heterocyclic Carbenes. Chem. Rev. 107, 5606-5655 (2007).
- List, B. Enamine Catalysis Is a Powerful Strategy for the Catalytic Generation and Use of Carbanion Equivalents. Acc. Chem. Res. 37, 548-557 (2004).
- Nair, V., Bindu, S., Sreekumar, V. N-Heterocyclic carbenes: Reagents, not just ligands!. Angew. Chem. Int. Ed. 43, 5130-5135 (2004).
- Marion, N., Dìez-González, S., Nolan, S. P. N-Heterocyclic Carbenes as Organocatalysts. Angew. Chem. Int. Ed. 46, 2988-3000 (2007).
- Biju, A. T., Kuhl, N., Glorius, F. Extending NHC-Catalysis: Coupling Aldehydes with Unconventional Reaction Partners. Acc. Chem. Res. 44, 1182-1195 (2011).
- Bugaut, X., Glorius, F. Organocatalytic umpolung: N-heterocyclic carbenes and beyond. Chem. Soc. Rev. 41, 3511-3522 (2012).
- Davis, h. j., Forrester, K. J. Thiazolium-ion based organic ionic liquids (OILs).1,2 Novel OILs which promote the benzoin condensation. Tetrahedron Lett. 40, 1621-1622 (1999).
- Xu, L. -. W., Gao, Y., Yin, J. -. J., Li, L., Xia, C. -. G. Efficient and mild benzoin condensation reaction catalyzed by simple 1-N-alkyl-3-methylimidazolium salts. Tetrahedron Lett. 46, 5317-5320 (2005).
- Jiang, F. S., Yu, H., Gao, G., Xie, R. G. Benzoin condensation in imidazolium based room-temperature ionic liquids. Chin. Chem. Lett. 16, 321-324 (2005).
- Estager, J., Lévêque, J. M., Turgis, R., Draye, M. Solventless and swift benzoin condensation catalyzed by 1-alkyl-3-methylimidazolium ionic liquids under microwave irradiation. J. Mol. Catal. A: Chem. 256, 261-264 (2006).
- Estager, J., Lévêque, J. -. M., Turgis, R., Draye, M. Neat benzoin condensation in recyclable room-temperature ionic liquids under ultrasonic activation. Tetrahedron Lett. 48, 755-759 (2007).
- Orsini, M., Chiarotto, I., Elinson, M. N., Sotgiu, G., Inesi, A. Benzoin condensation in 1,3-dialkylimidazolium ionic liquids via electrochemical generation of N-heterocyclic carbene. Electrochem. Commun. 11, 1013-1017 (2009).
- Dunn, M. H., Cole, M. L., Harper, J. B. Effects of an ionic liquid solvent on the synthesis of [gamma]-butyrolactones by conjugate addition using NHC organocatalysts. RSC Advances. 2, 10160-10162 (2012).
- Kelemen, Z., Holloczki, O., Nagy, J., Nyulaszi, L. An organocatalytic ionic liquid. Org. Biomol. Chem. 9, 5362-5364 (2011).
- Yu, F. -. L., Zhang, R. -. L., Xie, C. -. X., Yu, S. -. T. Synthesis of thermoregulated phase-separable triazolium ionic liquids catalysts and application for Stetter reaction. Tetrahedron. 66, 9145-9150 (2010).
- Aupoix, A., Vo-Thanh, G. Solvent-free synthesis of alkylthiazolium-based ionic liquids and their use as catalysts in the intramolecular Stetter reaction. Synlett. , 1915-1920 (2009).
- Yu, F. -. L., Jiang, J. -. J., Zhao, D. -. M., Xie, C. -. X., Yu, S. -. T. Imidazolium chiral ionic liquid derived carbene-catalyzed conjugate umpolung for synthesis of [gamma]-butyrolactones. RSC Advances. 3, 3996-4000 (2013).
- Liu, D., Zhang, Y., Chen, E. Y. X. Organocatalytic upgrading of the key biorefining building block by a catalytic ionic liquid and N-heterocyclic carbenes. Green Chem. 14, 2738-2746 (2012).
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H. Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20, 13889-13893 (2014).
- Nair, V., et al. Nucleophilic Heterocyclic Carbene Catalyzed Annulation of Enals to Chalcones in Methanol: A Stereoselective Synthesis of Highly Functionalized Cyclopentanes. Org. Lett. 11, 2507-2510 (2009).
- Ma, J., Huang, Y., Chen, R. N-Heterocyclic carbene-catalyzed (NHC) three-component domino reactions: highly stereoselective synthesis of functionalized acyclic ϵ-ketoesters. Org. Biomol. Chem. 9, 1791-1798 (2011).
- Domingo, L. R., Saez, J. A., Arno, M. A DFT study on the NHC catalysed Michael addition of enols to α,β-unsaturated acyl-azoliums. A base catalysed C-C bond-formation step. Org. Biomol. Chem. 12, 895-904 (2014).
- Kaeobamrung, J., Mahatthananchai, J., Zheng, P., Bode, J. W. An Enantioselective Claisen Rearrangement Catalyzed by N-Heterocyclic Carbenes. J. Am. Chem. Soc. 132, 8810-8812 (2010).
- Zweep, N., van Esch, J. H. . Functional Molecular Gels. , 1-29 (2014).
- Chiang, P. -. C., Kaeobamrung, J., Bode, J. W. Enantioselective, Cyclopentene-Forming Annulations via NHC-Catalyzed Benzoin−Oxy-Cope Reactions. J. Am. Chem. Soc. 129, 3520-3521 (2007).

