이온 성 액체에 의해 매개 1,6- Ketoesters의 높은 입체 선택적 합성 : 저 분자량 젤 레이터의 새로운 클래스에 빠른 액세스를 가능하게하는 3 요소 반응
Summary
Ionic liquids (ILs) mediate fast, simple and cheap access to 1,6-ketoesters in high diastereoselectivities and good yields. The reaction protocol is robust and the 1,6-ketoesters can be obtained in gram scale after a simple filtration protocol. Moreover, the 1,6-ketoesters are potent gelators in hydrocarbon solvents.
Abstract
In organic chemistry ionic liquids (ILs) have emerged as safe and recyclable reaction solvents. In the presence of a base ILs can be deprotonated to form catalytically active N-Heterocyclic Carbenes (NHCs). Here we have used ILs as precatalysts in the addition of α,β-unsaturated aldehydes to chalcones to form 1,6-ketoesters, incorporating an anti-diphenyl moiety in a highly stereoselective fashion. The reaction has a broad substrate scope and several functional groups and heteroaromatics can be integrated into the ketoester backbone in generally good yields with maintained stereoselectivity. The reaction protocol is robust and scalable. The starting materials are inexpensive and the products can be obtained after simple filtration, avoiding solvent-demanding chromatography. Furthermore, the IL can be recycled up to 5 times without any loss of reactivity. Moreover, the 1,6-ketoester end product is a potent gelator in several hydrocarbon based solvents. The method enables rapid access to and evaluation of a new class of low molecular weight gelators (LMWGs) from recyclable and inexpensive starting materials.
Introduction
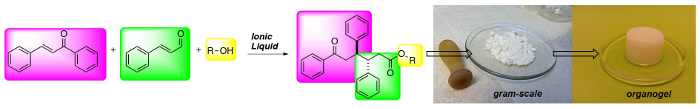
(위) 1,6- ketoesters의 3 성분계 합성 : 저 분자량 젤 레이터의 새로운 클래스.
이온 성 액체 (ILS)의 높은 안정성, 낮은 휘발성, 비 – 가연성을 가지므로 재활용 안전한 반응 매체와 이상적인 용매로서 관심을 표현하고있다. 1-3 디 알킬 imidazoliums은 이온 성 액체의 특정 유형임을, 염기의 존재하에 , organocatalysis의 분야에서 N- 헤테로 카르 벤 (NHC). (4)을 렌더링하기 위해 탈 수있는, NHCs, 서로 다른 반응 경로에서 작동, 일반적인 반응의 넓은 범위에서 광범위하게 사용을 발견했다. 5-11
그럼에도 불구하고, 대한 IL 및 CC 결합 formin 사이의 연결G NHC-촉매는 상대적으로 미개척입니다. 그럼에도 불구하고, IL을으로부터 유도 NHCs 그러한 벤조 축합 STETTER 반응으로 형성 반응 CC 결합을 촉진하는 것으로보고되고있다. 예를 들어 12-22, 데이비스 외. N – 알킬 thiazoliums로부터 유도의 IL이있는 precatalysts 역할을 보여 주었다 벤즈알데히드로부터 형성 벤조. 12
최근 첸과 동료 IL 기반 졸리움을 사용하여 이러한 개념을 확장, 1- 에틸 -3- 메틸이 미다 졸륨 아세테이트 (EMIMAc) '5,5 생성 5- hydroxymethylfurfural (HMF)에 벤조 축합을 수행하는 디 대한 IL 상업적으로 사용할 수 있으며, NHCs을 생성하는 저렴한 방법을 제공하는 점을 감안 (히드 록시 메틸) furoin (DHMF). (23), 우리는 반응에 대한 IL의 다른 유형 수행 할 수있는 것을 조사에 관심이 있었다. 이를 위해, 디 알킬 imidazoliums 효율적 공식 공액 additi에 precatalysts로서 사용될 수 있다는 것을 발견불포화 알데히드에 1,6- ketoesters을주는 칼콘 (그림 1)에. 가장 효율적인 IL, EMIMAc는 신남 및 칼콘 사이 높은 입체 선택적 반응을 촉진한다. 반응은 안티 -diastereomer에 대한 높은 선호도 발생 및 1,6- ketoesters은 최대 92 % 수율로 분리 할 수있다. 24,25,26
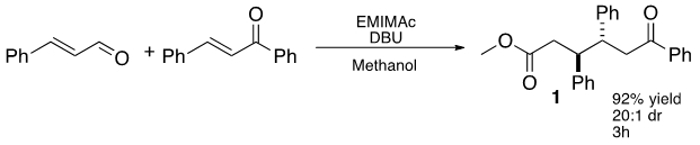
그림 1 : 세 가지 구성 요소, 칼콘에 신남의 입체 추가 IL-매개.
Protocol
Representative Results
Discussion
케토 에스테르 (3)의 X 선 분석 및 보데 및 동료 (30)에 의해 제안 된 기전 조사하여 결정 안티 배위에 기초하기 반응 경로는 (도 5)를 제안한다. IL의 탈 양성자는 NHC 종을 생성; NHC는 Breslow 중간 I. Breslow 중간체 형성하는 불포화 알데히드와 반응은 칼콘 디엔 II를 형성하도록 상호 벤조 반응에서 반응한다. 중급 II는 안티 지향 입체 센터 III를 설정, 보트 전이 상태 (TS)…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We gratefully acknowledge the Swedish Research Council Formas for generous financial support.
Materials
| 1-ethyl-3-methyl imidazolium acetate | Aldrich | 51053-100G-F | Produced by BASF ≥90%, dried on a rotary evaporated before use (10 mBar, 40 °C, 1h) CAS NUMBER: 143314-17-4 |
| 1,3-diphenyl-2-propen-1-one | Aldrich | 11970-100G | 98.0% CAS NUMBER: 94-41-7 |
| trans-cinnamaldehyde | Aldrich | C80687-25G | 99%, stored under nitrogen prior to use CAS NUMBER: 14371-10-9 |
| 1,8-Diazobicyclo[5.4.0]undec-7-ene | Aldrich | 139009-25G | 98% CAS NUMBER: 6674-22-2 |
| Methanol | Sigma-Aldrich | 32213N-2.5L | puriss. P.a., ACS reagent, reag. ISO, reag. Ph. Eur. ≥99.8% (GC) CAS NUMBER: 67-56-1 |
| Dichloromethane | Fischer Chemical | D/1852/17X | Analytic reagent grade, stabilized with amylene CAS NUMBER:9/2/1975 |
| n-Heptane | Fischer Chemical | H/0160/17X | Analytic reagent grade CAS NUMBER: 142-82-5 |
References
- Hallett, J. P., Welton, T. Room-Temperature Ionic Liquids: Solvents for Synthesis and Catalysis. 2. Chem. Rev. 111, 3508-3576 (2011).
- Welton, T. Room-Temperature Ionic Liquids. Solvents for Synthesis and Catalysis. Chem. Rev. 99, 2071-2084 (1999).
- Vora, H. U., Wheeler, P., Rovis, T. Exploiting acyl and enol azolium intermediates via N-hetero- cyclic carbene-catalyzed reactions of α-reducible aldehydes. Adv. Synth. Catal. 354, 1617-1639 (2012).
- Holloczki, O., et al. Carbenes in ionic liquids. New J. Chem. 34, 3004-3009 (2010).
- Enders, D., Balensiefer, T. Nucleophilic Carbenes in Asymmetric Organocatalysis. Acc. Chem. Res. 37, 534-541 (2004).
- Enders, D., Niemeier, O., Henseler, A. Organocatalysis by N-Heterocyclic Carbenes. Chem. Rev. 107, 5606-5655 (2007).
- List, B. Enamine Catalysis Is a Powerful Strategy for the Catalytic Generation and Use of Carbanion Equivalents. Acc. Chem. Res. 37, 548-557 (2004).
- Nair, V., Bindu, S., Sreekumar, V. N-Heterocyclic carbenes: Reagents, not just ligands!. Angew. Chem. Int. Ed. 43, 5130-5135 (2004).
- Marion, N., Dìez-González, S., Nolan, S. P. N-Heterocyclic Carbenes as Organocatalysts. Angew. Chem. Int. Ed. 46, 2988-3000 (2007).
- Biju, A. T., Kuhl, N., Glorius, F. Extending NHC-Catalysis: Coupling Aldehydes with Unconventional Reaction Partners. Acc. Chem. Res. 44, 1182-1195 (2011).
- Bugaut, X., Glorius, F. Organocatalytic umpolung: N-heterocyclic carbenes and beyond. Chem. Soc. Rev. 41, 3511-3522 (2012).
- Davis, h. j., Forrester, K. J. Thiazolium-ion based organic ionic liquids (OILs).1,2 Novel OILs which promote the benzoin condensation. Tetrahedron Lett. 40, 1621-1622 (1999).
- Xu, L. -. W., Gao, Y., Yin, J. -. J., Li, L., Xia, C. -. G. Efficient and mild benzoin condensation reaction catalyzed by simple 1-N-alkyl-3-methylimidazolium salts. Tetrahedron Lett. 46, 5317-5320 (2005).
- Jiang, F. S., Yu, H., Gao, G., Xie, R. G. Benzoin condensation in imidazolium based room-temperature ionic liquids. Chin. Chem. Lett. 16, 321-324 (2005).
- Estager, J., Lévêque, J. M., Turgis, R., Draye, M. Solventless and swift benzoin condensation catalyzed by 1-alkyl-3-methylimidazolium ionic liquids under microwave irradiation. J. Mol. Catal. A: Chem. 256, 261-264 (2006).
- Estager, J., Lévêque, J. -. M., Turgis, R., Draye, M. Neat benzoin condensation in recyclable room-temperature ionic liquids under ultrasonic activation. Tetrahedron Lett. 48, 755-759 (2007).
- Orsini, M., Chiarotto, I., Elinson, M. N., Sotgiu, G., Inesi, A. Benzoin condensation in 1,3-dialkylimidazolium ionic liquids via electrochemical generation of N-heterocyclic carbene. Electrochem. Commun. 11, 1013-1017 (2009).
- Dunn, M. H., Cole, M. L., Harper, J. B. Effects of an ionic liquid solvent on the synthesis of [gamma]-butyrolactones by conjugate addition using NHC organocatalysts. RSC Advances. 2, 10160-10162 (2012).
- Kelemen, Z., Holloczki, O., Nagy, J., Nyulaszi, L. An organocatalytic ionic liquid. Org. Biomol. Chem. 9, 5362-5364 (2011).
- Yu, F. -. L., Zhang, R. -. L., Xie, C. -. X., Yu, S. -. T. Synthesis of thermoregulated phase-separable triazolium ionic liquids catalysts and application for Stetter reaction. Tetrahedron. 66, 9145-9150 (2010).
- Aupoix, A., Vo-Thanh, G. Solvent-free synthesis of alkylthiazolium-based ionic liquids and their use as catalysts in the intramolecular Stetter reaction. Synlett. , 1915-1920 (2009).
- Yu, F. -. L., Jiang, J. -. J., Zhao, D. -. M., Xie, C. -. X., Yu, S. -. T. Imidazolium chiral ionic liquid derived carbene-catalyzed conjugate umpolung for synthesis of [gamma]-butyrolactones. RSC Advances. 3, 3996-4000 (2013).
- Liu, D., Zhang, Y., Chen, E. Y. X. Organocatalytic upgrading of the key biorefining building block by a catalytic ionic liquid and N-heterocyclic carbenes. Green Chem. 14, 2738-2746 (2012).
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H. Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20, 13889-13893 (2014).
- Nair, V., et al. Nucleophilic Heterocyclic Carbene Catalyzed Annulation of Enals to Chalcones in Methanol: A Stereoselective Synthesis of Highly Functionalized Cyclopentanes. Org. Lett. 11, 2507-2510 (2009).
- Ma, J., Huang, Y., Chen, R. N-Heterocyclic carbene-catalyzed (NHC) three-component domino reactions: highly stereoselective synthesis of functionalized acyclic ϵ-ketoesters. Org. Biomol. Chem. 9, 1791-1798 (2011).
- Domingo, L. R., Saez, J. A., Arno, M. A DFT study on the NHC catalysed Michael addition of enols to α,β-unsaturated acyl-azoliums. A base catalysed C-C bond-formation step. Org. Biomol. Chem. 12, 895-904 (2014).
- Kaeobamrung, J., Mahatthananchai, J., Zheng, P., Bode, J. W. An Enantioselective Claisen Rearrangement Catalyzed by N-Heterocyclic Carbenes. J. Am. Chem. Soc. 132, 8810-8812 (2010).
- Zweep, N., van Esch, J. H. . Functional Molecular Gels. , 1-29 (2014).
- Chiang, P. -. C., Kaeobamrung, J., Bode, J. W. Enantioselective, Cyclopentene-Forming Annulations via NHC-Catalyzed Benzoin−Oxy-Cope Reactions. J. Am. Chem. Soc. 129, 3520-3521 (2007).

