En Endothelial Planar Cell Model for Imaging Immunologisk Synapse Dynamics
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
Adaptiv immunitet er reguleret af dynamiske interaktioner mellem T-celler og antigen-præsenterende celler (APC'er) benævnt »immunologiske synapser«. Inden for disse intime celle-celle grænseflader diskrete sub-cellulære klynger af MHC / Ag-TCR, F-actin, vedhæftning og signalmolekyler dannes og remodel hurtigt. Disse dynamikker menes at være kritiske determinanter for både effektiviteten og kvaliteten af de immunreaktioner, der udvikler og derfor beskyttende versus patologisk immunitet. Nuværende forståelse af immunologiske synapser med fysiologisk APC'er er begrænset af den utilstrækkelige opnåelige imaging opløsning. Selvom kunstigt substrat modeller (f.eks plane lipiddobbeltlag) tilbyder fremragende opløsning og har været yderst værdifulde værktøjer, er de i sagens natur ikke-fysiologiske og forsimplede. Vaskulære og lymfeendotelceller er dukket op som en vigtig perifere væv (eller stromale) rum af 'semi-professional APC'erne «. Disse APC'er (som udtrykker det meste af molekylære maskineri professionelle APC'er) har den unikke egenskab at danne næsten plane celleoverfladen og er let transficerbare (f.eks med fluorescerende protein reportere). Heri en grundlæggende tilgang til at gennemføre endothelceller som en roman og fysiologisk 'plane cellulære APC model "for forbedret billeddannelse og forhør af fundamentale antigene signaleringsprocesser blive beskrevet.
Introduction
T-lymfocytter er en gren af det adaptive immunsystem kendetegnet ved evnen til effektivt at genkende peptidantigen (Ag) bundet til major histocompatibility complex (MHC) molekyler gennem deres T-cellereceptorer (TCR'er) 1. Naive lymfocytter konstitutivt migrere og scanne faglige Ag celler '(APC'er; f.eks dendritiske celler) inden lymfeknuder, mens hukommelsen / effektor T-celler har brug for effektivt at overskue en meget bred vifte af APC og potentielle målceller inden perifere væv.
I min efter første indregning af beslægtet Ag på en APC, lymfocytter arrestere deres migration og begynder at danne en specialiseret intim celle-celle-interface betegnes "immunologisk synapse" (IS). Vedvarende (dvs. 30-60 min) kontakter er forpligtet til at forstærke og fastholde signalering 2-7 IS. Nye undersøgelser identificere, at inden for IS, er den kontinuerlige dannelse og hurtig remodeling af diskrete sub-cellulær signalering mikro-klynger (dvs. indeholdende MHC / Ag-TCR, F-actin, vedhæftning og signalmolekyler), der bestemmer styrken og kvaliteten af resulterende immunreaktioner 2-7. Dog er dynamiske detaljer og reguleringsmekanisme af denne proces ufuldstændigt forstået 8,9. Dette skyldes i høj grad fra de tekniske udfordringer forbundet med uregelmæssige topologier af APC overflader og dårligt kontrolleret orientering af celle-celle interaktion fly, spørgsmål, dybt begrænser den nødvendige Spatiotemporal billeddannelse nærmer 8-10 (Figure1A).
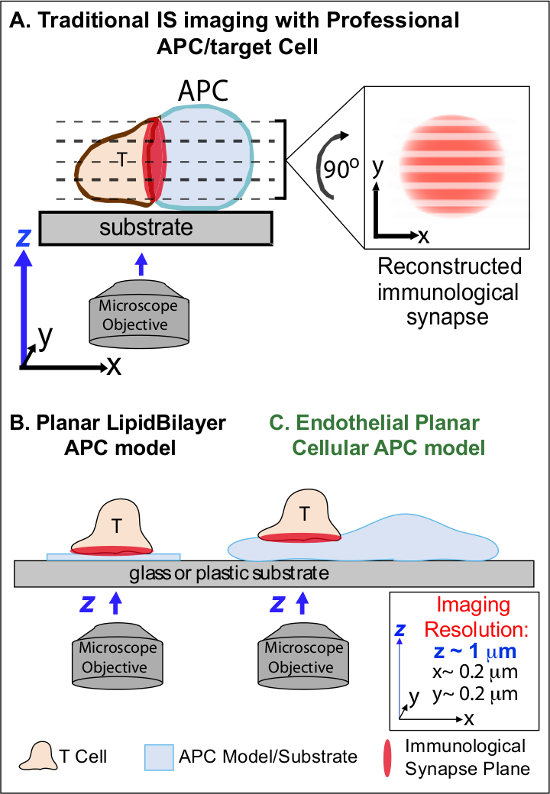
Figur 1. Et Fysiologisk Planar Cell APC Model for Imaging Immunologisk Synapse Dynamics. Den skematiske illustrerer traditionelle billeddannelse af immunologisk synapser mellem en T-celle og en professio udg APC (A) og T-celle og en traditionel plane lipiddobbeltlag APC model (B) i forhold til denne nye endotel plane APC model (C). Professionelle APC'er giver fysiologiske immunologiske synapser men tilbyder dårligt orienteret celle-celle-grænseflade (dvs. med hensyn til den optimale xy afbildningsplanet, opløsning ~ 0,2 um), som dramatisk kompromitterer rumlige (z billedplanet opløsning ~ 1 um) og tidsmæssige (dvs. på grund af behovet for gentagne gange at scanne gennem alle z imaging fly) opløsning på billeddannelse. Dobbeltlag modeller har en plan topologi, der giver optimal Spatiotemporal billedbehandling opløsning, men er også meget forenklet, ikke-fysiologiske og stive. Denne endotelcelle model kombinerer den plane topologi lipiddobbeltlag med fysiologisk substrat af en klassisk APC til at levere en optimal rumlig og tidsmæssig opløsning billeddannelse i et fysiologisk miljø.m / filer / ftp_upload / 53288 / 53288fig1large.jpg "target =" _ blank "> Klik her for at se en større version af dette tal.
Tidligere arbejde har delvist omgås disse hindringer ved at udvikle plane modeller (dvs. lipiddobbeltlag og antistof-coatede overflader), som giver optimal spatiotemporale opløsning (dvs. via fastsættelse af T-celleaktivering overflade i en enkelt plan, der er parallelt med den optimale xy imaging fly) 11-15 (figur 1B). Disse modeller har lettet vigtig indsigt i de subcellulære / molekylær dynamik, der styrer antigen signalering i T-celler, herunder opdagelsen af dynamiske actin / TCR signalering mikro-klynger 7,11-14. Imidlertid er sådanne modeller iboende oversimplificeres, samt stive (hinder udvikling / studie af 3-dimensionelle topologiske træk) (figur 1B). Derfor er det fortsat usikkert, hvordan at relatere sådanne resultater til grafisiologic celle-celle immunovervågning.
Men stadig dublerede er vaskulære og lymfatiske endotelceller fremstår som en stor (dvs. større i antal end alle professionelle APC'er, ved ~ 1000 gange) perifere rum af 'semi-professionelle "APC'er 16-18. Disse celler udtrykker MHC-I-, II- MHC-og et væld af co-stimulator molekyler (f.eks CD40, LFA3, ICOSL, 4-1 BB, OX40L, TL1A, PD-L1, men ikke CD80 og CD86), og er strategisk placeret ved blod-vævsgrænsefladen hvor de tjener specialiserede sentinel funktioner 16-18. Tidligere undersøgelser viste, at endotelceller effektivt kan re-stimulere effektor / hukommelse, men ikke naive, T-celler 19-25. Således spiller sandsynligvis unikke APC roller i effektorfasen af adaptive immunresponser inden for de perifere væv, såsom lokal indflydelse på T-celleaktivering, differentiering, hukommelse og tolerance 16,17,26 endotelceller. Critisk, når der dyrkes in vitro, endotelceller danner næsten plane celleoverflader og er let transficerbare (f.eks med fluorescerende protein reportere). Disse funktioner er ideelle til høj Spatiotemporal opløsning billeddannelse af topologiske dynamik under celle-celle interaktioner 19,27. Således endotelceller kunne tjene som en fysiologisk 'plane cellulære APC' model udpræget egnet til undersøgelse af de subcellulære / molekylære mekanismer remodeling som driver antigen-genkendelse og regulerer responser (figur 1C) 19,20.
Tidligere konstaterede komplementære billeddannelsesteknikker (herunder transfektion af endotel celler med fluorescerende protein skaberne af plasmamembranen og cytosol) for at studere detaljerne i leukocyt-endotel interaktion under adhæsion og transendotelial migration 27, viste, at leukocytter aktivt sonde overfladen af endotel ved dynamisk indsættelse af end tilbagetrækning af sub-micron-skala, actin-rige cylindriske fremspring (200-1000 nm i diameter og dybde ~) betegnes invadosome-lignende fremspring (dvs. "ILPS ') 27,28. Disse billeddannende fremgangsmåder er blevet udvidet yderligere sammen med oprettelsen af protokoller for at drage fordel af endotel APC-funktion for at udvikle de første metoder til høj spatiotemporale opløsning billeddannelse af T-celle-endothelial immunologisk synapse som rapporteret 19,20 og beskriver endvidere heri. En central konklusion stammer fra denne roman plane cellulære APC-modellen er, at T-celle efterværn fungere både i at fremme indledende Ag detektion og fastholde efterfølgende signalering. Faktisk arrays af flere efterværn (der blev stabiliseret og påløbne som reaktion på indledende calciumflux) viser berigelse i TCR og molekyler, der tyder på aktiv signalering sådan PKC-Q, ZAP-70, phosphotyrosin og HS1. Derfor synes efterværn at repræsentere et tredimensionalt fysiologisk svarer til TCR-signalering mikroklynger set i plane dobbeltlag modeller. Denne tilgang, således følsomt afslører / rapporter molekylære og arkitektoniske (og underforståede biomekaniske) dynamik ellers ikke påvises.
Den her beskrevne metode bør være nyttige for at bygge bro mellem professionelle APC og kunstige APC substrat modeller for at forbedre vores evne til at afhøre grundlæggende mekanismer i adaptive immunrespons. Mens her er fokus på aktiveringen af CD4 + Th1-typen effektor / lagercelle, kan denne grundlæggende fremgangsmåde let modificeres til at studere en bred vifte af T-celle typer og Ags, som beskrevet nedenfor.
Protocol
Representative Results
Discussion
Samlet set denne protokol beskriver metoder til undersøgelse endothelceller som i) dublerede fysiologiske APC'er og ii) som en ny form for 'plane cellulære APC model ". Med hensyn til førstnævnte, er det blevet stadig klart, at ikke-hæmatopoietiske perifere (eller "stromale ') APC'er spiller kritiske, ikke-redundante roller (dvs. sammenlignet med hæmatopoietisk APC'er) i udformningen af adaptive immunresponser 16-18. Blandt sådanne "semi-professionelle" …
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
References
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

