Um modelo de celular endotelial Planar for Imaging imunológica Synapse Dynamics
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
A imunidade adaptativa é regulada por interações dinâmicas entre as células T e células apresentadoras de antígenos ('APCs') conhecido como 'sinapses imunológicas. Dentro destas interfaces de célula-célula íntimos agrupamentos sub-celular discretas de MHC / Ag-TCR, F-actina, adesão e moléculas de sinalização formar e remodelar rapidamente. Essas dinâmicas são pensados para ser determinantes críticos tanto da eficiência e qualidade das respostas imunes que se desenvolvem e, portanto, de proteção contra a imunidade patológica. Compreensão atual das sinapses imunológicas com fisiológico APCs é limitado pela inadequação da resolução de imagem obtidos. Embora modelos substrato artificial (por exemplo, bicamadas lipídicas planas) oferecem excelente resolução e têm sido ferramentas extremamente valiosas, eles são inerentemente não-fisiológica e simplista. As células endoteliais vasculares e linfáticas surgiram como um tecido periférico importante (ou estroma) compartimento de "semi-profissãoai APCs '. Estas APCs que expressam (a maioria da maquinaria molecular de APCs profissionais) têm a característica única de formação da superfície celular praticamente plana e são facilmente transfectáveis (por exemplo, com os repórteres de proteína fluorescente). Aqui uma abordagem básica para implementar as células endoteliais como uma nova e fisiológico "planar modelo celular da APC 'para melhorar a imagiologia de interrogação e de processos fundamentais de sinalização antigénicos irá ser descrito.
Introduction
Os linfócitos T são um ramo do sistema imunitário adaptativo, caracterizado por a capacidade de reconhecer eficientemente antigénio peptídico (Ag) ligado ao complexo principal de histocompatibilidade (MHC) através dos seus receptores de células T (TCRs) 1. Linfócitos naive constitutivamente migrar e digitalizar 'Ag células apresentadoras de profissionais "(APCs; por exemplo, células dendríticas) dentro de gânglios linfáticos, enquanto as células de memória / T efetoras precisa fazer um levantamento efetivamente uma gama extremamente ampla de APCs e células alvo em potencial dentro tecidos periféricos.
Na min após o reconhecimento inicial de cognato Ag em um APC, linfócitos prender sua migração e começam a formar uma interface célula-célula íntimo especializado denominado "sinapse imunológica" (IS). Sustentada (ie, 30-60 min) É contatos são necessários para ampliar e sustentar a sinalização 2-7. Estudos emergentes identificar que no seja, é a formação contínua e rápida remodeling de micro-aglomerados discretos sinalização sub-celular (ou seja, contendo MHC / Ag-TCR, F-actina, adesão e moléculas de sinalização) que determinam a força e qualidade dos resultando respostas imunes 2-7. No entanto, detalhes dinâmicos e mecanismo de regulação deste processo são completamente compreendidas 8,9. Isso decorre, em grande parte dos desafios técnicos associados com topologias de superfícies irregulares APC e orientação mal controlada dos planos de interação célula-célula, as questões que limitam profundamente a imagem espaço-temporal requisito aproxima 8-10 (Figura 1A).
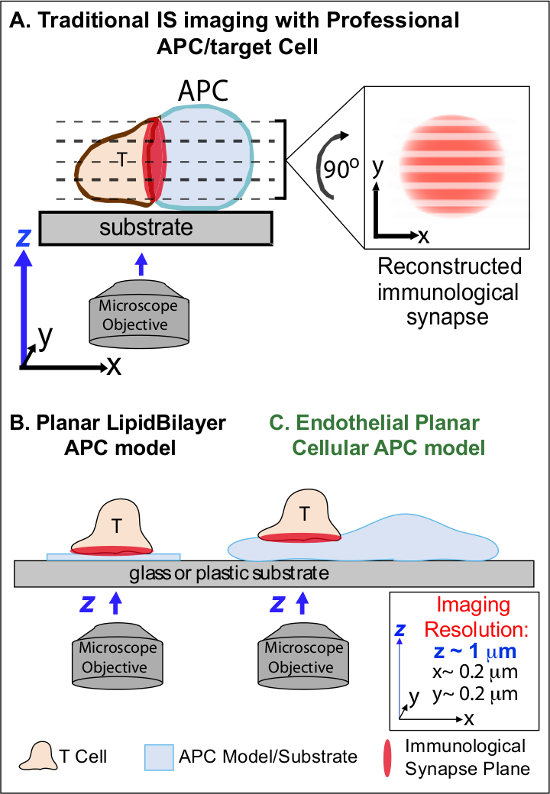
Figura 1. Um Fisiológica Planar Modelo APC celular for Imaging imunológica Synapse Dynamics. O esquema ilustra imagem tradicional da sinapse imunológica entre uma célula T e um professio nal APC (A) e de células T e um lipídicas planas modelo tradicional bicamada APC (B) em comparação com este modelo planar APC endotelial novel (C). APCs profissionais fornecer sinapses imunológicos fisiológicos, mas oferecem interface de mal orientadas célula-célula (isto é, em relação ao plano de imagem XY óptima; resolução ~ 0,2 ^ M), o que compromete dramaticamente espacial (plano de imagem z resolução ~ 1 mm) e temporal (isto é, devido à necessidade de digitalizar repetidamente através de todos os planos de imagem z) resolução de imagem. Modelos de duas camadas tem uma topologia plana que fornece melhor resolução de imagem espaço-temporal, mas também são altamente simplificado, não-fisiológica e rígida. Este modelo combina células endoteliais a topologia planar de camadas duplas lipídicas com o substrato fisiológico de um APC clássico para oferecer resolução de imagem espacial e temporal ideal em um ambiente fisiológico.m / files / ftp_upload / 53288 / "target =" _ blank 53288fig1large.jpg "> Clique aqui para ver uma versão maior desta figura.
Trabalhos anteriores contornada parcialmente estes obstáculos através do desenvolvimento de modelos de substrato planar (isto é, as bicamadas lipídicas e das superfícies revestidas com anticorpo) que fornecem resolução espaço-temporal óptimo (ou seja, através de fixação superfície a activação das células T num único plano que é paralelo ao imagiologia XY óptima avião) 11-15 (Figura 1B). Estes modelos têm facilitado importantes insights sobre a dinâmica subcelulares / molecular que controlam a sinalização antigênico nas células T, incluindo a descoberta de actina dinâmica / TCR sinalização micro-aglomerados 7,11-14. No entanto, tais modelos são inerentemente muito simplificado, assim como rígida (impedindo o desenvolvimento / estudo de características topológicas 3-dimensional) (Figura 1B). Portanto, permanece incerto como relacionar esses achados para phycélula-célula siologic vigilância imunológica.
Embora ainda pouco estudadas, vascular e células endoteliais linfáticas estão emergindo como uma grande (ou seja, maior em número do que todos os APCs profissionais, por ~ 1.000 vezes) compartimento periférico de "semi-profissional" APCs 16-18. Estas células expressam MHC-I, MHC-II e uma multiplicidade de moléculas co-estimuladoras (por exemplo, CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1, mas não CD80 e CD86) e são estrategicamente posicionada na interface de sangue-tecido onde servem funções especializadas sentinela 16-18. Estudos anteriores demonstraram que as células endoteliais podem efetivamente re-estimular efector / memória, mas não naïve, células T 19-25. Assim, as células endoteliais são susceptíveis de desempenhar papéis exclusivos da APC na fase efectora da resposta imune adaptativa no interior dos tecidos periféricos, tais como a influência local sobre a activação de células T, a diferenciação, a memória e a tolerância 16,17,26. Criticalmente, quando cultivadas in vitro, as células endoteliais formam superfícies celulares praticamente planares e estão facilmente transfectáveis (por exemplo, com os repórteres de proteína fluorescente). Estas características são ideais para imagens de alta resolução espacial e temporal da dinâmica topológica durante as interações célula-célula 19,27. Assim, as células endoteliais pode servir como um fisiológico "planar celular da APC modelo extremamente adequado para o estudo dos mecanismos de remodelação subcelulares / moleculares que conduzem o reconhecimento do antigénio e regulam as respostas (Figura 1C) 19,20.
Previamente estabelecida técnicas de imagem complementares (incluindo a transfecção de células endoteliais com fabricantes de proteína fluorescente da membrana de plasma e citossol) para estudar os detalhes da interacção de leucócitos-endotélio durante a adesão e a migração transendotelial de 27, mostraram que os leucócitos sondar activamente a superfície do endotélio por dinâmico inserção de umd retração de sub-mícron-escala, saliências cilíndricas ricas em actina (~ 200-1.000 nm de diâmetro e profundidade) denominado saliências invadosome-like (ou seja, 'ILPS') 27,28. Estas abordagens de imagem têm sido expandida, juntamente com a criação de protocolos para tirar proveito da função endotelial APC para desenvolver os primeiros métodos para imagens de alta resolução espacial e temporal da célula endotelial sinapse imunológica T como relatado 19,20 e ainda descrever aqui. Uma constatação fundamental derivado dessa modelo APC celular romance planar é que procedimentos ILP células T funcionar tanto na promoção da detecção Ag inicial e na manutenção de sinalização subsequente. Na verdade, matrizes de múltiplos procedimentos ILP (que foram estabilizados e acumulados em resposta a rubricar o fluxo de cálcio) mostram enriquecimento em TCR e moléculas de sinalização sugestivos activa, tais PKC-Q, ZAP-70, fosfotirosina e HS1. Portanto, procedimentos ILP parecem representar um equivalente fisiológico tridimensional para o micro-TCR sinalizaçãoaglomerados observados nos modelos de duas camadas planas. Esta abordagem, assim, com sensibilidade revela / relatórios dinâmica molecular e arquitetônicos (e implícitas biomecânico) de outra forma não detectável.
O método descrito aqui deve ser útil para fazer a ponte entre APC profissional e modelos artificiais de substrato APC a fim de aumentar a nossa capacidade de interrogar mecanismos básicos da resposta imune adaptativa. Embora aqui o foco é sobre a activação das células T CD4 + do tipo Th1 efector / célula de memória, esta abordagem básica pode ser facilmente modificado para estudar uma ampla gama de tipos de células T e Ags, como discutido abaixo.
Protocol
Representative Results
Discussion
No geral, este protocolo descreve métodos para a investigação de células endoteliais como i) APCs fisiológicos pouco estudado e ii) como um novo tipo de "modelo APC celular planar". Com relação ao primeiro, tornou-se cada vez mais apreciado que APCs não hematopoiéticas periférica (ou 'estromais') desempenham papéis, não redundantes críticos (ou seja, em comparação com hematopoiéticas APCs) na formulação de respostas imunes adaptativas 16-18. Entre tais "semi-p…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
References
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

