Görüntüleme İmmünoloji Synapse Dynamics için bir Endotel Hücre Modeli Düzlemsel
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
Adaptif bağışıklık, T hücreleri ve antijen sunan hücreler ("APC 'ler') arasındaki dinamik etkileşimler ile düzenlenir 'immünolojik sinaps" olarak adlandırılır. Bu samimi hücre-hücre arayüzleri içinde MHC / Ag-TCR, F-aktin, yapışma ayrık alt hücresel kümeleri ve sinyal molekülleri oluşturur ve hızla pişmanlık. Bu dinamikler, kritik verimlilik ve geliştirmek bağışıklık tepkilerinin kalitesi hem belirleyicileri ve dolayısıyla patolojik bağışıklık karşı koruyucu olması düşünülmektedir. Fizyolojik APC 'ile immünolojik sinaps mevcut anlayış elde görüntüleme çözünürlüğü yetersizliği ile sınırlıdır. Yapay alt tabaka modelleri (örneğin, düzlemsel lipid bilayers) mükemmel çözünürlük sunan ve son derece değerli araçlar olmuştur rağmen, doğal olmayan fizyolojik ve oversimplified bulunmaktadır. Vasküler ve lenfatik endotel hücreleri 'yarı mesleğinin önemli bir çevresel doku (veya stroma) bölmesi olarak ortaya çıkmıştırEl APC'ler '. (Profesyonel APC 'moleküler makinelerin çoğu ifade) Bu APC'Ier neredeyse düzlemsel hücre yüzeyini oluşturan benzersiz özelliğe sahiptir ve (floresan protein gazetecilere, gibi) kolayca transfectable vardır. Burada temel bir yaklaşım tarif edilecektir yeni ve geliştirilmiş bir görüntüleme ve temel antijenik sinyal süreçlerinin sorgulanmak üzere fizyolojik 'düzlemsel hücresel APC modeli' olarak endotel hücreleri uygulamak.
Introduction
T lenfositleri majör histokompatibilite kompleksi (MHC) bağlı verimli peptit antijeni (Ag) tanıma yeteneği ile karakterize adaptif bağışıklık sisteminin bir dalı vardır, T hücre reseptörlerinin (TCR'ler) 1 ile molekülleri. Naif lenfositler kurucu göç ve profesyonel Ag sunan hücreler '(ZPT; örneğin, dendritik hücreler) tarama bellek / efektör T hücreleri etkin bir periferik dokularda APC' ve potansiyel hedef hücrelerin son derece geniş bir yelpazede anket gerekir iken, lenf düğümleri içinde.
Bir APC üzerindeki soydaş Ag ilk muhasebeleştirilmesi aşağıdaki min, bunların göç tutuklama ve özel bir samimi hücre-hücre arayüzü olarak adlandırılan 'immünolojik sinaps' oluşmaya başlar lenfosit (IS). Sürekli (yani 30-60 dk) temas yükseltmek ve 2-7 sinyalizasyon sürdürmek için gerekli olan IS. Gelişmekte olan çalışmalar IS içinde, sürekli oluşumu ve hızlı r olduğunu tespitgücü ve immün yanıtları 2-7 sonuçlanan kalitesini belirlemek (örneğin, MHC / Ag-TCR, F-aktin, yapışma ve sinyal molekülleri içeren) ayrık alt hücresel sinyal mikro-kümelerin emodeling. Ancak, bu sürecin dinamik detaylar ve düzenleyici mekanizma tam olarak 8,9 anlaşılmaktadır. Bu son derece gerekli zamanmekansal görüntüleme sınırı APC yüzeylerin düzensiz topolojileri ve hücre-hücre etkileşimi uçakları kötü kontrollü yönlendirme, sorunları ile ilgili teknik zorlukları büyük ölçüde kaynaklanmaktadır 8-10 (Figure1A) yaklaşır.
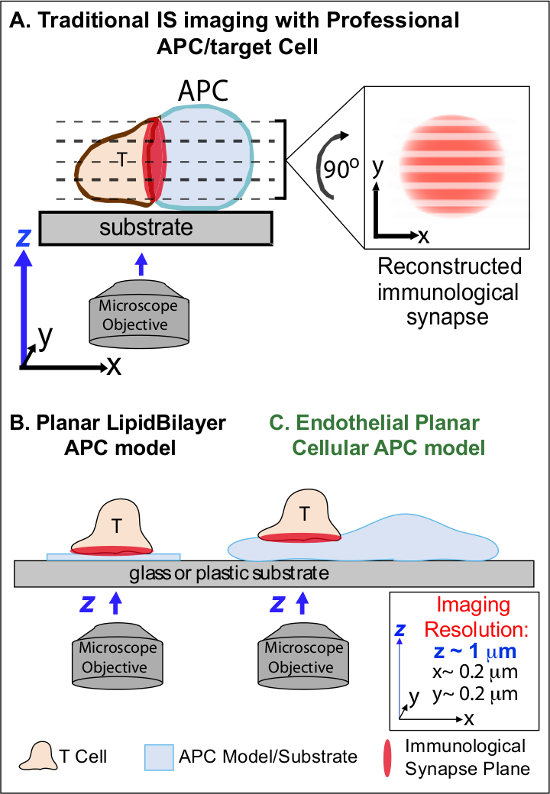
Görüntüleme İmmünoloji Synapse Dynamics Şekil 1. Fizyolojik Planar hücre APC Modeli. Şematik bir T hücresi ve professio arasındaki immünolojik sinaps geleneksel görüntüleme göstermektedir nal APC (A) ve T hücresi ve bu yeni endotel düzlemsel APC modelinde (C) ile karşılaştırıldığında, geleneksel bir düzlemsel lipid iki katmanlı APC modeli (B). , Dramatik, yani mekansal (z görüntüleme düzey çözünürlük ~ 1 mikron) ve temporal (ödün; Profesyonel ZPT fizyolojik immünolojik sinaps sağlar, ancak (çözünürlük ~ 0.2 mikron Optimum xy görüntüleme düzlemine göre yani) kötü amaçlı hücre-hücre arabirimi sunar ihtiyacı nedeniyle defalarca görüntüleme çözünürlüğü) tüm z görüntüleme uçakları ile tarayın. Iki tabakalı modelleri Optimal zamanmekansal görüntüleme çözünürlüğü sağlar düzlemsel topoloji var, ama aynı zamanda son derece, fizyolojik olmayan ve sert basitleştirilmiştir. Bu endotel hücre modeli fizyolojik bir ortamda optimum mekansal ve zamansal görüntüleme çözünürlüğü sağlamak için klasik bir APC fizyolojik substrat ile lipit bilayers düzlemsel topolojisini birleştirir.m / files / ftp_upload / 53288 / 53288fig1large.jpg "target =" _ blank "> bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Önceki çalışma kısmen uygun xy görüntüleme paralel olan tek bir planına T hücresi aktivasyonu aracılığı ile yüzey sabitleme örneğin, uygun uzaysal çözünürlük (sağlar geliştirmek düzlemsel alt-tabaka bir model (yani, lipid çift tabakaları ve antikor-kaplı yüzeyler), bu engeller etrafından olan düzlem) 11-15 (Şekil 1B). Bu modeller, dinamik aktin / TCR sinyalizasyon mikro kümelerin 7,11-14 keşif dahil olmak üzere T hücrelerinin antijenik sinyalizasyon, kontrol moleküler / hücre içi dinamikleri önemli bilgiler kolaylaştırmıştır. Bununla birlikte, bu modeller doğal basitleştirilmiş edilir, yanı sıra, katı (Şekil 1B) (3-boyutlu bir topolojik özelliklerin geliştirilmesi / çalışma engelleyen). Bu nedenle, phy böyle bulguları ilişkilendirmek nasıl belirsizdirsiologic hücre-hücre immün gözetim.
Hala understudied rağmen, damar ve lenfatik endotel hücreleri büyük olarak ortaya çıkmaktadır (yani ~ 1000 kat tüm profesyonel APC'lerce daha numaraları, daha fazla) 'yarı profesyonel' APC '16-18 periferik bölmesi. (Örneğin, CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1; fakat CD80 ve CD86) Bu hücreler, MHC-I-, MHC-II-ve ko-stimülatör moleküllerin çok sayıda dile ve stratejik olarak Onlar özel nöbetçi işlevleri 16-18 hizmet kan doku arayüzünde konumlandırılmış. Daha önceki çalışmalar, endotel hücrelerinin etkili bir efektör / bellek ama saf olmayan, T hücrelerini 19-25 yeniden stimüle edebilirler. Bu nedenle, endotelyal hücreler gibi T hücresi aktivasyonu, farklılaşması, hafıza ve tolerans 16,17,26 yerel etkisi gibi periferik dokular içinde adaptif bağışıklık tepkilerinin, efektör aşamasında özel APC rol oynaması olasıdır. Criin vitro yetiştirilen ola- rak, endotel hücreleri neredeyse düzlemsel hücre yüzeylerine formu (floresan protein muhabir olan, örneğin) kolayca transfekte bulunmaktadır. Bu özellikler, hücre-hücre etkileşimleri 19,27 sırasında topolojik dinamiklerin yüksek uzaysal çözünürlüklü görüntüleme için idealdir. Böylece endotel hücreleri tepkileri (Şekil 1C) 19,20 antijen tanıma sürücü ve düzenleyen moleküler / hücre içi biçimlenme mekanizmalarının çalışma için belirgin uygun bir fizyolojik 'düzlemsel hücresel APC' model olarak hizmet olabilir.
Daha önce yapışma ve transendoteliyal göç 27 sırasında lökosit-endotel etkileşimi detaylarını incelemek için (plazma zarı ve sitoplazmada floresan protein üreticileri ile endotelin hücrelerin transfeksiyonu dahil) tamamlayıcı görüntüleme tekniklerini kurulan lökositler aktif, dinamik tarafından endotel yüzeyine soruşturma olduğunu gösterdi Ekleme birmikronaltı ölçek d retraksiyonu, aktin-zengin silindirik çıkıntılar (~ çap ve derinlikte 200-1,000 nm) invadosome benzeri çıkıntılar (yani, 'ILPS') 27,28 olarak nitelendirdi. Bu görüntüleme yaklaşımları daha da bildirilen 19,20 olarak T hücre-endotelyal immünolojik sinaps yüksek uzaysal çözünürlüklü görüntüleme için ilk yöntemler geliştirmek endotel APC fonksiyonunun yararlanmak ve ayrıca burada açıklamak için protokollerin oluşturulması ile birlikte genişletilmiştir. Bu yeni düzlemsel hücresel APC modelinden elde edilen bir merkez bulgu T hücresi ILPS ilk Ag algılama teşvik ve sonraki sinyalizasyon sürdürülmesi hem işlev olmasıdır. Nitekim, (stabilize ve kalsiyum akı başlangıç yanıt tahakkuk eden) TCR ve aktif sinyal gibi PKC-Q, ZAP-70, fosfotirosinin ve HS1 düşündüren moleküllerde gösteri zenginleştirme birden ILPS'nin diziler. Bu nedenle, ILPS TCR-sinyal mikro üç boyutlu fizyolojik eşdeğer temsil etmek gibi görünüyordüzlemsel iki tabakalı modellerinde görülen kümeler. Bu yaklaşım, bu nedenle, hassas ortaya / raporlar, moleküler ve mimari (ve biyomekanik zımni) dinamikleri aksi saptanabilir değil.
Burada açıklanan yöntem adaptif bağışıklık tepkilerinin temel mekanizmaları sorgulamak için yeteneğimizi geliştirmek amacıyla profesyonel APC ve yapay APC substrat modelleri arasında köprü için yararlı olacaktır. Burada odaklama CD4 + efektör Th1-tipi / hafıza hücresinin aktivasyonuna iken, aşağıda ele alındığı gibi, bu temel yaklaşım, hali hazırda, T hücre türleri ve Ag'lerin geniş bir çalışma için modifiye edilebilir.
Protocol
Representative Results
Discussion
Genel olarak, bu protokol i) understudied fizyolojik APC'ler olarak endotel hücreleri soruşturma yöntemleri açıklar ve ii) 'düzlemsel hücresel APC modeli' yeni bir türü olarak. Eski ile ilgili olarak, giderek adaptif immün yanıtları 16-18 şekillenmesinde (hematopoetik APC'lerin karşılaştırıldığında, yani), periferal olmayan hematopoetik (ya da 'stromal') APC'Ier kritik olmayan gereksiz roller oynadığı takdir haline gelmiştir. Böyle 'yarı prof…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
References
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

