En Endothelial Planar Cell Modell för Imaging Immunologisk Synapse Dynamics
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
Adaptiv immunitet regleras av dynamiska interaktioner mellan T-celler och antigenpresenterande celler (APC) kallade immunologiska synapser ". Inom dessa intima gränssnitt cell-cell diskreta sub-cellulär kluster av MHC / Ag-TCR, F-aktin, vidhäftning och signalmolekyler bildar och renovera snabbt. Denna dynamik tros vara en avgörande betydelse för effektiviteten och kvaliteten på de immunsvar som utvecklar och därför skyddande kontra patologisk immunitet. Aktuell kunskap om immunologiska synapser med fysiologisk APC begränsas av otillräcklig erhållas avbildning upplösning. Även artificiella substrat modeller (t.ex. plana lipiddubbelskikt) erbjuder utmärkt upplösning och har varit mycket värdefulla verktyg, de är till sin natur icke-fysiologiska och förenklad. Vaskulära och lymfatiska endotelceller har dykt upp som en viktig perifer vävnad (eller stromaceller) fack av "semi-yrkeal APC '. Dessa APC (som uttrycker de flesta av de molekylära maskiner professionella APC) har den unika funktionen att bilda praktiskt taget plana cellytan och är lätt transfekterbara (t.ex. med fluorescerande protein reportrar). Häri en grundläggande strategi för att genomföra endotelceller som en roman och fysiologisk "plana cell APC modell" för förbättrad avbildning och förhör grundläggande antigena signalprocesser kommer att beskrivas.
Introduction
T-lymfocyter är en gren av det adaptiva immunsystemet kännetecknas av förmågan att effektivt känna igen peptidantigen (Ag) bundna till större histokompatibilitetskomplex (MHC) molekyler genom deras T-cellreceptorer (TCR) 1. Naiva lymfocyter konstitutivt migrera och skanna yrkesmässiga Ag presenterande celler "(APC, t.ex. dendritiska celler) i lymfkörtlar, medan minnet / T-celler behöver för att effektivt kartlägga ett mycket brett utbud av APC och potentiella målceller inom perifera vävnader.
I min efter första redovisningen av besläktad Ag på en APC, lymfocyter arrestera deras migration och börja bilda en specialiserad intim cell-cell-gränssnittet kallas "immunologisk synaps" (IS). Fortsatt (dvs 30-60 min) ÄR kontakter krävs för att förstärka och upprätthålla signalering 2-7. Tillväxtstudier identifiera att inom IS, är det den kontinuerliga bildningen och snabb remodeling diskreta sub-cellulära signaleringsmikrokluster (dvs innehållande MHC / Ag-TCR, F-aktin, vidhäftning och signalmolekyler) som avgör styrka och kvalitet resulterande immunsvar 2-7. Men dynamiska detaljer och regleringsmekanism i denna process ofullständigt förstått 8,9. Detta beror till stor del från tekniska utmaningar som är förknippade med oregelbundna topologier av APC ytor och dåligt kontrollerad orientering av interaktions cell-cell flygplan, frågor som i grunden begränsar den erforderliga Spatiotemporal avbildning närmar 8-10 (Figure1A).
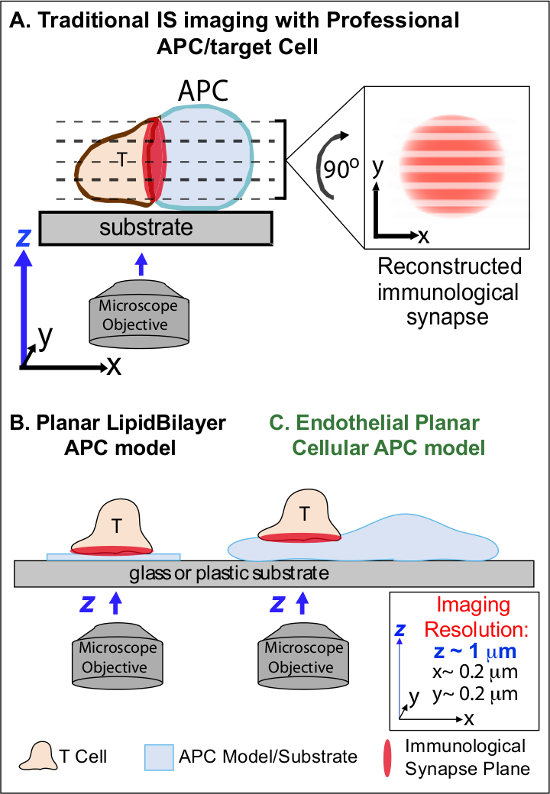
Figur 1. en fysiologisk Planar Cell APC Modell för Imaging Immunological Synapse Dynamics. Schemat visar traditionella avbildning av immunologisk synaps mellan en T-cell och en professio nella APC (A) och T-cell och en traditionell plana lipiddubbelskikt APC modell (B) i jämförelse med denna nya endotel plana APC modell (C). Professionella APC ger fysiologiska immunologiska synapser men erbjuder dåligt orienterad cell-cell-gränssnitt (det vill säga, med avseende på den optimala xy avbildningsplanet; upplösning ~ 0,2 | im), som dramatiskt äventyrar rumsliga (z avbildningsplanet upplösning ~ 1 | im) och tidsmässiga (dvs., på grund av behovet att upprepade gånger söka igenom alla z avbildningsplan) upplösning avbildning. Dubbelskikts modeller har ett plant topologi som ger optimal Spatiotemporal avbildningsupplösning, men är också mycket förenklade, icke-fysiologiska och styvt. Denna endotelceller modellen kombinerar den plana topologi lipidbiskikt med den fysiologiska substrat av ett klassiskt APC att leverera optimal rumsliga och tidsmässiga avbildning upplösning i en fysiologisk miljö.m / filer / ftp_upload / 53288 / 53288fig1large.jpg "target =" _ blank "> Klicka här för att se en större version av denna siffra.
Tidigare arbete har delvis kring dessa hinder genom utvecklings plana substratmodeller (dvs lipiddubbelskikt och antikroppsbelagda ytor) som ger optimala Spatiotemporal upplösning (dvs., via fastställande av cellaktivering ytan T till en och samma plan som är parallellt med den optimala xy avbildning planet) 11-15 (Figur 1B). Dessa modeller har underlättat viktiga insikter i de subcellulära / molekylära dynamik som styr antigen signalering i T-celler, inklusive upptäckten av dynamiska aktin / TCR signalering mikrokluster 7,11-14. Men sådana modeller inneboende förenklad, liksom stela (utgör hinder för utveckling / studie av 3-dimensionella topologiska funktioner) (Figur 1B). Därför är det osäkert hur man relatera dessa resultat till physiologic cell-cell-immunövervakning.
Men fortfarande understudied är vaskulära och lymfatiska endotelceller framstår som en stor (dvs större i antal än alla professionella APC, genom ~ 1000 gånger) periferiutrymme "halvprofessionella" APC 16-18. Dessa celler uttrycker MHC-I-, MHC-II och en mängd co-stimulator molekyler (t.ex., CD40, LFA3, ICOSL, 4-1 BB, OX40L, TL1A, PD-L1, men inte CD80 och CD86) och är strategiskt placerad vid blodvävnads gränssnitt där de tjänar specialiserade kontrollfunktionerna 16-18. Tidigare studier har visat att endotelceller kan effektivt åter stimulera effektor / minne, men inte naiva, T-celler 19-25. Sålunda endotelceller är sannolikt att spela unika APC roller i effektorfasen av adaptiva immunresponser inom de perifera vävnader, såsom lokalt inflytande på T-cellsaktivering, differentiering, minne och tolerans 16,17,26. Critiskt, när den odlas in vitro, endotelceller bildar nästan plana cellytor och är lätt transfekterbara (t.ex. med fluorescerande protein reportrar). Dessa funktioner är idealiska för hög Spatiotemporal upplösning avbildning av topologiska dynamik under cell-cell-interaktioner 19,27. Således endotelceller kan tjäna som en fysiologisk "plana cell APC modell klart lämpad för studier av de subcellulära / molekylära remodeling mekanismer som driver antigenigenkänning och reglerar svar (Figur 1C) 19,20.
Tidigare etablerade kompletterande avbildningstekniker (inklusive transfektion av endotel celler med fluorescerande protein skaparna av plasmamembranet och cytosolen) för att studera detaljerna i leukocyt-endotel interaktion under vidhäftning och transendotelial migration 27, visade att leukocyter sond aktivt yta endotel genom dynamisk insättnings end indragning av sub-micron skala, aktin rika cylindriska utsprång (~ 200-1000 nm i diameter och djup) kallas invadosome liknande utsprång (dvs "IUP) 27,28. Dessa avbildning har utökats ytterligare tillsammans med skapandet av protokoll för att dra nytta av endotel APC-funktion för att utveckla de första metoderna för hög Spatiotemporal upplösning avbildning av T-cells endothelial immunologisk synaps som rapporterats 19,20 och ytterligare beskriver häri. En central slutsats härrör från denna nya plana cellulära APC-modellen är att T-cell IUP fungera både för att främja inledande Ag upptäckt och för att upprätthålla efterföljande signalering. I själva verket, kedjor av flera IUP (som stabiliserats och upplupna som svar på initial kalciumflöde) visar anrikning i TCR och molekyler som tyder på aktiv signalering sådan PKC-Q, ZAP-70, fosfotyrosin och HS1. Därför IUP verkar representera en tre-dimensionell fysiologisk motsvarande TCR-signalering mikrokluster sett i plana dubbelskiktsmodeller. Detta tillvägagångssätt således känsligt avslöjar / rapporter molekylära och arkitektoniska (och underförstådda biomekaniska) dynamik annars inte upptäckas.
Den metod som beskrivs i detta dokument ska vara till nytta för att överbrygga klyftan mellan professionella APC och konstgjorda APC substrat modeller för att förbättra vår förmåga att förhöra grundläggande mekanismer adaptiva immunsvar. Även här ligger fokus på aktivering av CD4 + Th1-typ effektor / minnescell, kan denna grundläggande strategi lätt modifieras för att studera ett brett spektrum av T-celltyper och Ags, såsom diskuteras nedan.
Protocol
Representative Results
Discussion
Sammantaget beskriver detta protokoll metoder för att undersöka endotelceller som i) understudied fysiologiska APC och ii) som en ny typ av "plana cellulära APC-modellen". När det gäller den förstnämnda, har det blivit allt mer uppenbart att icke-hematopoetiska perifera (eller "stromala) APC spelar kritiska, icke-redundanta roller (dvs jämfört med hematopoetisk APC) i utformningen av adaptiva immunsvar 16-18. Bland sådana "halvprofessionella" APC, vaskulära och lym…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
References
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

