マイクロポストアレイ上の簡単かつ正確なメカノプロファイリング
Summary
Described are protocols for quantifying mechanical interactions between adherent cells and microstructured substrates. These interactions are closely linked to essential cell behaviors including migration, proliferation, differentiation, and apoptosis. The protocols present an open-source image analysis software called MechProfiler, which enables determination of involved forces for each micropost.
Abstract
Cell culture substrates with integrated flexible microposts enable a user to study the mechanical interactions between cells and their immediate surroundings. Particularly, cell-substrate interactions are the main interest. Today micropost arrays are a well-characterized and established method with a broad range of applications that have been published over the last decade. However, there seems to be a reservation among biologists to adapt the technique due to the lengthy and challenging process of micropost manufacture along with the lack of easily approachable software for analyzing images of cells interacting with microposts.
The force read-out from microposts is surprisingly easy. A micropost acts like a spring with the cell ideally attached at its tip. Depending on size a cell applies force from its cytoskeleton through one or multiple focal adhesion points to the micropost, thus deflecting the micropost. The amount of deflection correlates directly to the applied force in direction and in magnitude. The number of microposts covered by a cell and the post deflection patterns are characteristic and allow determination of values like force per post and many biologically relevant parameters that allow “mechano-profiling” of cell phenotypes.
A convenient method for mechano-profiling is described here combining the first generation of ready-to-use commercially available microposts with an in-house developed software package that is now accessible to all researchers. As a demonstration of typical application, single images of bone cancer cells were taken in bright-field microscopy for mechano-profiling of cell line models of metastasis. This combination of commercial traction force sensors and open source software for analysis allows for the first time a rapid implementation of the micropost array technique into routine lab work done by non-expert users. Furthermore, a robust and streamlined analysis process enables a user to analyze a large number of micropost images in a highly time-efficient manner.
Introduction
メカノ敏感な細胞ベースのアッセイは、メカニックが細胞生物学でプレーすることができます中心的な役割を反映して、幅広いアプリケーションで、接着細胞を調査することを可能にします。これらのアプリケーションは、多くの場合、細胞内プロセスまたは全細胞の挙動を駆動機序に焦点を当てています。一方、このような細胞外マトリックス組成物またはマトリックスの剛性などの外部環境要因が劇的に細胞の機械的および生物学的応答に影響を与えることができる。1同様の薬学的に活性な化合物の多くのクラスの使用後に観察することが可能である効果がそれらの多くの場合、細胞培養モデルを用いて特徴づけ、そのような自発的または実験的に誘導され、遺伝子の突然変異によって引き起こされるもののような一方の遺伝子型の性質上2を 、細胞骨格の構造および機能の変化と関連している細胞の表現型の著しい変化を誘導することができる。3これらの実施例は、あります多くの可能なのほんの一部トピックれる細胞の機械的な表現型が関連しており、これらの全てが有用マイクロポストのアレイで検討されています。
この記事の執筆時点では、約200の記事は、細胞マイクロポストの相互作用を記述する公開されています。これらの作品は、マイクロポスト偏向原則の理論的側面だけでなく、その製造上の実際的な手順について説明します。細胞や柔軟なマイクロポストアレイの相互作用を記述した最初の記事は、連続する軟質基板はnanonewton規模細胞収縮、タンらを推定するために使用されている古典的な牽引力顕微鏡(TFM)とは対照的に、2003年4タンらによって発表されました。シリコーンエラストマー製の複数の近接した垂直方向のビームを使用する方法を記載しています。この技術の主な利点は、2つの主要な特徴から出てきます。維持しつつ、第1セル見かけ基板の剛性を変更するために、1つは、マイクロポストの寸法を変更する必要がありますそれ以外の場合は一定のため、表面トポロジーと化学の違いを回避基質組成物。第二マイクロポストは、離散的に個々の焦点接着のために力と空間分解能で分析することができ、標準的なTFMにより類似の分析に固有の分析の課題を減らすことができ、個々のバネのように作用します。
今日マイクロポストアレイの適用範囲が大幅にいくつかの単一細胞のための力のほんのマッピングを超えています。たとえば、秋山は、昆虫の筋肉のパワーで動く自律マイクロロボットを開発するために、マイクロポストアレイ用アクチュエータとして蛾の毛虫から分離された背側の血管組織の使用を報告している。5
しかし、マイクロポストのほとんど公開された出願は、感染症や癌のような医学的状態の研究に焦点を当てています。例えば、マイクロポストアレイは、ナイセリアgonorrhのバンドルIV型線毛の力発生を研究するために使用されています感染を増強するシグナルカスケードに関連しているOEAコロニー6その他の細胞骨格を標的とする医薬化合物で処理された乳癌細胞を研究するためにマイクロポストを使用している。7
マイクロポストのたわみは、多くの場合、細胞のみをマイクロポストの非常に先端に取り付けられていると仮定すると、エンド負荷のカンチレバーのための古典的なビーム理論を用いて説明します。たわみδが発生する 。ここで適用される力 F は、マイクロポストの「曲げ剛性」Kに依存して計算され:
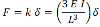 (1)
(1)
Eと、I、およびLは、ヤング率が、それぞれ慣性ビーム長の面積モーメントです。ビームは剪断および曲げだけでなく、基板の反りがACに入れないので、この式の結果は、仕事だけで力の一般的な近似を与えますカウント。マイクロポストは、典型的には、ポリジメチルシロキサン(PDMS)のような軟質材料から作られていることを考慮すると、シリコーンゴムをベースこれらの要因が含まれる必要があります。 。シェーンらは、マイクロポストのアスペクト比(L / D)と、対応するポリマーのポアソン比 Vに基づいて、そのような補正係数があることを実証した8これは、で与えられます。
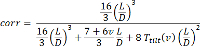 (2)
(2)
T チルト(v)は 、同じ記事で見つけることができるようにフィッティングパラメータa = 1.3が含まれて傾斜係数であることで:
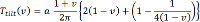 (3)
(3)
それがマイクロポストの補正後の剛性 k CORRは、純粋な曲げ剛性 k = k個の曲がり補正係数CORRの製品であることを意味しますで与えられます:
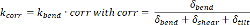 (4)
(4)
したがって、細胞力の計算は、現在読んで、式(1)の、より洗練された変化を使用して実行されるべきです。
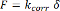 (5)
(5)
補正の影響はすぐにマイクロポストの大きさの標準値が使用されているように、より明白になります。例えば、円形の断面とPDMSベースのシリコーンゴム製の5ミクロンの直径15ミクロン、長マイクロポストは、0.77の補正係数をもたらし、したがって、未補正の計算は、23%によって及ぼされる細胞力を過大評価するであろう。これは、より小さなアスペクト比を有するマイクロポストのためにさらに深刻になります。
伝統的には、マイクロポストの画像分析は、理想的なビーム曲げ理論に基づいています。 2005年にMICRの使用を開拓グループOPOSTアレイは、マイクロポスト解析に適した画像解析ソフトウェアを発表した9ソフトウェアは、ソフトウェアライセンスを必要とし、ユーザーはそれぞれの位置のための3つの画像を取る必要があります。送信モードと染色された細胞で蛍光モードで別の1でマイクロポストの上部と下部の平面から一つずつ。それぞれに上部と下部の位置を比較した後、ソフトウェアが力のベクトル場を決定し、ポストあたりの力のような関連パラメータを計算するマイクロポスト。他のソフトウェア・パッケージが存在し、彼らの分析の原則を簡単にそれらを記述し、対応する記事に記載されているが、これらの解析ソフトウェアパッケージは、一般公開されていません。10,11
マッピングセル力のために設計されマイクロポストのアレイは、全ての隣接マイクロポストの間に等距離ギャップの利点を有する後者の直交マイクロポストのレイアウトや六角形一つであることのいずれかに分類することができます。典型的なマイクロポストヘクタール円形断面をまし、それらの寸法は、長さ50μmの直径及び2に1.0ミクロンから10ミクロンの範囲にある。4しかし、楕円形または正方形の断面を有するマイクロポストも報告されている。12,13
マイクロポスト材料としてPDMSベースのシリコーン混合物の使用は、混合物中にナノ粒子を添加することが可能になります。例えばコバルトナノロッドを追加すると、マイクロポストの磁気活性化を可能にし、したがって、潜在的な実験デザインに別の自由度を与える。14ほとんどのグループは、カバーガラスのような、またはペトリ皿の内側のフラットリジッド基板上でのマイクロポストアレイを生成します。しかし、マンと共同研究者は最近、伸縮性膜上に形成されたマイクロポストの配列を報告した。15これは、細胞収縮性の点で生細胞の細胞内の動的応答を勉強しながら、セルのアプリケーションは接着細胞に力を伸ばしことができます。
広く使用されている最もESTABSU8フォトレジストを用いてシリコンウエハの上に微細構造を生成するために使用される短い標準クリーンルーム工程においてシニァデツキら。16-18の洞察に満ちたプロトコールに記載されているようにマイクロポストのアレイを作製するためのプロセスがlishedソフトリソグラフィーに基づくものです。これは、シリコーンゴムを金型にそれらを移送構造体上にキャストされたコピー処理が続きます。第二段階では、これらの型は、選択された基板の上にシリコンゴムを使用して初期の微細構造を複製するために使用されます。しかし、彼らのアプリケーションに関連する出版物の大規模で増えているにもかかわらず、マイクロポストの製造プロセスを確立することはあっても、マイクロエンジニアリングの専門家のためにかなりの時間がかかります。許容可能な品質レベルを得るために、特定のラボ環境とマイクロポストレイアウトに最適化と適応を必要とする多くの処理工程があります。
市販のマイクロポストアレイは準備ができて-Tで使用できるようになりました一貫して高品質のO-使用(「既製」)形式。そのため彼らは、オンサイト生産に必要な複雑かつ長時間の製造プロセスに代わるもの。この論文では、市販のマイクロポストのアレイは、単一の明視野顕微鏡画像を用いて、細胞の力をマッピングするために使用しました。さらに重要なのは、この資料では、この原稿の副教材としてダウンロードすることができますMechProfilerという名前のフル機能のオープンソース・ソフトウェアを、説明し、文書化します。ソフトウェアの活発にメンテナンスバージョンもhttp://www.orthobiomech.ethz.chで見つけることができます。
「既製」アッセイと互換性のあるオープンソースの解析ソフトウェアの組み合わせは、著しく正確なTFM実験を達成するために、エントリハードルを下げます。クリーンルーム施設やソフトウェア開発の専門知識のいずれかを利用できない研究者が成功した細胞の力を分析することができます。これはmechanosに注力することを可能にensitivityアッセイ出力ではなく、技術そのもの、およびより広範な地域社会への牽引力の測定値を利用できるようになります。さらに、これはマイクロポストアレイの完全自動スクリーニングへの道を切り開くための重要なステップです。
MechProfiler解析ソフトウェアは、ファイル形式、TIFF、PNG、BMPおよびJPGの画像を処理します。画像は、蛍光、位相差または明視野光学顕微鏡を用いて撮影することができます。スタンドアロンのプログラムは、(で入手できます: 図12)は、フリーのMatlabのコンパイラのランタイムと一緒に実行され、基礎となるアルゴリズムは、約1分で、単一または複数のセルで画像を処理することを可能にする、合理化された画像処理を可能にします。さらに、これらの細胞を、生きてもよいし、「固定」。
MechProfilerソフトウェアが大きく品質の商用マイクロポストのアレイの再現性に依存することにより、データ分析のスループットを増加させることができ、より具体的には、デフォルト・#8220;配列内の各ポストの非偏向」位置が理想的なグリッドに対して推定することができる(この研究のために使用される配列内のグリッドの製造偏差は100nm未満でした)。
短いものでは、関心領域にそれらの作物、分析のための画像ファイルの選択を開き、細胞で覆われたポストを定義するか、廃棄する必要がある、ポスト位置を決定し、偏向/理想格子に対する力を計算し、最終的に標準的なオフィスのスプレッドシートに含め、輸出の可能性を持つすべてのセル固有のデータを保存します。
Protocol
Representative Results
Discussion
この作品は、実質的にエントリへの技術的、実用的な障壁を下げることによって牽引力顕微鏡の分野を進めることを目指しています。これらの障壁は、二つの側面から来ます。まず第一に再現可能に製造し、実験的にマイクロポストの配列を委託するために克服しなければならない多数の非自明な技術的課題があります。典型的な実験は、細胞の数百または数千もの分析を必要とするかもし?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the Committee Technology and Innovation (CTI) Switzerland grant 14796-PFLS-LSCTI. MicroPost arrays were generously provided by MicroDuits GmbH.
Materials
| T25 cell culture flasks | Nunc | 156367 | |
| 1x PBS-buffer | Sigma | D8537 | |
| 0.5% Trypsin-EDTA | Life Technologies | 15400054 | |
| Medium DMEM/F12 | Sigma | D8437 | |
| FBS South America | Life Technologies | 10270106 | |
| Penicillin-Streptomycin 100x | Sigma | P4333 | |
| 15 ml centrifuge vials | Sarstedt | 62.554.502 | |
| Micropost array | MicroDuits | MPA-col1/FN | Micropost dimensions: |
| pre-coated with Collagen I/Fibronectin | Ø= 6.4 µm, l=18.2 µm; grid= 13 µm, kcorr= 2.87 nN/µm | ||
| Ethanol abs p.A. | Merck | 100.983 | |
| 12-well plate | Nunc | 150628 | |
| Formalin solution, neutral buffered 10% | Sigma | HT5011 | |
| Brilliant Blue G-250 | Sigma | 27815 | Coomassie blue |
| Methanol ACS p.A. | Merck | 1.06009 | |
| Acetic acid | Sigma | 695092 | |
| Glass bottom dish | WillCo Wells BV | GWSb-3522 | 35 mm diameter, aperture 22 mm |
| T-100 Eclipse | Nikon | n/a | Inverted microscope |
| D3-L3 | Nikon | n/a | Camera controler |
| DS Fi2 | Nikon | Camera |
References
- Sharma, R. I., Snedeker, J. G. Biochemical and biomechanical gradients for directed bone marrow stromal cell differentiation toward tendon and bone. Biomaterials. 31 (30), 7695-7704 (2010).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomater. 3 (4), 413-438 (2007).
- Bartalena, G., et al. A novel method for assessing adherent single-cell stiffness in tension: design and testing of a substrate-based live cell functional imaging device. Biomed Microdevices. 13 (2), 291-301 (2011).
- Tan, J. L., et al. Cells lying on a bed of microneedles: An approach to isolate mechanical force. PNAS. 100 (4), 1484-1489 (2003).
- Akiyama, Y., Hoshino, T., Iwabuchi, K., Morishima, K. Room Temperature Operable Autonomously Moving Bio-Microrobot Powered by Insect Dorsal Vessel Tissue. PloS ONE. 7 (7), (2012).
- Biais, N., Ladoux, B., Higashi, D., So, M., Sheetz, M. Cooperative retraction of bundled type IV pili enables nanonewton force generation. Plos Biology. 6 (4), 907-913 (2008).
- Wuang, S. C., Ladoux, B., Lim, C. T. Probing the Chemo-Mechanical Effects of an Anti-Cancer Drug Emodin on Breast Cancer Cells. Cell Mol Bioeng. 4 (3), 466-475 (2011).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing Cellular Traction Forces by Micropillar Arrays: Contribution of Substrate Warping to Pillar Deflection. Nano Lett. 10 (5), 1823-1830 (2010).
- Lemmon, C. A., et al. Shear Force at the Cell-Matrix Interface: Enhanced Analysis for Microfabricated Post Array Detectors. Mech Chem Biosyst. 2 (1), 1-16 (2005).
- Lam, R. H. W., Weng, S. N., Lu, W., Fu, J. P. Live-cell subcellular measurement of cell stiffness using a microengineered stretchable micropost array membrane. Integr Biol-UK. 4 (10), 1289-1298 (2012).
- Roure, O., et al. Force mapping in epithelial cell migration. PNAS. 102 (39), 14122-14122 (2005).
- Papenburg, B. J., Rodrigues, E. D., Wessling, M., Stamatialis, D. Insights into the role of material surface topography and wettability on cell-material interactions. Soft Matter. 6 (18), 4377-4388 (2010).
- Badique, F., et al. Directing nuclear deformation on micropillared surfaces by substrate geometry and cytoskeleton organization. Biomaterials. 34 (12), 2991-3001 (2013).
- Sniadecki, N. J., et al. Magnetic microposts as an approach to apply forces to living cells. PNAS. 104 (37), 14553-14558 (2007).
- Weng, R. H. W. A silicone-based stretchable micropost array membrane for monitoring live-cell subcellular cytoskeletal response. Lab Chip. 12, 731-740 (2012).
- Desai, R. A., Yang, M. T., Sniadecki, N. J., Legant, W. R., Chen, C. S. Microfabricated Post-Array-Detectors (mPADs): an Approach to Isolate Mechanical Forces. J Vis Exp. (8), e311 (2007).
- Yang, M. T., Fu, J. P., Wang, Y. K., Desai, R. A., Chen, C. S. Assaying stem cell mechanobiology on microfabricated elastomeric substrates with geometrically modulated rigidity. Nat Protoc. 6 (2), 187-213 (2011).
- Sniadecki, N. J., Han, S. J., Ting, L. H., Feghhi, S. Micropatterning in Cell Biology. Methods in Cell Biol. 121, 61-73 (2014).

