Membrane transportprocesser analyseret af en Highly Parallel nanopore Chip System på Single Protein Opløsning
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
Membran protein transport på enkelt protein niveauet stadig undviger detaljeret analyse, hvis underlaget omplantes er non-elektrogen. Der er gjort en stor indsats på dette område, men teknikker muliggør automatiseret high-throughput transport analyse i kombination med opløsningsmidler fri lipid dobbeltlag teknikker, der kræves til analyse af membrantransportører er sjældne. Denne klasse af transportvirksomheder dog er afgørende i celle homeostase, og derfor et vigtigt target i lægemiddeludvikling og metoder til at opnå nye indsigter hårdt tiltrængt.
Den her præsenterede manuskript beskriver etablering og håndtering af en roman biochip til analyse af membranprotein medieret transportprocesser på enkelt transporter opløsning. Biochip består af mikrohulrum, der afgrænses af nanopores som er yderst parallelt i sit design og kan fremstilles i industriel kvalitet og mængde. Protein-huser liposomer kan direkte anvendes påchip overfladen danner selv-samlet pore-spanning lipiddobbeltlag under anvendelse SSM-teknikker (faste understøttede lipidmembraner). Pore-spanning dele af membranen fritstående og fungerer som bindeled til substratet translokation ind i eller ud af hulrummet rum, som kan efterfølges af multi-spektral fluorescerende udlæsning i realtid. Etableringen af standardprocedurer (SOP) tillader ligetil etablering af protein-huser lipid dobbeltlag på chippen overfladen af stort set alle membranprotein, der kan rekonstitueres funktionelt. Den eneste forudsætning er etableringen af en fluorescerende udlæsning system til ikke-elektrogen transport substrater.
Høje-indhold screening applikationer er accomplishable ved anvendelse af automatiserede inverterede fluorescerende mikroskoper optagelse af flere chips i parallel. Store datasæt kan analyseres ved hjælp af frit tilgængelige specialdesignede analyse software. Tre-farve multi spektrale fluorescerendeudlæsning desuden muliggør objektiv diskrimination data i forskellige event klasser, eliminerer falske positive resultater.
Chippen teknologi er i øjeblikket baseret på SiO2 overflader, men yderligere funktionalisering ved hjælp guldbelagte chip overflader er også mulig.
Introduction
Analysen af membranproteiner er blevet af stigende interesse for grundlæggende og farmaceutisk forskning i de sidste 20 år. Udviklingen af nye lægemidler afhænger af identificering og detaljeret karakterisering af nye mål, som i øjeblikket er en af de begrænsende faktorer. Det forhold, at omkring 60% af alle lægemiddelmål er membranproteiner 1, gør udviklingen af teknikker for at belyse deres funktion vigtigste.
I fortiden, har teknikker til undersøgelse af elektrogen kanaler og transportere blevet udviklet i mange 2 – 4. Ikke-elektrogen substrater i modsætning fremlægge en mere udfordrende opgave. De er imidlertid af særlig interesse som primære lægemiddelmål, da de kontrollerer strømningen af opløste stoffer og næringsstoffer gennem cellemembranen og funktion som centrale receptorer i signaleringskaskader 5.
Betydelig indsats har været lagt i udviklingen af techniques at studere funktionen af membrantransportproteiner 6, 7. Systemer med fast-understøttede membraner er dukket op som mest lovende redskaber i denne felt 8 – 10 herunder faste understøttede lipiddobbeltlag, tøjrede dobbeltlag 11, 12, microblack lipidmembraner 13, 14 og native vesikel arrays 15, 16 at nævne nogle få. Nogle af dem er endda tilgængelige som kommercielle opsætninger 17, 18. Nogle eksempler er blevet offentliggjort kombinere evnen til at studere enkelt membranproteiner i en yderst parallel måde 14, 19, en forudsætning for screening applikationer. Men disse metoder sjældent bro fra grundforskning til det industrielle miljø. Vanskelighederne ligger ofte i systemets evne til at være automatiserbar, cost-intensiv produktion og / eller besværlige forberedelse. En tilgang overcoming alle de ovennævnte forhindringer er det endelige mål.
Teknikken præsenteres her blev udviklet for at studere membran kanaler og transportere in vitro i et kontrolleret miljø på enkelt protein niveauet 20-22. Rekonstituering af oprensede membranproteiner i LUV er langt mere etableret end sammenlignelige tilgange til GUVs 23 – 26 eller sort lipidmembraner 27. De kan direkte påføres chipoverfladen, hvor dobbeltlagsformation finder sted via et selvsamlende proces. Den glasbund design af nanoporøse chip (fig. 1) tillader luft mikroskopi, som tillader enkel automatisering af systemet. I kombination med et motoriseret trin flere chips kan måles på samme tid, med hver synsfelt indeholdende tusinder af forseglede hulrum til analyse.
<p class="jove_content" fo:keep-together.within-page= "1">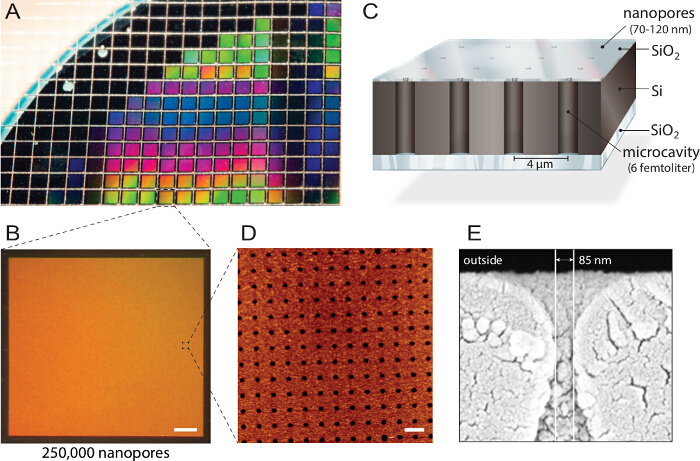
Figur 1. Design af multiplex nanopore biochips. A) En silicium-på-isolator (SOI) wafer er struktureret af reaktiv-ion ætsning. Ca. 1150 individuelle chips er fremstillet af hver wafer med identiske egenskaber og kvalitet. B) Hver chip består af 250.000 individuelle mikrokaviteter med nano åbninger. Målestok:. 200 um C) Hvert hulrum er adresserbare via multi-spektral fluorescens udlæsning. En uigennemsigtig øverste lag blokerer de fluorescerende signaler fra stødpudebeholderen, hvilket gør biochip forenelig med omvendte fluorescens mikroskoper. D) atomic force mikroskopi (AFM) afbildning afslører jævnt arrangeret poreåbninger og overfladeruhed af siliciumdioxid lag på 3,6 nm (n = 40) optimalt til vesikelfusion. Målestok:. 5 um E) Scanning elektron microscopy (SEM) billede viser et tværsnit gennem nanopore giver adgang til de femtoliter hulrum inde i silicium chip. Dette tal blev genbrugt med tilladelse fra 21. Klik her for at se en større version af dette tal.
Alle data analyse udføres under anvendelse freeware at garantere ubegrænset adgang for slutbrugerne. Tidsserier analyseres ved hjælp af gratis billedbehandling software og en brugerdefineret build kurve analyse software muliggør batch behandling og ligetil korrelation af store datasæt med flere fluorescerende kanaler og tusindvis af kurver.
Modellen protein anvendt i denne protokol er den mekanosensitive kanal af store ledningsevne (MscL) kanal protein afledt af E. coli. Den fungerer som en ventil til at frigive osmotisk chok i naturen, men blev ændret på en sådan måde, at rationelt designet Synthetic funktionaliteter kan kovalent fastgøres til kanaler konstriktion side. Via charge-frastødning af covalent bundet aktivator (MTSET) kanalen udløses til at åbne, hvilket skaber en nano-ventil. Små molekyler såsom ioner, vand, små proteiner, men også små fluoroforer kan trænge igennem kanalen. Her proteinet anvendes som model for at demonstrere evnen af systemet til at detektere protein-medieret translokation.
Protocol
Representative Results
Discussion
Teknikken præsenteres her giver en yderst parallel analyse af membranprotein transport. Rekonstituerede membranprotein-systemer kan direkte påføres på biochip, hvilket gør tilpasningen af teoretisk hver membran transportør eller kanal mulig. Transport analyse er kun begrænset af etableringen af en fluorescerende udlæsning systemet, enten via direkte fluorescens ændring (translokation af fluoroforer eller fluorescens-mærkede substrater) eller indirekte fluorescens ændring (pH-følsomme farvestoffer…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
References
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

