Membraan transportprocessen geanalyseerd door een Highly Parallel Nanopore Chip System aan Single Protein Resolution
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
Membraaneiwit vervoer op de enkel eiwit niveau ontwijkt nog een gedetailleerde analyse, wanneer het substraat translocatie is niet elektrogene. Aanzienlijke inspanningen zijn gedaan op dit gebied, maar technieken voor directe high-throughput transport analyse in combinatie met oplosmiddelvrije lipide bilaag technieken die nodig zijn voor de analyse van membraan transporters zijn zeldzaam. Deze klasse van vervoerders is echter van cruciaal belang in cel homeostase en dus een belangrijke doelgroep in de ontwikkeling en methodologieën om nieuwe inzichten drug hard nodig.
De hier gepresenteerde manuscript beschrijft de inrichting en het beheer van een nieuwe biochip voor de analyse van membraaneiwit gemedieerd transportprocessen in één transporter resolutie. De biochip bestaat uit microcavities omsloten door nanoporiën die zeer parallel in het ontwerp en kunnen in industriële kwaliteit en kwantiteit. Eiwit-herbergen liposomen kunnen direct worden aangebracht opde chip oppervlak vormen van zelf-geassembleerde poriën verspreid over lipidedubbellagen behulp van SSM-technieken (vast ondersteund lipide membranen). Pore omspant delen van het membraan vrijstaand, door een interface voor translocatie substraat in of uit de holle ruimte, eventueel gevolgd door multispectrale de fluorescentie in real-time. De oprichting van Standard Operating Procedures (SOP's) maakt het mogelijk de eenvoudige oprichting van-eiwit herbergen lipidedubbellagen op de chip oppervlak van vrijwel elke membraaneiwit dat functioneel kan worden opgelost. De enige voorwaarde is de oprichting van een tl-read-out systeem voor niet-elektrogene transport substraten.
High content toepassingen accomplishable door geautomatiseerde omgekeerde fluorescentie microscoop opnamen meerdere chips parallel. Grote datasets worden geanalyseerd met de vrij beschikbare maat gemaakt analysesoftware. Drie-kleuren multi-spectrale tlVerder lees-out zorgt voor een onpartijdige discriminatie data in verschillende event klassen, waardoor vals-positieve resultaten.
De chiptechnologie is momenteel gebaseerd op SiO2 oppervlakken, maar verdere functionalisering behulp goud gecoate chip oppervlakken mogelijk.
Introduction
De analyse van membraaneiwitten is geworden van de toenemende belangstelling voor fundamenteel en farmaceutisch onderzoek in de afgelopen 20 jaar. De ontwikkeling van nieuwe geneesmiddelen is afhankelijk van de identificatie en de gedetailleerde karakterisering van nieuwe targets, momenteel één van de beperkende factoren. Het feit dat ongeveer 60% van alle targets zijn membraaneiwitten 1, maakt de ontwikkeling van technieken om hun belangrijkste functie helderen.
In het verleden, zijn technieken voor het bestuderen van elektrogene kanalen en transporters ontwikkeld veelheid 2-4. Non-elektrogene substraten in tegenstelling presenteren een meer uitdagende taak. Zij zijn echter van bijzonder belang als voornaamste drug targets, omdat ze de flux van opgeloste stoffen en voedingsstoffen door het celmembraan en fungeren als de belangrijkste receptoren controle bij het signaleren van cascades 5.
Aanzienlijke inspanningen werden in de ontwikkeling van t gezetechniques de functie van membraan transporteiwitten 6, 7 bestuderen. Systemen met vaste drager als membranen meest veelbelovende hulpmiddelen ontstond in dit gebied 8-10, waaronder vaste drager lipidendubbellagen gebonden dubbellagen 11, 12, microblack lipide membranen 13, 14 en inheemse vesicle arrays 15, 16 te noemen. Sommige zijn zelfs verkrijgbaar als commerciële opstellingen 17, 18. Voorbeelden zijn gepubliceerd combineren vermogen enkelvoudige membraaneiwitten te bestuderen op een zeer parallelle wijze 14, 19, een voorwaarde voor screening toepassingen. Echter, deze methoden zelden overbruggen van fundamenteel onderzoek tot de industriële omgeving. Het feitelijke probleem vaak het vermogen van het systeem om automatiseerbare, de kostbare productie en / of bewerkelijke bereiding. Een aanpak overcoming alle hierboven genoemde obstakels is het einddoel.
De techniek die hier werd ontwikkeld om membraankanalen en transporters studie in vitro in een gecontroleerde omgeving voor de interne eiwitniveau 20-22. Reconstructie van gezuiverde membraaneiwitten in LUV's is veel meer gevestigde dan vergelijkbare aanpak voor GUVs 23-26 of zwarte lipide membranen 27. Ze kunnen direct worden aangebracht op het chip oppervlak, waarbij bilaag vorming plaatsvindt via een zelf-assemblageproces. De glazen bodem ontwerp van de nanoporeuze chip (fig. 1) maakt lucht microscopie, die de eenvoudige automatisering van het systeem mogelijk maakt. In combinatie met een gemotoriseerde fase kan meerdere chips worden gemeten op hetzelfde tijdstip, waarbij elke gezichtsveld met duizenden afgesloten holtes voor analyse.
<p class="jove_content" fo:keep-together.within-page= "1">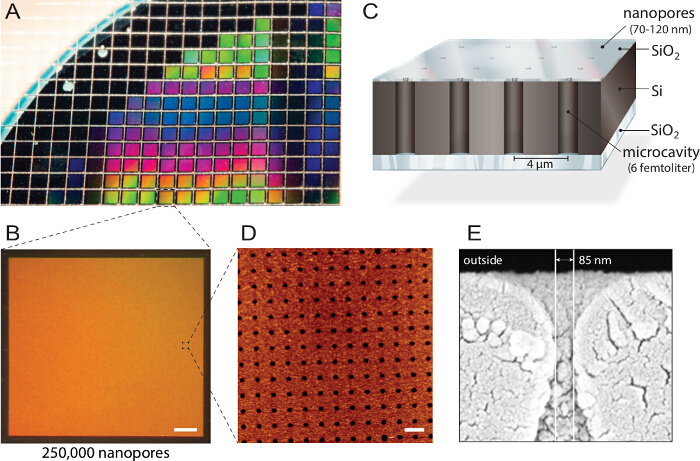
Figuur 1. Ontwerp van multiplex nanogaatje biochips. A) een silicon-on-insulator (SOI) wafer wordt gestructureerd door reactief-ion etsen. Ongeveer 1.150 individuele chips worden vervaardigd uit elk wafer met identieke eigenschappen en kwaliteit. B) Elke chip bestaat uit 250.000 individuele microcaviteiten met nano openingen. Schaal bar:. 200 pm C) elke holte is adresseerbare via multispectrale fluorescentie uitlezing. Een ondoorzichtige bovenlaag blokkeert de fluorescentiesignalen uit het bufferreservoir, waardoor de biochip compatibel met omgekeerde fluorescentie microscoop. D) Atomic Force Microscopy (AFM) beeldvorming openbaart gelijk geschikt poriënopeningen en oppervlakteruwheid van de siliciumdioxide-laag van 3,6 nm (n = 40) optimaal voor blaasje fusion. Schaal bar:. 5 micrometer E) Scanning electron microscopy beeld (SEM) toont een dwarsdoorsnede door de nanoporiën de toegang tot de femtoliter holten in de siliciumchip. Dit cijfer werd hergebruikt met toestemming van 21. Klik hier om een grotere versie van deze figuur te bekijken.
Alle data-analyse wordt uitgevoerd met behulp van freeware naar onbeperkte toegang voor eindgebruikers te garanderen. Tijdreeksen worden geanalyseerd met behulp van gratis software voor beeldverwerking en een custom build curve analyse software die batch processing en ongecompliceerd correlatie van grote datasets met meerdere fluorescerende kanalen en duizenden bochten.
De model-eiwit gebruikt in dit protocol is de mechanosensitieve kanaal van grote geleidbaarheid (MscL) kanaal eiwitten afkomstig van E. coli. Het functioneert als een klep om osmotische shock aard vrij, maar werd aangepast zodanig dat rationeel ontworpen Synthetic functionaliteiten kunnen covalent aan de kanalen vernauwing zijde worden bevestigd. Via charge-afstoting van het covalent gebonden activator (MTSET) het kanaal wordt geactiveerd om te openen, het creëren van een nano-klep. Kleine moleculen zoals ionen, water, kleine eiwitten, maar ook kleine fluoroforen kan doordringen door het kanaal. Hier wordt het eiwit gebruikt als een model om het vermogen van het systeem om eiwit gemedieerde translocatie detecteren tonen.
Protocol
Representative Results
Discussion
De techniek die hier kan een zeer parallelle analyse membraaneiwit transport. Gereconstitueerd membraaneiwit systemen kunnen direct worden aangebracht op de biochip, waardoor de aanpassing van theoretisch elke membraantransporter of kanaal mogelijk. Transport analyse wordt alleen beperkt door de oprichting van een tl-read-out systeem, hetzij via directe fluorescentie verandering (translocatie van fluoroforen of fluorescent gelabelde substraten) of indirecte fluorescentie change (pH-gevoelige kleurstoffen, secundaire enz…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
References
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

