癌細胞の浸潤や衛星腫瘍形成を探検するための三次元培養アッセイ
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
単層での哺乳動物細胞の培養は、広く様々な生理学的および分子プロセスを研究するために使用されます。しかし、成長細胞を研究するために、このアプローチは、多くの場合、不要なアーティファクトを生成します。したがって、多くの場合、細胞外マトリックス成 分を用いた3次元(3D)環境内での細胞培養は、によりインビボ組織または臓器において天然にその近い類似に興味深い代替として登場しました。我々は、フィブリンゲルからなる疑似一次macrospherical腫瘍および(ii)の周辺の無細胞区画としてコラーゲンゲル作用に埋め込 まれた癌細胞を含む中心コンパートメント、二つの区画、すなわち(i)を用いて、三次元細胞培養システムを開発しましたすなわち、中心部に使用されるものとは異なる細胞外マトリックス成 分は、ここで癌細胞が遊走する(浸潤フロント)および/ または第二またはサテライト腫瘍を表す微小球腫瘍を形成することができます。末梢コンパートメント内の衛星腫瘍の形成であります著しく、この3D培養系は、ユニークなネイティブの腫瘍細胞の既知の攻撃性または転移性の起源、と相関。この細胞培養アプローチは、癌細胞の浸潤性および運動性、細胞 – 細胞外マトリックス相互作用と抗がん剤の特性を評価する方法としてを評価するために考慮されるかもしれません。
Introduction
癌細胞の浸潤/遊走およびその後の転移の確立の基本的および生物医学的特性を調査することは熱心な研究1,2の主題です。転移は、がんの究極の段階であり、その臨床管理はとらえどころのないままになります。細胞および分子レベルでの転移のより良い理解は、より効率的な治療法3の開発を可能にします。
転移性細胞のいくつかの特性は、それらの幹細胞性と移行し、内と原発腫瘍5から侵入する遷移状態( 例えば 、類上皮間葉移行)を取得する可能性を含む試験管 4 で検討することができます。それは事実上の血液/リンパ循環の寄与を除外しかし、浸潤/転移過程のin vitro評価は、課題でした。コラーゲンゲルに腫瘍断片を埋め込む器官培養物previou有しますずる癌の攻撃性をモニターするために使用されて。腫瘍の複雑さ( 例えば 、非癌性細胞の存在)を保持しているが、腫瘍断片を、制限された培地の拡散にさらされている、サンプリング変化、および間質細胞6の異常増殖です。別の方法は、三次元(3D)細胞環境を模倣する細胞外マトリックス(ECM)の構成要素内の癌細胞を成長させることにあります。コラーゲンゲルおよび/または基底膜由来のマトリックス中の乳癌細胞株の増殖は、3次元細胞培養物の最もよく特徴づけ実施例の中です。特定の三次元細胞培養環境を使用して、標準的な条件下で増殖させた乳癌細胞について観察された無秩序なアセンブリは、乳腺腺房と管状構造7-10の自発的形成を逆転させることができます。また、腺癌細胞由来の多腫瘍スフェロイドの形成は、(別の技術を使用して集まっ例えば、滴、浮遊スフェロイド、寒天埋め込 み)を吊りは現在最も一般的に使用される三次元細胞培養アッセイ11-13を構成しています。しかし、このアッセイは、スフェロイドを形成することができる癌細胞株の制限されたセットによってこれらの条件で細胞を研究するために利用可能な短い期間によって制限されます。
この視覚化技術では、我々は、本明細書中に関心の癌細胞は、代わりに基底膜由来のマトリックスで被覆することができる擬似原発腫瘍のインビトロ形成を可能にするために、コラーゲンゲル中に包埋された洗練された三次元細胞培養アッセイ法を導入します。一旦形成されると、擬似原発腫瘍はその後、癌細胞は、2つの行列の区画との間の界面を横断することを可能にする無細胞マトリックス(ここでフィブリンゲル)に挟まれている( 図1参照)。興味深いことに、攻撃的な癌細胞と共に擬似原発腫瘍に由来する二次性腫瘍のような構造は、で表示されフィブリンゲル。このような三次元培養系は、例えば、抗癌剤、遺伝子発現および細胞-細胞および/ または細胞-ECM相互作用14-16、調査に必要な柔軟性を提供します。
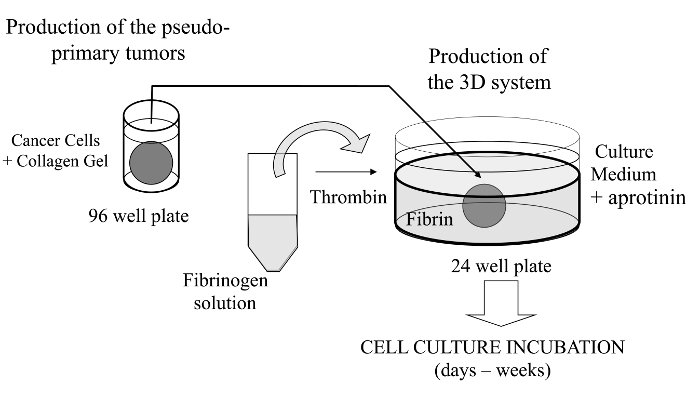
図1: メソッドの概要癌研究のためのモデルとして、3D細胞培養系を生成するための方法の概略要約この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
重要な技術脚注として、ギャップは、中枢および末梢ゲルとの間の界面に存在しないことが必須です。それ以外の場合は、フィブリンゲルに侵入/移行する細胞の能力を低下させる可能性があります。トロンビンは、適切に希釈されていない場合、コラーゲンとフィブリンゲルとの間の空間は、培養の最初の24時間の間に形成してもよいです。試験した細胞株は、それによって両方のゲルの間?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

