Tredimensionell kultur analys att utforska Cancer Cell invasiv och satellit tumörbildning
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
Däggdjurscellkultur i monolager används i stor utsträckning för att studera olika fysiologiska och molekylära processer. Men denna metod för att studera växande celler genererar ofta oönskade artefakter. Därför, cellodling i en tredimensionell (3D) miljö, ofta med hjälp av extracellulära matriskomponenter, framträdde som ett intressant alternativ på grund av dess nära likhet med den nativa in vivo vävnad eller ett organ. Vi utvecklat en 3D cellodlingssystem med användning av två avdelningar, nämligen (i) en central avdelning innehållande cancerceller inbäddade i en kollagengel som verkar som en pseudo-primär macrospherical tumör och (ii) en perifer cellfri fack tillverkat av ett fibrin gel, dvs en extracellulär matriskomponent som skiljer sig från den som används i centrum, där cancerceller kan migrera (invasion fram) och / eller bilda mikrosfäriska tumörer representerar sekundära eller satellit tumörer. Bildandet av tumörer satellit i det perifera utrymmet äranmärkningsvärt korrelerad med kända aggressivitet eller metastaserad ursprung infödda tumörceller, vilket gör denna 3D odlingssystem unik. kan anses denna cellkultur för att bedöma cancercell invasivitet och motilitet, cell-extracellulär matrix-interaktioner och som en metod för att utvärdera anticancerläkemedel egenskaper.
Introduction
Undersöka de grundläggande och biomedicinska egenskaper cancercellinvasion / migration och efterföljande metastas etablering är föremål för en intensiv forskning 1,2. Metastas är slutskedet av cancer och dess kliniska hanteringen förblir gäckande. En bättre förståelse av metastaser på cellulär och molekylär nivå gör det möjligt att utveckla effektivare terapier 3.
Flera egenskaper hos metastaserande celler kan utforskas in vitro fyra inklusive deras stemness och potential att förvärva ett övergångstillstånd (t.ex. epithelioid-mesenkymala övergång) att migrera och invadera inom och från den primära tumören 5. Emellertid har bedömningen av invasion / metastaser processer in vitro varit en utmaning eftersom det praktiskt taget utesluter bidrag blod / lymfcirkulationen. Organotypic kulturer som bädda tumörfragment i kollagengeler har previously använts för att övervaka cancer aggressivitet. Även om komplexiteten av tumörer bevaras (t.ex. närvaron av icke-cancerceller), tumörfragment utsätts för begränsad medel diffusion, till provtagningsvariation och för att en överväxt av stromaceller 6. En alternativ metod består i att odla cancerceller inom komponenter av den extracellulära matrisen (ECM), som härmar den tredimensionella (3D) cellomgivningen. Spridningen av bröstcancercellinjer i en kollagengel och / eller ett basalmembran-härledda matrisen är bland de bäst karakteriserade exemplen på 3D cellodling. Genom att använda specifika 3D cellodlingsmiljöer kan oorganiserade enheten observerats för bröstcancerceller odlade under normala förhållanden återföras till det spontana bildandet av bröst acini och rörstrukturer 7-10. Vidare, bildandet av multicellulära tumör sfäroider härledda från adenokarcinom cancerceller saml med användning av olika tekniker (t.ex. hängande droppar, flytande sfäroider, agar ingjutning) nu utgör den mest använda 3D cellodlingsanalys 11-13. Emellertid är denna analys begränsas av den begränsade uppsättningen av cancercellinjer som kan bilda sfäroider och genom den korta perioden tillgängliga för att studera celler under dessa förhållanden.
I detta visualiseras teknik, vi häri införa en sofistikerad 3D cellodlingsanalys där cancerceller av intresse är inbäddade i en kollagengel för att tillåta bildandet av en pseudo-primär tumör som kan alternativt beläggas med ett basalmembran-härlett matrisen in vitro. När den väl bildats, är pseudo-primärtumören sedan inklämt i ett acellulärt matris (fibrin gel i detta fall), som gör att cancercellerna att korsa gränsytan mellan de två matrisfacken (se figur 1). Interestingly, sekundära tumörliknande strukturer som härrör från den pseudo primära tumören tillsammans med aggressiva cancerceller visas ifibrin gel. Ett sådant 3D odlingssystem ger den flexibilitet som krävs för att undersöka, till exempel läkemedel mot cancer, genuttryck och cell-cell och / eller cell ECM interaktioner 14-16.
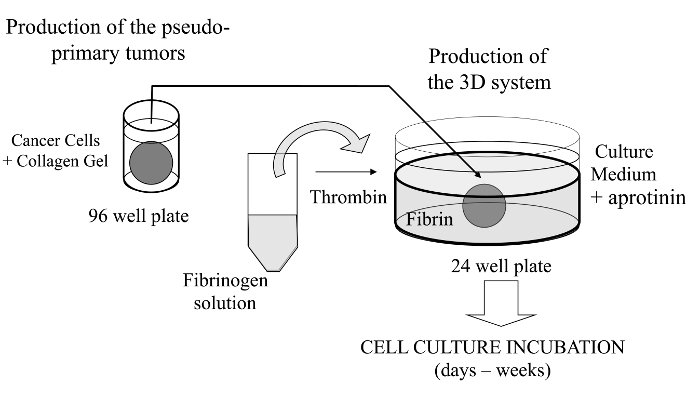
Figur 1:.. Översikt av metoden Schematisk översikt av metoden för att generera 3D cellodlingssystem som en modell för cancerstudier Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Som en viktig teknisk fotnot är det viktigt att ingen lucka föreligger vid gränsytan mellan den centrala och de perifera geler. Annars kan det minska kapaciteten hos celler att migrera / invadera fibrin gel. Ett utrymme mellan kollagen och fibrin geler kan bildas under de första 24 h av kultur om trombin inte har lämpligt utspädd. Det är också möjligt att cellinjen testades kan leda kollagengelen att dra ihop sig under odling och därigenom orsakar ett relativt stort utrymme för att bilda mellan båda geler. D…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

