Comparaison de tabac Méthodes hôte cellulaire Protein suppression par Blanchir plantes intactes ou par traitement thermique des extraits
Summary
Trois chaleur des procédés de précipitation sont présentées qui éliminent efficacement plus de 90% des protéines de la cellule hôte (SPH) de tabac extrait avant toute autre étape de purification. L'usine RSG agréger de manière irréversible à des températures supérieures à 60 ° C.
Abstract
Les plantes fournissent non seulement la nourriture, l'alimentation et des matières premières pour l'homme, mais ont également été mis au point en tant que système de production économique pour les protéines biopharmaceutiques, tels que des anticorps, des vaccins candidats et des enzymes. Ceux-ci doivent être purifiés à partir de la biomasse des plantes, mais des étapes de Chromatographie sont gênées par les concentrations élevées de protéines de cellule hôte (HCP) dans les extraits de plantes. Cependant, la plupart des professionnels de la santé agrégées de manière irréversible à des températures supérieures à 60 ° C facilitant la purification ultérieure de la protéine cible. Ici, trois méthodes sont présentées pour obtenir la précipitation de la chaleur des RSG de tabac soit dans des feuilles intactes ou des extraits. Le blanchissement des feuilles intactes peut facilement être incorporé dans les processus existants, mais peut avoir un impact négatif sur les étapes subséquentes de filtration. L'inverse est vrai pour la précipitation de la chaleur des extraits de feuilles dans un récipient agité, ce qui peut améliorer la performance des opérations en aval mais avec des changements majeurs dans la conception de l'équipement de procédé, tels quela géométrie de la homogénéisateur. Enfin, une configuration de l'échangeur de chaleur est bien caractérisée en termes de conditions de transfert de chaleur et facile à l'échelle, mais le nettoyage peut être difficile et il peut y avoir un impact négatif sur la capacité du filtre. L'approche de conception-de-expériences peut être utilisé pour identifier les paramètres de processus les plus pertinents affectant l'élimination des HCP et la récupération du produit. Ceci facilite l'application de chaque méthode dans d'autres plates-formes d'expression et l'identification de la méthode la plus appropriée pour une stratégie de purification donné.
Introduction
Les systèmes de santé modernes dépendent de plus en plus sur les protéines biopharmaceutiques 1. La production de ces protéines dans les plantes est avantageuse en raison de la charge pathogène faible et une plus grande évolutivité par rapport aux systèmes d'expression classiques 2-4. Cependant, le traitement en aval (DSP) de produits pharmaceutiques d'origine végétale peut être difficile parce que les procédures d'extraction perturbateurs se traduisent par une charge élevée de particules, dont la turbidité dépassant 5.000 unités néphélométriques de turbidité (NTU), et de la protéine de la cellule hôte (HCP) concentrations dépassant souvent 95 % [m / m] 5,6.
Procédures de clarification Elaborate sont nécessaires pour éliminer les particules dispersées 7-9, mais l' équipement de chromatographie est moins coûteux à exploiter en mode bind-et-éluent lors de la récupération initiale du produit s'il y a une étape antérieure pour l'élimination efficace des professionnels de la santé 10,11. Ceci peut être réalisé soit par précipitation de la protéine cible à l'aide flocculfourmis 12 ou à faible pH 13,14, ainsi que par l' origine du RSG pour agréger. L'agrégation sélective de la ribulose-1,5-biphosphate carboxylase / oxygénase (RuBisCO), le HCP le plus abondant dans les plantes vertes telles que le tabac (Nicotiana tabacum), peut être favorisée par l' addition de polyéthylène – glycol 15, mais ceci est coûteux et incompatible avec un grand fabrication -scale. Le traitement thermique a été montré pour dénaturer et précipiter plus de 95% des professionnels de la santé du tabac, tandis que les vaccins candidats protéines telles que le paludisme Vax8 demeurent stables en solution 16-18.
Trois approches différentes ont été utilisées pour réaliser la précipitation induite par la chaleur des professionnels de la santé du tabac (i) de blanchiment, à savoir l'immersion des feuilles intactes dans un liquide chaud, (ii) une température contrôlée récipient sous agitation, et (iii) un échangeur de chaleur ( Figure 1) 16. Pour des feuilles intactes, Blanchir atteint la précipitation rapide et efficace des professionnels de la santé et a été également facileà l' échelle et compatible avec les procédés de fabrication à grande échelle existantes qui comprennent une étape initiale pour laver la biomasse végétale 19. En revanche, les navires à température contrôlée sont déjà disponibles dans certains procédés , et peuvent être utilisés pour le traitement thermique d'extraits de plantes 20, mais leur évolutivité et une vitesse de transfert d'énergie sont limitées parce que le rapport de la surface au volume des réservoirs est réduite progressivement et devient impropre à l'échelle du processus. Un échangeur de chaleur est une alternative techniquement bien défini pour chauffer des cuves agitées , mais nécessite une offre abondante de chauffage et de milieux de refroidissement, par exemple, de la vapeur et de l' eau froide, ainsi qu'un débit volumétrique étroitement contrôlé qui est adaptée à la géométrie de l' échangeur de chaleur et propriétés des médias, par exemple., la capacité thermique spécifique. Cet article montre comment les trois méthodes peuvent être utilisées pour la précipitation induite par la chaleur des RSG du tabac, et RSG végétales en général. La mise en place et le fonctionnement de each méthode dans un environnement de laboratoire peut être utilisé pour évaluer leur aptitude à des processus à plus grande échelle. Le principal défi consiste à identifier les modèles à échelle réduite adéquates et les conditions de fonctionnement pour chaque opération qui ressemblent à des dispositifs et des conditions utilisées lors de la fabrication processus échelle. Les données présentées ici se réfèrent à des expériences menées avec des plants de tabac transgéniques exprimant le paludisme candidat vaccin Vax8 et protéine fluorescente DsRed 16, mais la méthode a également été appliquée avec succès à N. benthamiana plantes exprimant de manière transitoire 21 d' autres protéines biopharmaceutiques.
A expériences de conception-de-(DoE) approche 22 peut faciliter le processus de développement, et de floculants 23 peut également être bénéfique dans ce contexte comme décrit précédemment 8. La principale différence entre le blanchiment, les navires chauffés et des échangeurs de chaleur est que blanchissement est appliquée à des feuilles intactes au début du processus alors que le otla sienne sont appliqués aux extraits de plantes (figure 1).
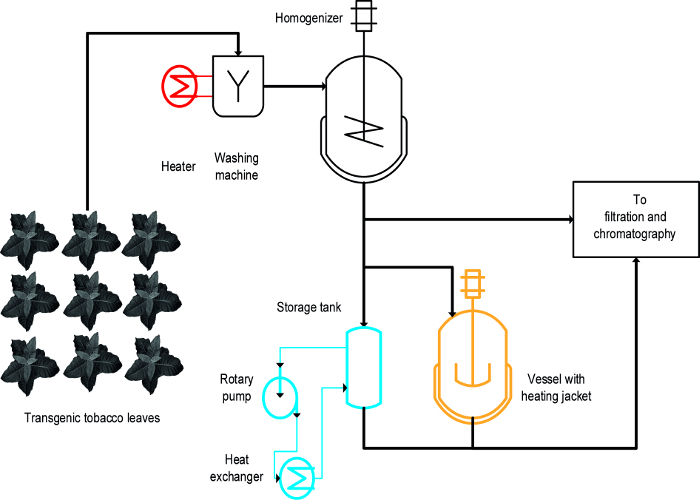
Figure 1:. Schéma de flux de processus illustrant la mise en œuvre de trois méthodes différentes pour le tabac HCP Heat Précipitation Le matériel végétal est lavé et homogénéisé avant clarification et purification. L'équipement pour l'étape de blanchiment (rouge) peut facilement être ajouté à la machine existante. En revanche, en utilisant un récipient agité (orange) et en particulier un échangeur de chaleur (bleu) nécessite un ou plusieurs dispositifs supplémentaires et les tubes. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
Les trois méthodes pour la précipitation de chaleur décrites ci – dessus peuvent éliminer efficacement RSG du tabac avant toute étape de purification chromatographique 16,17. Elles complètent d' autres stratégies visant à accroître la pureté initiale du produit, par exemple, guttation 29, rhizosecretion 30 ou centrifuge extraction 31,32, qui sont limitées à des protéines sécrétées. Cependant, les méthodes basées sur la chaleur ne peuvent être ut…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
References
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

