تطوير وصيانة للورم المريض قبل السريرية المستمدة طعم أجنبي نموذج للتحقيق في رواية مكافحة السرطان العلاج
Summary
الاستفادة من الأورام المستمدة من المريض في نموذج ما قبل السريرية تحت الجلد هو وسيلة ممتازة لدراسة فعالية علاجات جديدة، واكتشاف العلامات البيولوجية التنبؤي، والمخدرات مسارات المقاومة. هذا النموذج، في عملية التنمية المخدرات، أمر أساسي في تحديد مصير العديد من العلاجات المضادة للسرطان جديدة قبل التحقيق السريري.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
سرطان القولون والمستقيم (CRC) هو مساهم كبير في وفيات السرطان في الولايات المتحدة. في عام 2015، كان هناك ما يقدر ب 132700 حالة جديدة من اتفاقية حقوق الطفل مع 49700 حالة وفاة 1. على الرغم من أن التشخيص في المرضى الذين يعانون من مرض محلية ممتازة، والمرضى الذين يعانون من مرض متقدم لها نتائج سيئة، مما يجعل هذا أولوية رئيسية في تطوير علاجات جديدة. وعلى الرغم من مستوى نظم العلاج الكيميائي الرعاية والبيولوجية الحديثة التي يتم نشرها ضد هذا المرض، كان هناك فقط زيادة تدريجية في البقاء على قيد الحياة. وفقا لذلك، وهناك جهدا كبيرا في فهم مسارات سائق المعنية في تسهيل نمو الورم في هذا المرض. حددت أطلس شبكة السرطان الجينوم مؤخرا العديد من الممرات الرئيسية التي تورطت في اتفاقية حقوق الطفل التقلبات وتشمل: WNT، فسفوإينوزيتيد 3-كيناز (PI3K)، RAS، وتحويل عامل النمو β (TGF- β) وTP53 2. جنبا إلى جنب، مع التحقيقات التي تصف بعد التمديدوقد أشعلت مسارات لها أن تحفيز النمو في لجنة حقوق الطفل تطوير علاجات جديدة تهدف إلى تحسين كبير في البقاء على قيد الحياة في هذه الفئة من السكان المريض 3-5. وقد تم استخدام نماذج ما قبل السريرية في تطوير العقاقير الأورام أساسيا في هذه العملية في توقع النشاط السريري لهذه المركبات الجديدة.
وقد استخدمت النماذج قبل السريرية المختلفة في عملية تطوير العقاقير. وبالنظر إلى أن النماذج الحيوانية المعدلة وراثيا قبل السريرية وتخليد كانت خطوط الخلايا غير ناجحة في تحديد النشاط السريري لعلاج الأورام الجديدة، إلى حد كبير بسبب عدم قدرتها على عكس تعقيد الأورام البشرية، أنشئت المستمدة من المريض ورم طعم أجنبي (PDTX) نماذج. أكبر ميزة لهذا النموذج هو أن الورم التباين لا يزال قائما، ويعكس بشكل وثيق الخصائص الجزيئية وقابلية التنسيل من منشأ الورم المريض 6-9. توفر نماذج PDTX ممتازة في الجسم الحيمنصة قبل السريرية لدراسة وكلاء الرواية، ومسارات المقاومة للأدوية، واستراتيجيات التوافقية، وسرطان الخلايا الجذعية علم الأحياء 10.
ويتضح لمحة عامة عن عملية PDTX في الشكل 1. وهي تبدأ في العيادة، بالتراضي المرضى للسماح لبعض من أنسجة الورم الزائدة لاستخدامها لهذا البحث. وبعد ذلك، في عملية جراحية، وحقق قطعة من ورم من قبل الطبيب الشرعي ووضعها في وسائل الإعلام ليتم نقلها إلى أفراد البحث. مباشرة بعد ذلك، يتم قطع جزء من الورم الى قطع صغيرة وزرع في الفئران العوز المناعي تحت الجلد. مرة واحدة ينمو الورم، وpassaged ذلك إلى أجيال مختلفة من الفئران من أجل الحفاظ على الورم 10. عادة، بعد جيل F3 الورم يمكن توسيعها إلى دراسة العلاج حيث يتم تقييم مركبات جديدة و / أو العلاجات التوافقية. باستخدام الجيل التالي تسلسل (Exome تسلسل، RNA تسلسل وSNP مجموعة) المؤشرات الحيوية التنبؤية المحتملة اكتشافالطبعة التي تساعد في اختيار المرضى الذين قد لا يحقق استفادة من علاج معين.
الأهداف الأسمى استخدام نماذج PDTX هي: 1) تقييم فعالية علاجات جديدة وكيل واحد أو في تركيبة و2) تحديد المؤشرات الحيوية التنبؤية للحساسية أو مقاومة قبل التحقيق السريري. في هذه المخطوطة، ونحن نقدم منهجية في بدء والحفاظ على بنك CRC PDTX وتوفير مزايا وقيود من هذا النموذج في اكتشاف تطوير الأدوية.
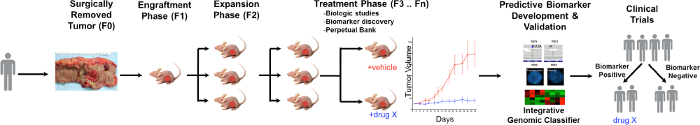
الشكل 1. نظرة عامة على البروتوكول النموذجي CRC PDTX. تم تلقي المريض المستمدة ورم من الجراحة وحقن مباشرة في الفئران عارية athymic تحت الجلد. مرة واحدة ينمو الورم يتم توسيعه إلى الأجيال اللاحقة وتوسعت في نهاية المطاف للدراسات العلاج. RESPO العلاجويتم تقييم NSES ويتم تحديد المؤشرات الحيوية التنبؤية التي قد تساعد في اختيار المريض. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تقدم PDTX منصة اكتشاف الأدوية وتحسين نموذج لأوجه القصور في نماذج ما قبل السريرية الأخرى التي لا يمكن الاعتماد عليها في التنبؤ النشاط السريري للمركبات جديدة. الأهم من ذلك، أورام في هذا النموذج هي مستقرة من الناحية البيولوجية، في الحفاظ على إمكانية النقيلي، وتظهر استجا…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

