קביעת פני התא יחסית והביטוי סה"כ של תעלות יונים רקומביננטי שימוש cytometry זרימה
Summary
הפרעות בקצב לב בירושה לעתים קרובות נגרמים על ידי מוטציות המשנות את מסירת השטח של תעלות יונים אחד או יותר. הנה, אנחנו מתאימים זרימת cytometry מבחני לספק כימות של ביטוי החלבון הכולל ותא יחסית משטח של תעלות יונים רקומביננטי לידי ביטוי בתאים TSA-201.
Abstract
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Introduction
מאמר זה מספק assay אמין לדווח הביטוי שטח פני התא היחסי של חלבונים בממברנה כגון תעלות יונים לידי ביטוי בתאים רקומביננטי באמצעות טכנולוגית cytometry הזרימה הקיימת. תעלות יונים הן חלבונים בממברנה נקבוביים יוצרים שאחראים לשליטת אותות חשמליים על ידי gating את זרימת יונים על פני קרום התא. הם מסווגים על ידי מנגנון הפעלה, טבע, סלקטיביות של מינים יון העוברים דרך הנקבוביות שבו הם נקודתיים. ברמה התאית ורקמות, והנתיבים יון מקרוסקופית דרך תעלות יונים הם תוצר של biophysical (gating ו חלחול), ביוכימיות (זירחון), ו biogenesis (סינתזה, glycosylation, סחר, השפלה) נכסים 1. כל התהליכים הללו הוא ייחודי לכל סוג של תעלות יונים, והוא מותאם למלא את התפקיד הפיזיולוגי של ערוץ יון. כתוצאה מכך, שינויים בכל תהליכים המכוילים אלה באמצעותבירושה או הנדסה גנטית, המכונה לעתים קרובות "channelopathy", יכול להיות מזיק הומאוסטזיס תא. חשוב להדגיש, כי מסירת הסכום "הנכון" של תעלות יונים על פני התא היא קריטית הומאוסטזיס תא. גם עליות קטנות (רווח של פונקציה) וירידה קטנה (הפסד של פונקציה) בפעילות ערוץ יון יש פוטנציאל לגרום פתולוגיה רצינית לאורך החיים. פגמי המשלוח פני התא של תעלות יונים בוגרות הוא הקובע חשוב channelopathies רב, כגון סיסטיק פיברוזיס (ערוץ יון CFTR) 2 ו הפרעות בקצב לב של טופס תסמונת QT הארוך (תעלות אשלגן לב) 3.
Channelopathies המשויכים מוות פתאומי של הלב 4. שהשכיחות העולמית הנוכחית של כל channelopathies הלב נחשב לפחות 1: 2,000-1: 3,000 לנפש 5 ואחראים כמחצית ca למוות קרדיאלי פתאומי בקצב לא סדירses 6. תפקוד לקוי של נתרן מתח מגודר לב, potassium-, ו בסידן תעלות יונים סלקטיבי ידועות לשחק תפקיד מרכזי בתהליך זה. The L-סוג Ca V 1.2 תעלות סידן מתח מגודרת נדרש ליזום התכווצות שריר הלב מסונכרן. הלב L- סוג Ca V 1.2 ערוץ הינו קומפלקס חלבון רב-למקטע מורכב למקטע α1 הראשי יוצרי הנקבוביות Ca V ו- CA V SS ו- CA V α2δ1 יחידות משנה עזר 7-12. ראוי לציין, כי ההשלמה המלאה של יחידות משנת עזר נדרשת לייצר ערוצי Ca V 1.2 פעילות לפי קרום הפלזמה ואינטראקציות דינמיות בין יחידות המשנה אלה חיוניות כדי לתמוך בפונקציה החשמלית הרגילה של הלב 13. Ca V SS מקדם את הביטוי על פני קרום התא של Ca V 1.2 ערוצים באמצעות אינטראקציה הידרופובי nanomolar הלא קוולנטיים 14. שיתוף ביטוי של wi למקטע Ca V α2δ1ה Ca V SS הנכנס Ca V α1 מגרה ביטוי השיא הנוכחי (5 עד פי 10) ומקדם ההפעלה ערוץ במתח שלילי יותר. קבל של פונקצית מוטציות של למקטע יוצרי הנקבוביות Ca V 1.2 נקשר עם צורה של הפרעות קצב חדריות שנקראת תסמונת QT הארוך 15 בעוד שורה של מוטציות נקודתיות בשלוש היחידות משנה הראשיים להרכיב ערוץ L- סוג Ca V 1.2 זוהה במקצועות הסובלים הפרעות קצב של טופס תסמונת QT הקצר 16,17. תעלות יונים הן חלבוני בממברנה שניתן לחקור מנקודת מבט ביוכימית (כימית חלבון) או באמצעות כלי אלקטרו (מכונה ייצור הנוכחי) ולעתים קרובות תוך שימוש בגישות משלימות אלה. אלקטרופיזיולוגיה, ב תיקון- clamping כל תא מסוים, היא פתרון ראוי להבהיר את הפונקציה של תעלות יוני 15 אבל לא יכולה לפתור שינויים בסחר חלבון משינויי biophysical שלהםנכסים. כימית חלבון יש, עם זאת, לעתים קרובות שימוש אפשרי מוגבלת בשל הביטוי הנמוך היחסי של חלבונים בממברנה גדולים ביחס חלבונים מסיסים קטנים. שיטות תפוקה גבוהה חזקות באמצעות הודעת קרינה צריכות להיות מפותחות על מנת לתת מענה ליקויים דווקא biogenesis חלבון גורמים לשינויי הביטוי פני התא של תעלות יונים.
Cytometry זרימה היא טכנולוגיה biophysical מועסק ספירת תאים, מיון, איתור סמן ביולוגי, והנדסת חלבון 18. כאשר פתרון מדגם של תאי חיים או חלקיקים מוזרק לתוך cytometer זרימה, התאים מסודרים לזרם יחיד שיכול להיות נחקר על ידי מערכת זיהוי של המכונה (איור 1). התזרים הראשון cytometer המכשיר המיוצר ב -1956 19 זוהה רק פרמטר אחד אבל cytometers הזרימה המודרני יש לייזרים מרובים גלאי קרינה המאפשרים זיהוי של יותר מ -30 פרמטרי ניאון 20,21.מסננים ומראות (אופטיקה פליטה) לכוון את פיזור האור או אור הניאון של תאי רשת אלקטרונית (פוטודיודה וגלאים) הממירה את אור יחסי עוצמתו. נתונים דיגיטליים מנותחים באמצעות תוכנות מיוחדות הפלט העיקרי מוצג כמזימת נקודה 21.
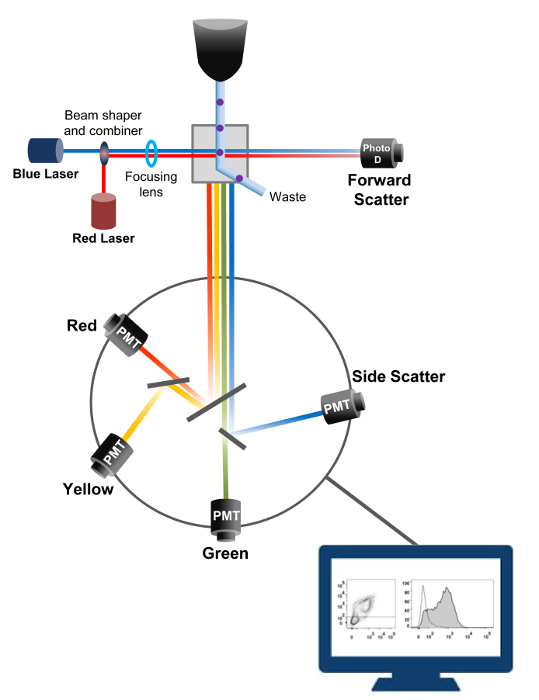
איור 1:. עקרונות Biophysical של זרימת cytometry מיון תאים בודדים נדחפים דרך נחיר בלחץ גבוה בתוך זרם של נוזל נדן אשר נע אותם על אחד או יותר נקודות החקירה לייזר. אלומת האור היא מוסחת על ידי התאים עוברים והאור שנאסף בכיוון קדימה (Forward הפיזור, FCS) נשלח פוטודיודה הממיר האור לאות ביחס ישירה לגודל של התא. האור נאסף גם בזווית של 90 ° לנתיב לייזר ונשלח גלאי (המכונה גם photomultipliers (PMT)).אור זה מנותב דרך מראות dichroic המאפשרות זיהוי של אות הפיזור בצד (SSC), המשקפת את הגרעיניות בתוך התאים, ואת פליטת פלורסנט אם fluorochromes הנרגש נוכחים בתא. שלושה גלאים (ירוק, צהוב, אדום) מיוצגים עם מסננים bandpass אורך גל שונה, מה שמאפשר זיהוי סימולטני של fluorochromes שונים. האותות השונים דיגיטציה ידי למחשב חיצוני והוסבו נתונים שינותחו לכמת את המאפיינים של התאים. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
קיבולת התפוקה הגבוהה של cytometers הזרימה נוצלה לכמת את ביטוי הקרום היחסי של סוג-בר רקומביננטי מתח מגודר סחר מחסר L- סוג Ca V 1.2 ערוצים יחידים משנה הקשורים בתאים חיים. בונת cDNA שיתוףדינג עבור החלבונים תויגו כפליים לבצע אפיטופ ללא ניאון תאי זמנית שיכול להיות מזוהה על ידי נוגדן מצומדות ניאון בלתי חדיר ו fluorophore תאי כי הוא פלורסנט constitutively. הן epitope התאית, הוכנסה בלופ תאי של החלבון, ואת fluorophore התאי, מוכנסת לאחר C- הסופית, מתורגם עם החלבון. בסדרה זו של ניסויים, חלבון Ca V α2δ1 תוכנן להביע hemagglutinin התאי epitope (HA) (YPYDVPDYA) זוהה על ידי (isothiocyanate והעמסה) FITC בלתי חדירה, מצומדות אנטי-HA ו mCherry כמו fluorophore התאי המהותי. כדי לקבוע את רמת הביטוי שטח פני התא היחסי של α2δ1 V mCherry-Ca HA-tagged חלבון, תאים רקומביננטי המבטאים את החלבון היתוך נבצרו לאחר transfection, ומוכתם antibod תג FITC- מצומדות העכבר חד שבטיים אנטי-HA epitopey (איור 2). FITC הוא תרכובת אורגנית ניאון כי הוא קטן יותר באופן משמעותי מאשר כתבים האנזים ולכן לא צפויות כמו להפריע לתפקוד ביולוגי. mCherry- Ca V α2δ1-HA ביתר TSA-201cells, מייצר גידול של 3-יומן משמעותי את קרינת FITC ו mCherry הקרין על מגרשים דו ממדים 22. בהתחשב בכך epitope HA ממוקם בחלק התאי של החלבון, את עוצמת הקרינה עבור FITC שהושגה בנוכחות של תאים שלמים לשקף את המדד היחסי של הביטוי על פני קרום התא של חלבון HA-tagged. הנגישות של epitope HA של המבנים הוא תוקף באופן שיטתי על ידי מדידת האות FITC לאחר התא permeabilization. מדד זה משמש גם כדי לאשש את ביטוי חלבון הכולל המנורמל מאז עוצמות קרינה היחסיות עבור FITC מוערכות בתאי permeabilized הם איכותיים להשוות את ערכי הקרינה היחסיים FOr mCherry נמדד בתנאי permeabilized והלא-permeabilized 22,23. חשוב לציין כי ספקטרום קרינה הפנימי מוסט לכיוון ערכים גבוהים יותר לאחר permeabilization אבל זה הערך היחיד שדווח הוא השינוי בעוצמת קרינה לעומת המבנה השליט. שינויים יחסיים בעוצמת הקרינה עבור המבנים הבדיקה מחושבים באמצעות עוצמת הקרינה ΔMean (ΔMFI) ערכים עבור כל fluorophore (mCherry או FITC). ניסויים נועדו למדוד את עוצמת הקרינה של יחסי מבחן לבנות את עוצמת הקרינה של מבנה השליטה לידי ביטוי באותם תנאים להגביל וריאציות ניסיוני הקרינה הפנימית של הנוגדן מצומדות fluorophore. שני חלבונים בממברנה נחקרו בהצלחה באמצעות assay: למקטע יוצרים הנקבובי של תעלות סידן L- סוג המתח מגודרת Ca V 1.2 14,22 ו בסדרה שונה שלניסויים, למקטע תאיים עזר Ca V α2δ1 22,23. הפרוטוקול הבא שמש כדי לקבוע את הביטוי על פני קרום התא של למקטע Ca V α2δ1 של L-סוג הלב Ca V 1.2 ערוץ בתנאים מלאים לאחר מוטציות המשפיעות על שינוי posttranslational של ערוץ היון. תחת תנאי ניסוי סטנדרטיים, הקרינה פני התא של FITC מגבירה מעין-ליניארי עם הביטוי של cDNA מקודדי חלבוני mCherry-Ca V α2δ1-HA (האיור 5 בהפניה 22).
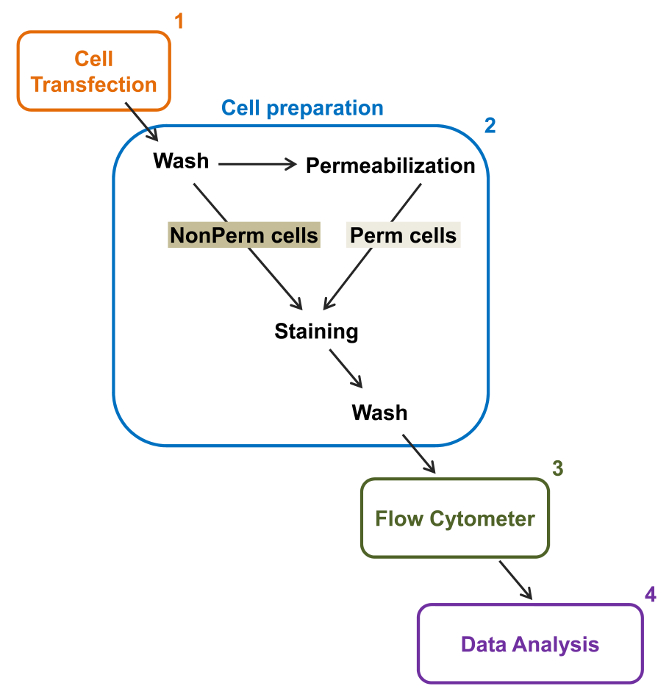
איור 2:. ייצוג סכמטי של תיוג סך קרום בזרימת cytometry פרוטוקול הניסוי התוכנית מתאר כמה מן השלבים העיקריים הדרושים כדי לכמת את הביטוי הכולל ותא השטח היחסי של תעלות יונים רקומביננטי ידי flow cytometry. תאים הם transfected עם בניית פעמים מתויגות mCherry-Ca V α2δ1-HA בתאי TSA-201 (1) ו מוכתמים לפני או אחרי permeabilization (2). נתוני פרמטרים מרובים נרכשים cytometer זרימה (3) עבור ניתוח רב משתנה (4). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
Assay cytometry מבוסס זרימה זו יושם בהצלחה על מדידת רמות פן כולל ותא היחסיים של fluorescently שכותרתו יוצרי הנקבוביות הקשורים יחידות המשנה של ערוצי סידן מגודר מתח 14,22,26. עדיף להשתמש כאשר חוקרים את ההשפעה של מוטציות גנטיות וכך מחייב כי עוצמת הקרינה הפנימית של המבנה fluorescently שכ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the “Fondation de l’Institut de Cardiologie de Montréal” to L.P.
Materials
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1,5 mL | Sarstedt | 72-690-001 | |
| Tubes 15 mL | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100-mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35-mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37°C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37°C water bath before use. |
| Trypsin-EDTA (1X) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 mL microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1X | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
References
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).

