Fastställande av den relativa cellytan och Total Expression av rekombinant jonkanaler med flödescytometri
Summary
Ärvda hjärtarytmier ofta orsakas av mutationer som förändrar ytan leverans av en eller flera jonkanaler. Här anpassar vi flödescytometri analyser för att ge en kvantifiering av den relativa totala och cellyteprotein uttryck av rekombinanta jonkanaler som uttrycks i TSA-201-celler.
Abstract
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Introduction
I detta dokument ges en tillförlitlig analys för att rapportera den relativa cellytan uttryck av membranproteiner såsom jonkanaler som uttrycks i rekombinanta celler med användning av den befintliga flödescytometri teknik. Jonkanaler är porbildande membranproteiner som är ansvariga för styrning av elektriska signaler genom grind flödet av joner genom cellmembranet. De klassificeras av aktiveringsmekanismen, natur, och selektivitet jonslag transit genom poren där de är lokaliserade. Vid de cellulära och vävnadsnivåer, de makroskopiska jonflöden genom jonkanaler är en produkt av biofysiska (gating och permeation), biokemiska (fosforylering), och biogenes (syntes, glykosylering, trafficking, och nedbrytning) egenskaper 1. Var och en av dessa processer är unik för varje typ av jonkanaler och är optimerad för att uppfylla den fysiologiska rollen för jonkanalen. Följaktligen förändringar i någon av dessa finjusterade processer genom enärftlig eller genetisk modifiering, ofta kallad "channelopathy", kan vara skadliga för cell homeostas. Det är viktigt att betona att leverera "rätt" mängd av jonkanaler vid cellytan är kritisk för cell homeostas. Även små ökningar (vinst-of-funktion) och små minskningar (förlust-of-funktion) i jonkanalaktiviteten har potential att orsaka en allvarlig patologi under en livstid. Defekter i cellytan leverans av mogna jonkanaler är en viktig determinant i talrika channelopathy, såsom cystisk fibros (CFTR jonkanalen) 2 och hjärtarytmier av långt QT-syndrom form (hjärtkaliumkanaler) 3.
Channelopathy förknippas med hjärt plötslig död 4. Den nuvarande globala förekomsten av alla hjärt channelopathy tros vara åtminstone 1: 2,000-1: 3000 per individ 5 och svarar för ungefär hälften av plötslig arytmier hjärtdöd caSES 6. Dysfunktion i hjärtspänningskänsliga natrium-, kalium- och kalcium- selektiva jonkanaler är kända för att spela en nyckelroll i denna process. L-typ Ca V 1,2 spänningsstyrda kalciumkanal krävs för att initiera synkroniserad hjärtmuskeln sammandragning. Hjärt L-typ Ca V 1,2-kanal är en multi-subenhet proteinkomplex bestående av huvud porbildande Ca V α1 subenheten och Ca V ß och Ca V α2δ1 hjälp subenheter 7-12. Observera att full uppsättning av hjälp subenheter krävs för att producera funktionella Ca V 1.2 kanaler på plasmamembranet och dynamiska samspelet mellan dessa subenheter är nödvändiga för att stödja den normala elektriska funktionen av hjärtat 13. Ca V ß befrämjar cellytan uttryck av ca V 1.2 kanaler genom en icke-kovalent nanomolära hydrofob växelverkan 14. Samexpression av Ca V α2δ1 subenhet with Ca V ß bundna Ca V α1 stimulerar toppström uttryck (5-10-faldigt) och främjar kanalaktivering på mer negativa spänningar. Få-of-funktion mutationer av porbildande subenhet Ca V 1,2 har förknippats med en form av ventrikulära arytmier kallas långt QT-syndrom 15 medan en mängd punktmutationer i de tre huvudenheterna bildar L-typ Ca V 1,2 kanal har identifierats hos patienter som lider av arytmier av kort QT-syndrom blankett 16,17. Jonkanaler är membranproteiner som kan undersökas ur en biokemisk perspektiv (proteinkemi) eller med hjälp av elektrofysiologiska verktyg (strömgenererande maskiner) och ofta använder dessa kompletterande metoder. Elektrofysiologi, särskilt hel-cell patch-fastspänning, är en lämplig metod för att belysa funktionen av jonkanaler 15 men kan inte lösa modifikationer i proteinhandeln från förändringar i deras biofysiskaegenskaper. Proteinkemi har dock ofta begränsad användning på grund av den relativt låga uttrycket av stora membranproteiner i förhållande till mindre lösliga proteiner. Robusta hög genomströmning metoder med hjälp av fluorescens avläsning måste utvecklas för att specifikt behandla defekter i protein biogenes orsakar förändringar i cellytan uttryck av jonkanaler.
Flödescytometri är en biofysisk teknik som används i cellräkning, sortering, biomarkör upptäckt, och protein 18. När en provlösning av levande celler eller partiklar injiceras i en flödescytometer är cellerna ordnade till en enda ström som kan sonderas av maskinens detektionssystem (figur 1). Den första flödescytometer instrument som produceras i 1956 19 upptäckt bara en parameter men moderna flödescytometrar har flera lasrar och fluorescensdetektorer som medger detektering av mer än 30 fluorescerande parametrar 20,21.Filter och speglar (utsläpps optik) rikta ljusspridning eller fluorescerande ljus av celler till ett elektroniskt nätverk (fotodiod och detektorer) som omvandlar ljuset i förhållande till dess intensitet. Digitala data analyseras med användning av specialiserad mjukvara och primärutgången visas som ett punktdiagram 21.
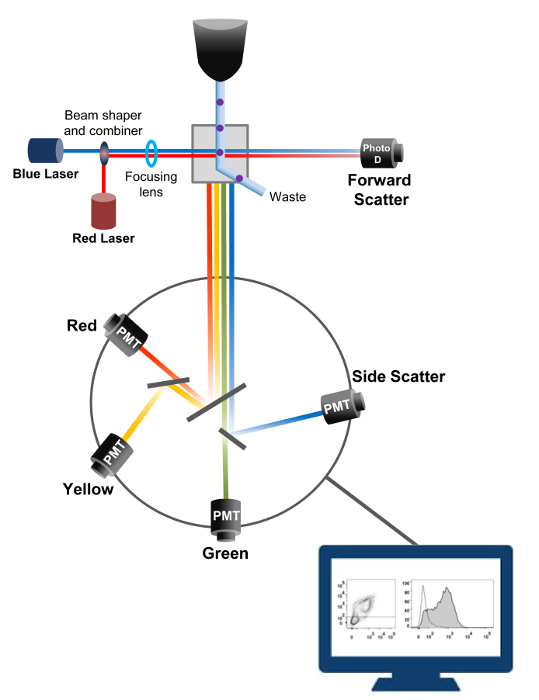
Figur 1:. Biophysical principerna för flödescytometri sortering Enstaka celler skjuts genom ett munstycke under högt tryck i en ström av omslutande vätska som förflyttar dem över en eller flera laserfrågepunkter. Ljusstrålen avlänkas av de passerande celler och ljuset uppsamlas i framåtriktningen (framåtspridning, FCS) sänds till en fotodiod som omvandlar ljuset till en signal som är proportionell mot storleken på cellen. Ljuset samlas också in vid en 90 ° vinkel i förhållande till laserbanan och sänds till detektorer (även kallade fotomultiplikatorer (PMT)).Detta ljus leds genom dikroiska speglar som tillåter detektering av sidospridningssignalen (SSC), vilket återspeglar den granularitet i cellerna, och de fluorescerande utsläppen om excite fluorokromer är närvarande i cellen. Tre detektorer (grön, gul och röd) är representerade med olika våglängd bandpassfilter, vilket gör att samtidig detektion av olika fluorokromer. De olika signalerna digitaliseras av en extern dator och omvandlas till data som kommer att analyseras för att kvantifiera egenskaper hos cellerna. Klicka här för att se en större version av denna siffra.
Hög kapacitet på flödescytometrar utnyttjades för att kvantifiera den relativa membran uttryck av rekombinant vildtyp och handel fattiga spänningskänsliga L-typ Ca V 1.2 kanaler och tillhörande subenheter i levande celler. cDNA konstruktioner coding för proteinerna dubbelt taggade att samtidigt ha en extracellulär icke-fluorescerande epitop som kan detekteras av en ogenomtränglig fluorescerande konjugerad antikropp och en intracellulär fluorofor som är konstitutivt fluorescerande. Både den extracellulära epitopen, insatt i en extracellulär slinga av proteinet, och den intracellulära fluorofor, införas efter C-terminalen, omräknas med proteinet. I denna serie av experiment, var Ca V α2δ1 protein konstruerad för att uttrycka ett extracellulärt hemagglutinin (HA) epitop (YPYDVPDYA) detekteras av en ogenomtränglig FITC (Fluoresceinisotiocyanat) -konjugerad anti-HA och mCherry som inneboende intracellulära fluoroforen. Att bestämma den relativa cellytan uttrycksnivån för mCherry-Ca V α2δ1 HA-märkt protein, rekombinanta celler som uttrycker fusionsproteinet skördas efter transfektion, och färgades med FITC-konjugerad monoklonal mus-anti-HA-epitop-taggen Antibody (Figur 2). FITC är en organisk fluorescerande förening som är betydligt mindre än enzym reportrar och därför inte så troligt att störa biologisk funktion. mCherry- Ca V α2δ1-HA överuttryckt i TSA-201cells, producerar en betydande 3-log ökning av FITC-fluorescens och mCherry fluorescens på tvådimensionella tomter 22. Med tanke på att HA-epitopen är belägen i den extracellulära delen av proteinet, fluorescensintensiteten för FITC erhölls i närvaro av intakta celler återspeglar den relativa index för cellytan uttryck av HA-märkt protein. Tillgängligheten till HA-epitopen i konstruktionerna systematiskt valideras genom mätning av FITC-signalen efter cell permeabilization. Denna åtgärd tjänar också till att bekräfta den normaliserade totala proteinuttryck eftersom de relativa fluorescensintensiteter för FITC beräknas i permeabiliserade celler är kvalitativt jämförbar med de relativa fluorescensvärdena for mCherry mätt under permeabiliserade och icke-permeabiliserade förhållanden 22,23. Det är viktigt att notera att den inneboende fluorescensspektrum skiftas mot högre värden efter permeabilisering men att det enda värde som rapporteras är den förändring i fluorescensintensitet jämfört med kontrollkonstruktionen. Relativa förändringar i fluorescensintensiteten för test konstruktioner uppskattas med hjälp av ΔMean Fluorescence Intensity (ΔMFI) värden för varje fluoroforen (mCherry eller FITC). Experiment har utformats för att mäta fluorescensintensiteten hos test konstruktionen i förhållande till fluorescensintensiteten hos kontroll konstruktet uttrycks under samma betingelser för att begränsa experimentella variationer i den inneboende fluorescensen av fluoroforen-konjugerade antikroppen. Två membranproteiner styrde studerades med användning av denna analys: det porbildande underenheten av L-typ spänningsstyrda kalciumkanal Ca V 1,2 14,22 och i en annan serie avexperiment, den extracellulära hjälp Ca V α2δ1 subenhet 22,23. Följande protokoll användes för att bestämma cellytan uttryck av Ca V α2δ1 subenheten av hjärt L-typ Ca V 1,2-kanal under kontrollbetingelser och efter mutationer som påverkar den posttranslationella modifieringen av jonkanalen. Under standardiserade experimentella betingelser, ökar cellytan fluorescens av FITC kvasi-linjärt med uttryck av cDNA som kodar för de mCherry-Ca V α2δ1-HA-proteiner (Figur 5 från referens 22).
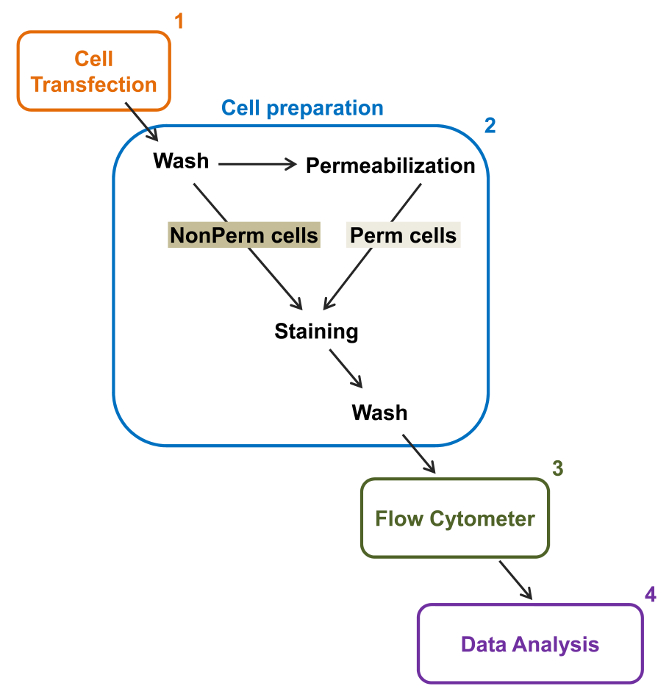
Figur 2:. Schematisk bild av den totala och membranmärkning i flödescytometri experimentella protokollet Systemet beskrivs några av de viktigaste stegen som krävs för att kvantifiera relativa totala och cellytan uttryck av rekombinanta jonkanaler från flow cytometry. Celler transfekteras med den dubbelmärkas konstruktion mCherry-Ca V α2δ1-HA i TSA-201-celler (1) och färgades före eller efter permeabilisering (2). FLERA uppgifter förvärvas i en flödescytometer (3) för multivariat analys (4). Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Denna flödescytometri-baserad analys har framgångsrikt tillämpats på mätning av relativa totala och cellyte nivåer av fluorescensmärkt porbildande och tillhörande subenheterna av spänningskänsliga kalciumkanaler 14,22,26. Det är bäst används när man undersöker effekterna av genetiska mutationer och kräver därför att den inneboende fluorescensintensiteten hos fluorescensmärkt taggade vildtyp konstruktionen vara minst 10 till 100 gånger större än för fluorescensintensiteten hos den fluore…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the “Fondation de l’Institut de Cardiologie de Montréal” to L.P.
Materials
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1,5 mL | Sarstedt | 72-690-001 | |
| Tubes 15 mL | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100-mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35-mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37°C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37°C water bath before use. |
| Trypsin-EDTA (1X) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 mL microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1X | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
References
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).

