والليزر السريع جس الطريقة يسهل تحديد غير الغازية وخالية الاتصال من الخواص الحرارية ورقة
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
يمكن للنباتات تنتج المواد الثمينة مثل المركبات الثانوية والبروتينات المؤتلف. تنقية الأخير من الكتلة الحيوية النباتية يمكن تبسيط بواسطة المعالجة الحرارية (ابيضاض). جهاز تبييض ويمكن تصميم أكثر دقة إذا عرفت الخصائص الحرارية من الأوراق في التفاصيل، أي قدرة الحرارة النوعية والتوصيل الحراري. قياس هذه الخصائص هو مضيعة للوقت وكثيفة العمالة، وعادة ما يتطلب أساليب الغازية التي الاتصال العينة مباشرة. هذا يمكن أن تقلل من المحصول المنتج وقد تكون غير متوافقة مع متطلبات الاحتواء، على سبيل المثال، في سياق الممارسات التصنيعية الجيدة. لمعالجة هذه القضايا، وقد وضعت غير الغازية، طريقة خالية من الاتصال التي تحدد قدرة الحرارة النوعية والتوصيل الحراري من أوراق النبات سليمة في حوالي دقيقة واحدة. الأسلوب ينطوي على تطبيق نبضة ليزر قصيرة المدى المحدد وشدة على منطقة صغيرة للعينة ورقة، مما تسبب في ارتفاع درجة الحرارة التي تقاس باستخدام مستشعر الأشعة تحت الحمراء القريب. يتم الجمع بين ارتفاع درجة الحرارة مع خصائص ورقة المعروفة (سمك وكثافة) لتحديد السعة الحرارية محددة. ثم يتم حساب التوصيل الحراري استنادا إلى بيان من انخفاض درجة الحرارة لاحق، مع الاشعاع الحراري والحمل الحراري نقل الحرارة في الاعتبار. وتناقش الحسابات المرتبطة والجوانب الحاسمة لمعالجة العينة.
Introduction
تجهيز نطاق واسع من المواد البيولوجية وغالبا ما يتطلب خطوات العلاج للحرارة مثل البسترة. المعدات اللازمة لمثل هذه العمليات يمكن أن تكون مصممة بشكل أكثر دقة إذا تم الخصائص الحرارية للمواد البيولوجية تتميز بشكل جيد، بما في ذلك القدرة محددة حرارة (ج ص، ق) والتوصيل الحراري (λ). هذه المعايير يمكن تحديدها بسهولة للسوائل، ومعلقات والخليط من الكالوري 1. ومع ذلك، وقياس هذه المعايير في العينات الصلبة يمكن أن يكون كثيفة العمالة، وغالبا ما يتطلب الاتصال المباشر مع العينة أو حتى تدميرها 2. على سبيل المثال، تقنيات ضوئي؛ ضوحراري تتطلب اتصال مباشر بين العينة وكاشف 3. وهذه القيود هي مقبولة خلال تجهيز الأغذية، ولكن غير متوافقة مع عمليات درجة عالية من التنظيم مثل إنتاج البروتينات الصيدلانية البيولوجية في النباتات في سياق ممارسة التصنيع الجيد (4). أنان هذا السياق، قد تكون هناك حاجة متكررة للرصد (على سبيل المثال، أسبوعيا) من الخواص الحرارية خلال فترة النمو في سبعة أسابيع للنباتات الفردية كأداة لمراقبة الجودة. إذا كان هذا الرصد تتطلب وتستهلك ورقة لكل قياس، لن يكون هناك أي الكتلة الحيوية اليسار إلى معالجة في وقت الحصاد.
بالإضافة إلى ذلك، باستخدام أجزاء ورقة فقط بدلا من شأنها أن تسبب إصابة للمصنع وتزيد من خطر نخر أو إصابة الممرض، ومرة أخرى تناقص الغلة العملية. قد يزيد من احتمال إصابة الممرض أيضا إذا كان سيتم استخدام الأسلوب مع اتصال مباشر إلى عينة، الأمر الذي أدى إلى خطر أن دفعة كاملة من النباتات يمكن أن يصاب من خلال الاتصال مع جهاز استشعار الملوثة. جوانب مشابهة لها للنظر في رصد مصنع يؤكد مثل الجفاف، على سبيل المثال، في سياق ecophysiological. على سبيل المثال، غالبا ما يتم رصد فقدان المياه من خلال تغيير في الكتلة الحيوية الطازجة، والتي تتطلب تري الغازيةatment من النباتات قيد التحقيق 5، على سبيل المثال، تشريح ورقة. بدلا من ذلك، تحديد السعة الحرارية محددة، والتي تعتمد على المحتوى المائي لعينة، بطريقة غير الغازية وصفه هنا، ويمكن استخدامها كمعلمة بديلة لوضع الماء من النباتات. في كلتا الحالتين (إنتاج الأدوية والفيزيولوجيا البيئية)، فإن الضغوط المصطنعة الناجمة عن تقنيات القياس المدمرة أو الغازية تكون ضارة لأنها يمكن أن تشوه البيانات التجريبية. طرق فلاش لذلك، تم ذكره سابقا 6 أو وضع عينات بين لوحات الفضة 7 غير مناسبة لمثل هذه العمليات والتجارب، إما لأنها تتطلب اتصال مباشر للعينة أو هي مدمرة. يجب أن تحدد المعلمات ج ص، ق وλ من أجل تصميم المعدات التكنولوجية لخطوة ابيضاض التي يمكن تبسيط تنقية المنتج وبالتالي تقليل تكاليف التصنيع 8-10. كلا جص، ق وλ يمكن الآن أن تحدد بسرعة عن طريق غير مدمرة بالقرب من الأشعة تحت الحمراء (الجرد) الليزر خالية من الاتصال التحقيق بطريقة متسقة وقابلة للتكرار 11 وسيتم شرح هذه الطريقة الجديدة في التفاصيل أدناه. النتائج المتحصل عليها مع هذه الطريقة استخدمت بنجاح لمحاكاة انتقال الحرارة في أوراق التبغ 12، والسماح للتصميم معدات التجهيز المناسبة واختيار معايير المطابقة مثل درجة الحرارة ابيضاض.
طريقة سهلة لإنشاء (الشكل 1)، ولها مرحلتين والقياس والتحليل، كل واحدة منها تضم اثنين من الخطوات الرئيسية. في مرحلة القياس، وأول تسخين عينة أوراق محليا من قبل نبضة ليزر قصيرة وسجلت أقصى درجة حرارة العينة. ثم يتم تسجيل البيانات الشخصية درجة حرارة العينة لمدة 50 ثانية. في مرحلة التحليل، خصائص ورقة مثل الكثافة (تحدد بسهولة ودقة من قبل measurem pycnometricوالأنف والحنجرة) وجنبا إلى جنب مع الحد الأقصى لدرجة حرارة العينة لحساب ج ص، ق. في الخطوة الثانية، يتم استخدام الشخصي في درجة الحرارة ورقة كمدخل لتوازن معادلة الطاقة، مع التوصيل، والاشعاع الحراري بعين الاعتبار، لحساب λ.
يتم توفير إرشادات مفصلة خطوة بخطوة في قسم البروتوكول، وتوسيع على محتويات الفيديو المصاحب. ثم تظهر القياسات النموذجية في قسم النتائج. وأخيرا، ويسلط الضوء على فوائد وقيود الأسلوب في قسم مناقشة جنبا إلى جنب مع التحسينات الممكنة والمزيد من التطبيقات.
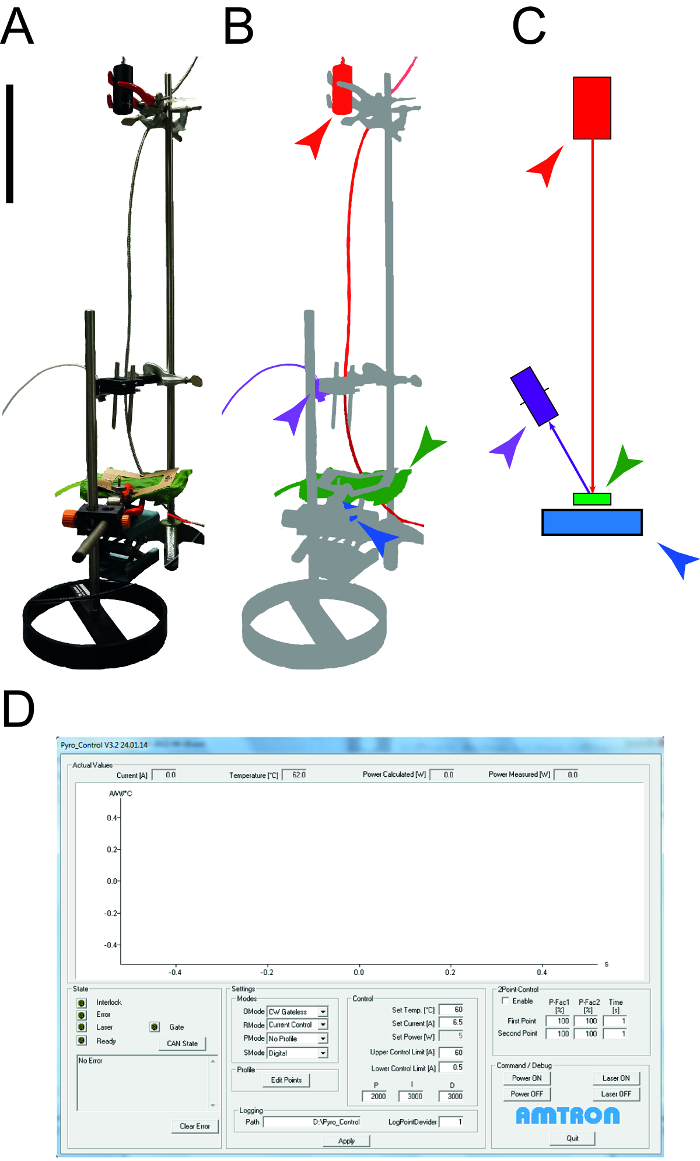
الشكل 1: جهاز يستخدم لتحديد الخصائص الحرارية ورقة. A. صورة للجهاز قياس تستخدم لتحديد السعة الحرارية محددة والتوصيل الحراري للجنيهأفيس. لا تظهر الأجهزة الطرفية (أجهزة الكمبيوتر، والذبذبات). ب. التمثيل التخطيطي للجهاز القياس. وسلط الضوء على الليزر والمعدات المتصلة باللون الأحمر، يظهر الكشف عن قوائم الجرد الوطنية لقياس درجة الحرارة في الأرجواني، والعينة ورقة خضراء واستشعار القوة الضوئي باللون الأزرق. C. رسم من عناصر الإعداد قياس مع رمز اللون نفسه كما في B. يشير شريط حجم 0.1 م. د. لقطة توضح العناصر النموذجية للبرنامج حاسوبي لمراقبة الليزر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
و، طريقة القياس غير المدمرة خالية من الاتصال المذكورة أعلاه يمكن أن تستخدم لتحديد ج ص، ق وʎ بطريقة متزامنة وقابلة للتكرار. حساب ʎ على وجه الخصوص يعتمد على العديد من المعلمات التي تعتبر حساسة للأخطاء. ومع ذلك، كان تأثير هذه الأخطاء وجد إما خطية أو شبه النسبي…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
References
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

