소포체와 미토콘드리아의 상호 작용의 연구에 의해<em> 현장에서</em> 근접 내고 분석 고정 세포의
Summary
여기, 우리는 고정 된 세포에서 소포체와 미토콘드리아의 내생 적 상호 작용을 시각화하고 고감도로 정량화 할 수있는 절차를 설명합니다. 프로토콜은이 미토콘드리아 관련 막 계면에서 이노시톨에게 1,4,5- 트리 포스페이트 수용체 / 혈당 조절 단백질 75 / 전압 가변 음이온 채널 / 시클로 필린의 D 복합체 타겟팅 시츄 근접 결찰 분석법 최적화 기능.
Abstract
Structural interactions between the endoplasmic reticular (ER) and mitochondrial membranes, in domains known as mitochondria-associated membranes (MAM), are crucial hubs for cellular signaling and cell fate. Particularly, these inter-organelle contact sites allow the transfer of calcium from the ER to mitochondria through the voltage-dependent anion channel (VDAC)/glucose-regulated protein 75 (GRP75)/inositol 1,4,5-triphosphate receptor (IP3R) calcium channeling complex. While this subcellular compartment is under intense investigation in both physiological and pathological conditions, no simple and sensitive method exists to quantify the endogenous amount of ER-mitochondria contact in cells. Similarly, MAMs are highly dynamic structures, and there is no suitable approach to follow modifications of ER-mitochondria interactions without protein overexpression. Here, we report an optimized protocol based on the use of an in situ proximity ligation assay to visualize and quantify endogenous ER-mitochondria interactions in fixed cells by using the close proximity between proteins of the outer mitochondrial membrane (VDAC1) and of the ER membrane (IP3R1) at the MAM interface. Similar in situ proximity ligation experiments can also be performed with the GRP75/IP3R1 and cyclophilin D/IP3R1 pairs of antibodies. This assay provides several advantages over other imaging procedures, as it is highly specific, sensitive, and suitable to multiple-condition testing. Therefore, the use of this in situ proximity ligation assay should be helpful to better understand the physiological regulations of ER-mitochondria interactions, as well as their role in pathological contexts.
Introduction
미토콘드리아 소포체 (ER)은 세포 소기관 독립적 아니지만 미토콘드리아 관련 소포체 막 (MAM)로 정의 접촉 부위에서 구조적 및 기능적으로 상호 작용한다. 사실, MAMS은 양쪽에서 단백질 간의 상호 작용을 가능하게하여 ER의 세포막과 미토콘드리아가 밀접하게 나란히 놓이는되는 지역에 해당합니다. 그럼에도 불구하고,이 세포 소기관의 멤브레인은이 지역 내에서 융합하지 않는, 그래서 그들은 자신의 별도의 기관을 유지한다. MAMS은 에너지 대사 및 세포 생존 1-3에 영향을 미치는, 미토콘드리아에 ER에서 칼슘의 중요한 역할 (칼슘)과 인지질 전송을한다.
응급실과 미토콘드리아 사이의 관계는 제 1 전자 현미경으로 1970 년대에 가시화되었다. 그 이후, 투과 전자 현미경 4,5-, 6,7- 전자 단층 또는 ER 및 미토콘드리아 특정 형광의 면역 지역화S / 형광 단백질 (8)는 고전 ER-미토콘드리아의 상호 작용을 연구하는 데 사용되었다. MAM의 분석을위한 다른 유용한 도구는 세포 이하 분획의 사용에 기초한다. 이것은 퍼콜 구배 (9)에 결합 된 차동 초 원심 MAM 분획을 분리 할 수있다. 그러나, 최종 제품은 풍부한 MAM 분획이 아닌 순수한 분획을 포함한다. 전부,이 전략은 특히 민감한 및 / 또는 정량적하지 않습니다, 그들은 큰 심사에 쉽게 의무가 없습니다. 다르게는, 약물 – 유도 성 형광 간 소기관 링커를 사용하여 유전 학적 접근이 등장 있지만 단백질 10의 내인성 발현 수준 소기관 상호 작용의 분석을 허용하지 않는다.
MAM 11의 IP3R / GRP75 / VDAC 복잡 Szabadkai의 발견에 기초하여, 우리는 ER-미토콘드리아의 상호 작용을 분석하는 정량적 방법을 개발 하였다. 우리는 현장 근접 ligati에 사용분석에 감지하고 VDAC1 및 IP3R1 사이의 상호 작용을 정량화하고, 고정 셀 (12)의 MAM 인터페이스에서 칼슘 2 + -channeling 복잡한에 관여하는 두 소기관 표면 단백질. 간단히 말해서, 우리는 ER 막에서 외부 미토콘드리아 막 (마우스 항 – VDAC1 차 항체) 및 IP3R1 (토끼 항 IP3R1 차 항체) (그림 1, 패널)에서 VDAC1을 프로빙. 그리고, 상기 분석에있어서, 우리는 항 – 마우스와 상보적인 올리고 뉴클레오티드로 확장되어 접합 항 – 토끼 IgG를 (마우스 및 토끼 근접 결찰 분석법 프로브) 모두를 추가했다. 두 개의 표적 단백질이 40 내지 이하의 거리에있는 경우, 올리고 뉴클레오티드는 원형의 DNA를 주형 (도 1, 패널 B)의 형성을 허용하도록 연속적으로 첨가 커넥터 올리고와 혼성화 할 수있다. 이 원형 DNA 분자에 공유 변위 센서 중 하나에 장착 된 단일 가닥 DNA 생성물 생성 결찰 증폭된다 (도 1, 패널 c) </stro> NG. MAM 계면에서 ER 및 미토콘드리아 간의 거리 내지 6 근접 결찰 증폭 인해 텍사스 레드 표지 된 올리고 뉴클레오티드 프로브 (도 1, 패널 (D)의 혼성화에이어서 검출 선도 할 수있는 (25)는 10 nm 내지 때문에 ). 각 형광 점 따라서 개별 셀의 현장에서 ER-미토콘드리아 상호 작용의 정량화를 허용 VDAC1 / IP3R1 사이의 상호 작용을 나타냅니다.
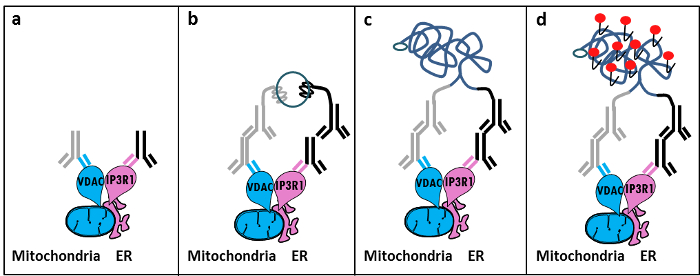
그림 1 : 제자리 근접 내고 분석에 의해 소포체 – 미토콘드리아 상호 작용의 검출의 개략도. a) VDAC1 및 MAM의 계면 근방에서 그 에피토프에 결합 할 수 IP3R1 향한 토끼 차 항체에 대해 유도 마우스 일차 항체 b) 인접 결찰 프로브 쌍의 또마우스와 토끼 IgG에 대해 지시했다. 이 프로브는 커넥터 올리고의 결찰에 대한 템플릿을 형성 할 수있는 DNA 가닥을 첨부했습니다. c) 결찰 후 형성된 원형의 DNA 가닥이 텍사스 레드 표지 된 올리고 뉴클레오티드를 이용하여 형광 현미경으로 도트 시각화) D 증폭 될 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
시츄 근접 결찰 분석 실험에서 유사한 항체 GRP75 / IP3R1 쌍뿐만 아니라 시클로 필린의 D (CypD) 수행 될 수있다 / IP3R1 항체 CypD는 MAM 계면에서 IP3R / GRP75 / VDAC 복합체와 상호 작용하는 것으로 나타났다 것을 고려 12-14.
Protocol
Representative Results
Discussion
Collectively, our studies indicate that the in situ proximity ligation assay is truly a relevant strategy to follow and quantify endogenous ER-mitochondria interactions in fixed cells, without the need for using organelle-specific fluorophores or fluorescent proteins. The specific use of VDAC1/IP3R1 antibodies has been adapted to study ER-mitochondria interactions in HuH7 cells. However, alternative isoforms of VDAC and IP3R may be used, depending on the cell type. In this case, antibodies need to be validated b…
Disclosures
The authors have nothing to disclose.
Acknowledgements
우리는 최적화 및 프로토콜을 검증하기 위해 기여 우리의 실험실에있는 모든 사람들에게 감사합니다. 이 작품은 INSERM과 국가 연구 기관 (ANR-09-JCJC-0116 및 ANR-11 BSV1-033-02)에 의해 지원되었다. ET는 고등 교육과 연구의 프랑스 내각에서 연구 교제 그녀의 박사 과정에 지원되었다.
Materials
| Formaldehyde | Sigma | F-8775 | |
| Glycine | Sigma | G-8898 | |
| Triton | Sigma | T8532 | |
| 35mm Glass bottom culture dishes | MatTeK corporation | P35G-0-14-C | |
| Blocking solution | Sigma | DUO-92004 or DUO-92002 | provided in the Duolink PLA probes, Sigma |
| VDAC1 antibody | Abcam | ab14734 | |
| IP3R1-H80 antibody | Santa Cruz | sc28614 | |
| CypD antibody | Abcam | ab110324 | |
| Grp75 antibody | Santa Cruz | sc13967 | |
| TBS 10X | euromedex | ET220 | Dilute to obtain 1X |
| Tween 100X | euromedex | 2001-B | dilute in TBS to obtain 0,01% |
| PLA Probes Mouse MINUS | Sigma | DUO-92004 | Duolink, Sigma |
| PLA Probes Rabbit PLUS | Sigma | DUO-92002 | Duolink, Sigma |
| Duolink detection reagents red | Sigma | DUO-92008 | Duolink, Sigma |
| Ligation solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Ligase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Amplification solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Polymerase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Duolink Mounting Medium | Sigma | DUO80102 | Duolink, Sigma |
| Softwares: | |||
| Blob-finder software | BlobFinder is a freely distributed software that can perform calculations on cells from fluorescence microscopy images. This software can be downloaded for free from The Centre for Image Analysis at Uppsala University who have developed the software and the work was supported by the EU FP6 Project ENLIGHT and Olink Bioscience. http://www.cb.uu.se/~amin/BlobFinder/index_files/Page430.htm | ||
| ImageJ software | Can be downloaded for free from: http://rsb.info.nih.gov/ij/download.html |
References
- Bravo-Sagua, R., et al. Organelle communication: signaling crossroads between homeostasis and disease. The international journal of biochemistry & cell biology. 50, 55-59 (2014).
- Giorgi, C., et al. Mitochondria-associated membranes: composition, molecular mechanisms, and physiopathological implications. Antioxidants & redox signaling. 22, 995-1019 (2015).
- Phillips, M. J., Voeltz, G. K. Structure and function of ER membrane contact sites with other organelles. Nature reviews. Molecular cell biology. 17, 69-82 (2016).
- Cosson, P., et al. The RTM resistance to potyviruses in Arabidopsis thaliana: natural variation of the RTM genes and evidence for the implication of additional genes. PLoS One. 7, 39169 (2012).
- Mannella, C. A. Structure and dynamics of the mitochondrial inner membrane cristae. Biochim Biophys Acta. 1763, 542-548 (2006).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. The Journal of cell biology. 174, 915-921 (2006).
- Mannella, C. A., Buttle, K., Rath, B. K., Marko, M. Electron microscopic tomography of rat-liver mitochondria and their interaction with the endoplasmic reticulum. Biofactors. 8, 225-228 (1998).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280, 1763-1766 (1998).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4, 1582-1590 (2009).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39, 121-132 (2010).
- Szabadkai, G., et al. Chaperone-mediated coupling of endoplasmic reticulum and mitochondrial Ca2+ channels. J Cell Biol. 175, 901-911 (2006).
- Tubbs, E., et al. Mitochondria-associated endoplasmic reticulum membrane (MAM) integrity is required for insulin signaling and is implicated in hepatic insulin resistance. Diabetes. 63, 3279-3294 (2014).
- Paillard, M., et al. Depressing Mitochondria-Reticulum Interactions Protects Cardiomyocytes From Lethal Hypoxia-Reoxygenation Injury. Circulation. 128, 1555-1565 (2013).
- Rieusset, J., et al. Disruption of calcium transfer from ER to mitochondria links alterations of mitochondria-associated ER membrane integrity to hepatic insulin resistance. Diabetologia. 59, 614-623 (2016).
- Allalou, A., Wahlby, C. BlobFinder, a tool for fluorescence microscopy image cytometry. Computer methods and programs in biomedicine. 94, 58-65 (2009).
- Theurey, P., et al. Mitochondria-associated endoplasmic reticulum membranes allow adaptation of mitochondrial metabolism to glucose availability in the liver. Journal of molecular cell biology. , (2016).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Soderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature methods. 3, 995-1000 (2006).
- De Pinto, V., Messina, A., Lane, D. J., Lawen, A. Voltage-dependent anion-selective channel (VDAC) in the plasma membrane. FEBS letters. 584, 1793-1799 (2010).
- Kaul, S. C., Taira, K., Pereira-Smith, O. M., Wadhwa, R. Mortalin: present and prospective. Experimental gerontology. 37, 1157-1164 (2002).

