Kartierung der Bindungsstelle eines Aptamer auf ATP Mit Micro Thermophorese
Summary
MicroScale Thermophoresis (MST) is a sensitive technology to characterize aptamer-target interactions. This manuscript describes an MST protocol to characterize aptamer-small molecule interactions.
Abstract
Characterization of molecular interactions in terms of basic binding parameters such as binding affinity, stoichiometry, and thermodynamics is an essential step in basic and applied science. MicroScale Thermophoresis (MST) is a sensitive biophysical method to obtain this important information. Relying on a physical effect called thermophoresis, which describes the movement of molecules through temperature gradients, this technology allows for the fast and precise determination of binding parameters in solution and allows the free choice of buffer conditions (from buffer to lysates/sera). MST uses the fact that an unbound molecule displays a different thermophoretic movement than a molecule that is in complex with a binding partner. The thermophoretic movement is altered in the moment of molecular interaction due to changes in size, charge, and hydration shell. By comparing the movement profiles of different molecular ratios of the two binding partners, quantitative information such as binding affinity (pM to mM) can be determined. Even challenging interactions between molecules of small sizes, such as aptamers and small compounds, can be studied by MST. Using the well-studied model interaction between the DH25.42 DNA aptamer and ATP, this manuscript provides a protocol to characterize aptamer-small molecule interactions. This study demonstrates that MST is highly sensitive and permits the mapping of the binding site of the 7.9 kDa DNA aptamer to the adenine of ATP.
Introduction
Wechselwirkung zwischen Molekülen ist die Basis der Natur. Daher Wissenschaftler in vielen Bereichen der Grundlagen- und angewandten Forschung versuchen die grundlegenden Prinzipien der molekularen Wechselwirkungen verschiedener Arten zu verstehen. Micro Thermophorese (MST) können Wissenschaftler die schnelle, präzise und kosteneffiziente und qualitätskontrollierte Charakterisierung von molekularen Wechselwirkungen in Lösung durchzuführen, mit einer freien Wahl von Puffern. Es gibt bereits mehr als 1.000 Publikationen MST mit, ab 2016 allein, beschreibt verschiedene Arten von Analysen, einschließlich Bibliothek Vorführungen, Ereignis Validierungen Bindung, kompetitive Assays, und Experimente mit mehreren Bindungspartnern 1-8. Im Allgemeinen erlaubt MST die Untersuchung der klassischen Bindungsparameter wie Bindungsaffinität (pM bis Mm), Stöchiometrie und Thermodynamik, der jede Art von molekularen Wechselwirkungen. Ein großer Vorteil der MST ist die Fähigkeit, Bindungsereignisse unabhängig von der Größe der Interaktionspartner zu studieren. Auch Heraus-fordernd Wechselwirkungen zwischen kleinen Nukleinsäure-Aptamere (15-30 nt) und Ziele wie kleine Moleküle, Medikamente, Antibiotika oder Metaboliten quantifiziert werden können.
Aktuelle state-of-the-art Technologien Aptamer-Target – Wechselwirkungen sind entweder im Labor intensiv und sehr komplex zu charakterisieren oder scheitern Aptamer-kleines Molekül 9,10 Wechselwirkungen zu quantifizieren. Oberflächenplasmonresonanz (SPR) -basierte Assays 11,12 und wirklich markierungsfreie kalorimetrischen Ansätze wie Isothermen Titrations – Kalorimetrie (ITC) 13-15, isokratische Elution 16, Gleichgewicht Infiltrations 17,18, in-line Sondieren 19, Gel- Shift – Assays, Stopped fl ow Fluoreszenz- Spektroskopie 20,21, Fluoreszenzanisotropiemessungen (FA) 22,23, Einzelmolekül – Fluoreszenz – Bildgebung 24,25 und Bio-Schicht – Interferometrie (BLI) 26 sind ebenfalls entweder ungenau oder nicht kompatibel mit Aptamer-kleines Molekül Wechselwirkungen. Andere principal Probleme dieser Verfahren sind eine geringe Empfindlichkeit, hohe Probenverbrauch, Immobilisation, Massentransportbeschränkungen auf Oberflächen und / oder Puffer Einschränkungen. Nur wenige dieser Technologien bieten integrierte Kontrollen für die Aggregation und Adsorption Effekte.
MST stellt ein leistungsfähiges Werkzeug für Wissenschaftler , diese Einschränkung zu überwinden , um die Wechselwirkungen zwischen Aptamere und kleine Moleküle , 27-29, sowie andere Ziele, wie Proteine 30-33 zu studieren. Die Technologie beruht auf der Bewegung von Molekülen durch Temperaturgradienten. Diese gerichtete Bewegung, die so genannte "Thermophorese," hängt von der Größe, der Ladung und Hydrathülle des Moleküls 34,35. Die Bindung eines Liganden an das Molekül direkt an mindestens einen dieser Parameter zu verändern, in einer veränderten thermophoretische Mobilität führt. Liganden mit kleinen Größen haben nicht erhebliche Auswirkungen in Bezug auf die Größenänderung von der ungebundenen zum gebundenen Zustand, aber sie können dr haben amatic Auswirkungen auf die Hydrathülle und / oder Ladung. Die Veränderungen in der thermophoretische Bewegung der Moleküle nach der Wechselwirkung mit dem Bindungspartner ermöglicht die Quantifizierung der Grundbindungsparameter 2,7,34,36,37.
Wie in 1A dargestellt ist , besteht der MST Vorrichtung eines Infrarotlasers auf die Probe innerhalb der Glaskapillaren fokussiert die gleiche Optik wie für die Fluoreszenzdetektion. Die thermophoretischer Bewegung von Proteinen über die Eigenfluoreszenz von Tryptophane 6 oder eines fluoreszierend 3,8 Interaktionspartner markiert überwacht werden kann , während der Laser einen Temperaturgradienten (AT von 2-6 ° C) herstellt. Die sich ergebende Temperaturdifferenz im Raum, & Delta; T, führt zur Verarmung oder Anreicherung von Molekülen im Bereich der erhöhten Temperatur, die durch die Soret quantifiziert werden kann Koeffizienten (S T):
g "/>
c hot stellt die Konzentration in dem erwärmten Bereich, und c kalt ist die Konzentration in dem anfänglichen Kaltbereich.
Wie in 1B gezeigt , um eine typische MST Versuchsergebnisse in einer MST Bewegungsprofil (Zeitverlauf), die aus verschiedenen Phasen, die durch ihre jeweiligen Zeitrahmen getrennt werden können. Die anfängliche Fluoreszenz wird in den ersten 5 s in Abwesenheit des Temperaturgradienten gemessen, um die genaue Start Fluoreszenz zu definieren und für Photobleaching oder photoenhancement zu überprüfen. Der Temperatursprung (T-Jump) repräsentiert die Phase, in der die Fluoreszenzänderungen vor thermophoretischer Bewegung. Diese anfängliche Abnahme der Fluoreszenz hängt von wärmeabhängige Veränderungen von fl uorophore Quantenausbeute. Die Thermophorese Phase folgt, in der die Fluoreszenz abnimmt (oder zunimmt) aufgrund der thermophoretische Bewegung der Moleküle, bis die Stationärzustandsverteilung erreicht wird.Die umgekehrte TJump und die gleichzeitige Rückdiffusion der fluoreszierenden Moleküle können wie in 1B angegeben beobachtet werden , nachdem der Laser ausgeschaltet ist. Um grundlegende Bindungsparameter, verschiedene Molverhältnisse der Interaktionspartner für den Zugriff werden analysiert und verglichen. Typischerweise werden 16 unterschiedliche Verhältnisse in einem MST Experiment untersucht, wohingegen der optische sichtbaren Molekül konstant gehalten wird und mit zunehmender Menge des unmarkierten Liganden zugeführt wird. Die Wechselwirkung zwischen den beiden Bindungspartner induziert Veränderungen in der Thermophorese, und somit in der normalisierten Fluoreszenz, F Norm, die wie folgt berechnet wird:
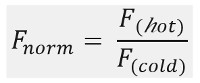
F heiß und F kalt stellen Intensitäten fluoreszenz bei de fi nierten Zeitpunkte der MST Spuren gemittelt. Bindungsaffinitäten (K d oder EC 50 -Werte) können durch curv berechnet werdene Fitting (1C).
Insgesamt ist MST ein leistungsfähiges Werkzeug molekularen Wechselwirkungen jeglicher Art zu studieren. Dieses Manuskript bietet ein Protokoll das herausfordernde Interaktion zwischen dem kleinen Molekül Adenosintriphosphat (ATP; 0,5 kDa) zu charakterisieren und die 25-nt kurze ssDNA Aptamer DH25.42 (7,9 kDa). Im Laufe des Manuskripts wird die Bindungsstelle des Aptamers an das ATP-Molekül an die Adenin-Gruppe des ATP kartiert unten.
Protocol
Representative Results
Discussion
Qualitätskontrollen:
Unspezifische Klebe- / Adsorption von Probenmaterial an Oberflächen sowie Aggregationseffekte, haben einen dramatischen Einfluss auf die Qualität der Affinitätsdaten. Doch nur wenige state-of-the-art Technologien bieten genaue und schnelle Möglichkeiten zu überwachen und diese Effekte zu vermeiden. MST bietet integrierte Qualitätskontrollen, die erkennen und helfen, diese Probleme zu überwinden, so dass für die schrittweise Optimierung der technischen Einrichtung. …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren haben keine Bestätigungen.
Materials
| Aptamer binding buffer | 20 mM Tris pH7.6; 300 mM NaCl; 5 mM MgCl2; 0.01%Tween-20 | ||
| Fluorescently labeled ATP aptamer | IDT, Leuven, Belgium | sequence: DH25.42 50-Cy5-CCTGGGGGAGT-ATTGCGGAGGAAGG-3 | |
| ATP | Sigma Aldrich, Germany | A2383 | 10 mM stock solutions stored at – 20 °C |
| ADP | Sigma Aldrich, Germany | A2754 | 10 mM stock solutions stored at – 20 °C |
| AMP | Sigma Aldrich, Germany | A2252 | 10 mM stock solutions stored at – 20 °C |
| Adenine | Sigma Aldrich, Germany | A8626 | 10 mM stock solutions stored at – 20 °C |
| SAM | Sigma Aldrich, Germany | A7007 | 10 mM stock solutions stored at – 20 °C |
| dATP | Sigma Aldrich, Germany | 11934511001 | 10 mM stock solutions stored at – 20 °C |
| CTP | Sigma Aldrich, Germany | C1506 | 10 mM stock solutions stored at – 20 °C |
| GTP | Sigma Aldrich, Germany | G8877 | 10 mM stock solutions stored at – 20 °C |
| Monolith NT.115 | NanoTemper Technologies, Munich, Germany | MO-G008 | Blue/Red Channel MST device with standard detector, Monolith NT115 pico is MST device with high sensitivity detector |
| Monolith NT.115 capillaries Standard | NanoTemper Technologies, Munich, Germany | MO-K002 | |
| Eppendorf PCR tubes | Eppendorf, Germany | 30124537 | |
| Monolith control software. 2.1.33, pre-installed on the device | NanoTemper Technologies, Munich, Germany | ||
| MO.affinity analysis v2.1.1 | NanoTemper Technologies, Munich, Germany | ||
| Kaleidagraph 4.5.2 | Synergy Software |
References
- Linke, P., et al. An Automated Microscale Thermophoresis Screening Approach for Fragment-Based Lead Discovery. J Biomol Screen. 21 (4), 414-421 (2015).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
- Zillner, K., et al. Microscale thermophoresis as a sensitive method to quantify protein: nucleic acid interactions in solution. Methods Mol Biol. 815, 241-252 (2012).
- Zhang, W., Duhr, S., Baaske, P., Laue, E. Microscale thermophoresis for the assessment of nuclear protein-binding affinities. Methods Mol Biol. 1094, 269-276 (2014).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun. 1, 100 (2010).
- Seidel, S. A., et al. Label-free microscale thermophoresis discriminates sites and affinity of protein-ligand binding. Angew Chem Int Ed Engl. 51 (42), 10656-10659 (2012).
- Seidel, S. A., et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59 (3), 301-315 (2013).
- Schubert, T., et al. Df31 protein and snoRNAs maintain accessible higher-order structures of chromatin. Mol Cell. 48 (3), 434-444 (2012).
- McKeague, M., Derosa, M. C. Challenges and opportunities for small molecule aptamer development. J Nucleic Acids. 2012, 748913 (2012).
- Ruscito, A., DeRosa, M. C. Small-Molecule Binding Aptamers: Selection Strategies, Characterization, and Applications. Front Chem. 4, 14 (2016).
- Chang, A. L., McKeague, M., Liang, J. C., Smolke, C. D. Kinetic and equilibrium binding characterization of aptamers to small molecules using a label-free, sensitive, and scalable platform. Anal Chem. 86 (7), 3273-3278 (2014).
- Chang, A. L., McKeague, M., Smolke, C. D. Facile characterization of aptamer kinetic and equilibrium binding properties using surface plasmon resonance. Methods Enzymol. 549, 451-466 (2014).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1-2), 9-18 (2011).
- Sokoloski, J. E., Dombrowski, S. E., Bevilacqua, P. C. Thermodynamics of ligand binding to a heterogeneous RNA population in the malachite green aptamer. Biochemistry. 51 (1), 565-572 (2012).
- Burnouf, D., et al. kinITC: a new method for obtaining joint thermodynamic and kinetic data by isothermal titration calorimetry. J Am Chem Soc. 134 (1), 559-565 (2012).
- Mannironi, C., Scerch, C., Fruscoloni, P., Tocchini-Valentini, G. P. Molecular recognition of amino acids by RNA aptamers: the evolution into an L-tyrosine binder of a dopamine-binding RNA motif. RNA. 6 (4), 520-527 (2000).
- Jenison, R. D., Gill, S. C., Pardi, A., Polisky, B. High-resolution molecular discrimination by RNA. Science. 263 (5152), 1425-1429 (1994).
- Huizenga, D. E., Szostak, J. W. A DNA aptamer that binds adenosine and ATP. Biochemistry. 34 (2), 656-665 (1995).
- Lee, E. R., Baker, J. L., Weinberg, Z., Sudarsan, N., Breaker, R. R. An allosteric self-splicing ribozyme triggered by a bacterial second messenger. Science. 329 (5993), 845-848 (2010).
- Wickiser, J. K., Cheah, M. T., Breaker, R. R., Crothers, D. M. The kinetics of ligand binding by an adenine-sensing riboswitch. Biochemistry. 44 (40), 13404-13414 (2005).
- Jucker, F. M., Phillips, R. M., McCallum, S. A., Pardi, A. Role of a heterogeneous free state in the formation of a specific RNA-theophylline complex. Biochemistry. 42 (9), 2560-2567 (2003).
- Zhao, Q., Lv, Q., Wang, H. Aptamer fluorescence anisotropy sensors for adenosine triphosphate by comprehensive screening tetramethylrhodamine labeled nucleotides. Biosens Bioelectron. 70, 188-193 (2015).
- Zhang, D., et al. A sensitive fluorescence anisotropy method for detection of lead (II) ion by a G-quadruplex-inducible DNA aptamer. Anal Chim Acta. 812, 161-167 (2014).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule imaging of an in vitro-evolved RNA aptamer reveals homogeneous ligand binding kinetics. J Am Chem Soc. 131 (29), 9866-9867 (2009).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule binding experiments on long time scales. Rev Sci Instrum. 81 (8), 083705 (2010).
- Zichel, R., Chearwae, W., Pandey, G. S., Golding, B., Sauna, Z. E. Aptamers as a sensitive tool to detect subtle modifications in therapeutic proteins. PLoS One. 7 (2), 31948 (2012).
- Baaske, P., Wienken, C. J., Reineck, P., Duhr, S., Braun, D. Optical thermophoresis for quantifying the buffer dependence of aptamer binding. Angew Chem Int Ed Engl. 49 (12), 2238-2241 (2010).
- Entzian, C., Schubert, T. Studying small molecule-aptamer interactions using MicroScale Thermophoresis (MST). Methods. 97, 27-34 (2016).
- Valenzano, S., et al. Screening and Identification of DNA Aptamers to Tyramine Using in Vitro Selection and High-Throughput Sequencing. ACS Comb Sci. 18 (6), 302-313 (2016).
- Jauset Rubio, M., et al. beta-Conglutin dual aptamers binding distinct aptatopes. Anal Bioanal Chem. 408 (3), 875-884 (2016).
- Breitsprecher, D., et al. Aptamer Binding Studies Using MicroScale Thermophoresis. Methods Mol Biol. 1380, 99-111 (2016).
- Stoltenburg, R., Schubert, T., Strehlitz, B. In vitro Selection and Interaction Studies of a DNA Aptamer Targeting Protein A. PLoS One. 10 (7), 0134403 (2015).
- Kinghorn, A. B., et al. Aptamer Affinity Maturation by Resampling and Microarray Selection. Anal Chem. 88 (14), 6981-6985 (2016).
- Duhr, S., Braun, D. Why molecules move along a temperature gradient. Proc Natl Acad Sci U S A. 103 (52), 19678-19682 (2006).
- Braun, D., Libchaber, A. Trapping of DNA by thermophoretic depletion and convection. Phys Rev Lett. 89 (18), 188103 (2002).
- Duhr, S., Arduini, S., Braun, D. Thermophoresis of DNA determined by microfluidic fluorescence. Eur Phys J E Soft Matter. 15 (3), 277-286 (2004).
- Jerabek-Willemsen, M., Wienken, C. J., Braun, D., Baaske, P., Duhr, S. Molecular interaction studies using microscale thermophoresis. Assay Drug Dev Technol. 9 (4), 342-353 (2011).
- He, K., Dragnea, V., Bauer, C. E. Adenylate Charge Regulates Sensor Kinase CheS3 To Control Cyst Formation in Rhodospirillum centenum. MBio. 6 (3), 00546 (2015).
- Brvar, M., et al. Structure-based discovery of substituted 4,5′-bithiazoles as novel DNA gyrase inhibitors. J Med Chem. 55 (14), 6413-6426 (2012).
- Pogorelcnik, B., et al. 4,6-Substituted-1,3,5-triazin-2(1H)-ones as monocyclic catalytic inhibitors of human DNA topoisomerase IIalpha targeting the ATP binding site. Bioorg Med Chem. 23 (15), 4218-4229 (2015).
- Jhaveri, S., Rajendran, M., Ellington, A. D. In vitro selection of signaling aptamers. Nat Biotechnol. 18 (12), 1293-1297 (2000).
- Khavrutskii, L., et al. Protein purification-free method of binding affinity determination by microscale thermophoresis. J Vis Exp. (78), (2013).
- Ramakrishnan, M., et al. Probing cocaine-antibody interactions in buffer and human serum. PLoS One. 7 (7), 40518 (2012).
- Chen, M., et al. Antiviral activity and interaction mechanisms study of novel glucopyranoside derivatives. Bioorg Med Chem Lett. 25 (18), 3840-3844 (2015).
- Wan, C., et al. Insights into the molecular recognition of the granuphilin C2A domain with PI(4,5)P2. Chem Phys Lipids. 186 (4,5), 61-67 (2015).
- Harazi, A., et al. The Interaction of UDP-N-Acetylglucosamine 2-Epimerase/N-Acetylmannosamine Kinase (GNE) and Alpha-Actinin 2 Is Altered in GNE Myopathy M743T Mutant. Mol Neurobiol. , (2016).

