Mapear el sitio de unión de un aptámero de ATP utilizando MicroScale termoforesis
Summary
MicroScale Thermophoresis (MST) is a sensitive technology to characterize aptamer-target interactions. This manuscript describes an MST protocol to characterize aptamer-small molecule interactions.
Abstract
Characterization of molecular interactions in terms of basic binding parameters such as binding affinity, stoichiometry, and thermodynamics is an essential step in basic and applied science. MicroScale Thermophoresis (MST) is a sensitive biophysical method to obtain this important information. Relying on a physical effect called thermophoresis, which describes the movement of molecules through temperature gradients, this technology allows for the fast and precise determination of binding parameters in solution and allows the free choice of buffer conditions (from buffer to lysates/sera). MST uses the fact that an unbound molecule displays a different thermophoretic movement than a molecule that is in complex with a binding partner. The thermophoretic movement is altered in the moment of molecular interaction due to changes in size, charge, and hydration shell. By comparing the movement profiles of different molecular ratios of the two binding partners, quantitative information such as binding affinity (pM to mM) can be determined. Even challenging interactions between molecules of small sizes, such as aptamers and small compounds, can be studied by MST. Using the well-studied model interaction between the DH25.42 DNA aptamer and ATP, this manuscript provides a protocol to characterize aptamer-small molecule interactions. This study demonstrates that MST is highly sensitive and permits the mapping of the binding site of the 7.9 kDa DNA aptamer to the adenine of ATP.
Introduction
La interacción entre las moléculas es la base de la naturaleza. Por lo tanto, los científicos en muchos campos de la investigación básica y aplicada tratan de comprender los principios fundamentales de las interacciones moleculares de diferentes tipos. MicroScale termoforesis (MST) permite a los científicos para llevar a cabo la caracterización rápida, precisa y rentable, y con control de calidad de las interacciones moleculares en solución, con una libre elección de tampones. Ya hay más de 1.000 publicaciones utilizando MST, a partir de 2016 solo, que describe diferentes tipos de análisis, incluyendo proyecciones de la biblioteca, validaciones de eventos, ensayos de competición, y los experimentos de unión con múltiples parejas de unión 1-8. En general, MST permite el estudio de los parámetros de unión clásicos, tales como la afinidad de unión (pM a mM), estequiometría, y la termodinámica, de cualquier tipo de interacción molecular. Una gran ventaja de MST es la capacidad para estudiar eventos de unión independientes del tamaño de las parejas de interacción. incluso chalinteracciones lenging entre pequeños aptámeros de ácido nucleico (15-30 nt) y objetivos tales como moléculas pequeñas, fármacos, antibióticos, o metabolitos pueden ser cuantificados.
Las tecnologías actuales del estado de la técnica para caracterizar las interacciones aptámero-objetivo son ya sea en laboratorio intensa y de gran complejidad o no se cuantifica aptámero-molécula pequeña Interacciones de 9,10. Surface Plasmon Resonance (SPR) a base de ensayos colorimétricos 11,12 y enfoques verdaderamente libre de marca, tales como calorimetría de titulación isotérmica (ITC) 13-15, elución isocrática 16, el equilibrio filtración 17,18, el sondeo en línea 19, de gel cambiar ensayos, stopped- flujo espectroscopía de fluorescencia 20,21, anisotropía de fluorescencia (FA) 22,23, de una sola molécula de fluorescencia de imagen 24,25, y Bio-capa de interferometría (BLI) 26 también son bien imprecisa o incompatible con la molécula del aptámero microcítico interacciones. otros principal problemas de estos métodos son de baja sensibilidad, alto consumo de ejemplo, la inmovilización, las limitaciones de transporte de masa en las superficies, y / o restricciones de amortiguamiento. Sólo unas pocas de estas tecnologías proporcionan controles integrados para la agregación y adsorción efectos.
MST representa una poderosa herramienta para los científicos para superar esta limitación para estudiar las interacciones entre los aptámeros y moléculas pequeñas 27-29, así como otros objetivos, tales como proteínas 30-33. La tecnología se basa en el movimiento de moléculas a través de gradientes de temperatura. Este movimiento dirigido, llamado "termoforesis," depende del tamaño, la carga, y la capa de hidratación de la molécula 34,35. La unión de un ligando a la molécula alterará directamente al menos uno de estos parámetros, lo que resulta en una movilidad termoforético cambiado. Ligandos con tamaños pequeños pueden no tener un impacto considerable en términos de cambio de tamaño de la independiente al estado ligado, pero pueden tener dr Amatic efectos sobre la capa de hidratación y / o carga. Los cambios en el movimiento termoforético de moléculas después de la interacción con la pareja de unión permite la cuantificación de los parámetros de unión básicas 2,7,34,36,37.
Como se muestra en la Figura 1A, el dispositivo MST consta de un láser infrarrojo enfocado sobre la muestra dentro de los capilares de vidrio utilizando la misma óptica como para la detección de fluorescencia. El movimiento termoforético de las proteínas a través de la fluorescencia intrínseca de triptófanos 6 o de un 3,8 pareja de interacción marcado con fluorescencia se puede monitorizar mientras el láser se establece un gradiente de temperatura (? T de 2-6 ° C). La diferencia de temperatura resultante en el espacio,? T, conduce al agotamiento o la acumulación de moléculas en el área de temperatura elevada, que se puede cuantificar por el Soret coeficiente (S T):
g "/>
c caliente representa la concentración en la región calentada, y c es la concentración de frío en la región en frío inicial.
Como se muestra en la Figura 1B, un típico experimento MST produce un perfil de movimiento MST (traza el tiempo), que consta de diferentes fases, que pueden separarse por sus respectivas escalas de tiempo. La fluorescencia inicial se mide en los primeros 5 s en ausencia del gradiente de temperatura para definir la fluorescencia a partir preciso y para comprobar si hay photobleaching o photoenhancement. El salto de temperatura (T-Jump) representa la fase en la que los cambios de fluorescencia antes del movimiento termoforético. Esta disminución inicial de la fluorescencia depende de cambios dependientes de calor de fluoróforo rendimiento cuántico. La fase termoforesis sigue, en el que se alcanza la disminución de fluorescencia (o aumenta) debido al movimiento de las moléculas termoforético hasta la distribución en el estado estacionario.El TJump inversa y retrodifusión concomitante de moléculas fluorescentes fl se pueden observar como se indica en la figura 1B después de que el láser está apagado. Con el fin de acceder a los parámetros básicos de unión, diferentes relaciones molares de los compañeros de interacción son analizados y comparados. Típicamente, 16 relaciones diferentes se estudian en un experimento MST, mientras que la molécula visible óptico se mantiene constante y se suministra con una cantidad creciente de ligando no marcado. La interacción entre las dos parejas de unión induce cambios en la termoforesis, y así en la fluorescencia normalizada, F norma, que se calcula de la siguiente manera:
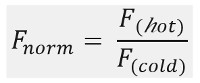
F caliente y fría F representan un promedio de intensidades de fluorescencia en puntos de tiempo de fi nido de las huellas del MST. Las afinidades de unión (Kd o valores de EC50) se pueden calcular por curve apropiado (Figura 1C).
En general, el MST es una poderosa herramienta para estudiar las interacciones moleculares de ningún tipo. Este manuscrito ofrece un protocolo para caracterizar la interacción entre el reto pequeña molécula de trifosfato de adenosina (ATP; 0,5 kDa) y el 25-nt corto ssDNA aptámero DH25.42 (7,9 kDa). En el transcurso del manuscrito, el sitio de unión del aptámero en la molécula de ATP se mapea hasta el grupo adenina del ATP.
Protocol
Representative Results
Discussion
Los controles de calidad:
adherencia inespecífica / adsorción de material de muestra a las superficies, así como los efectos de agregación, tiene una influencia dramática en la calidad de los datos de afinidad. Sin embargo, sólo unas pocas tecnologías de última generación ofrecen opciones precisos y rápidos para controlar y evitar estos efectos. MST ofrece controles de calidad integrados que detectan y ayudan a superar estos problemas, lo que permite la optimización paso a paso de la…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores no tienen reconocimientos.
Materials
| Aptamer binding buffer | 20 mM Tris pH7.6; 300 mM NaCl; 5 mM MgCl2; 0.01%Tween-20 | ||
| Fluorescently labeled ATP aptamer | IDT, Leuven, Belgium | sequence: DH25.42 50-Cy5-CCTGGGGGAGT-ATTGCGGAGGAAGG-3 | |
| ATP | Sigma Aldrich, Germany | A2383 | 10 mM stock solutions stored at – 20 °C |
| ADP | Sigma Aldrich, Germany | A2754 | 10 mM stock solutions stored at – 20 °C |
| AMP | Sigma Aldrich, Germany | A2252 | 10 mM stock solutions stored at – 20 °C |
| Adenine | Sigma Aldrich, Germany | A8626 | 10 mM stock solutions stored at – 20 °C |
| SAM | Sigma Aldrich, Germany | A7007 | 10 mM stock solutions stored at – 20 °C |
| dATP | Sigma Aldrich, Germany | 11934511001 | 10 mM stock solutions stored at – 20 °C |
| CTP | Sigma Aldrich, Germany | C1506 | 10 mM stock solutions stored at – 20 °C |
| GTP | Sigma Aldrich, Germany | G8877 | 10 mM stock solutions stored at – 20 °C |
| Monolith NT.115 | NanoTemper Technologies, Munich, Germany | MO-G008 | Blue/Red Channel MST device with standard detector, Monolith NT115 pico is MST device with high sensitivity detector |
| Monolith NT.115 capillaries Standard | NanoTemper Technologies, Munich, Germany | MO-K002 | |
| Eppendorf PCR tubes | Eppendorf, Germany | 30124537 | |
| Monolith control software. 2.1.33, pre-installed on the device | NanoTemper Technologies, Munich, Germany | ||
| MO.affinity analysis v2.1.1 | NanoTemper Technologies, Munich, Germany | ||
| Kaleidagraph 4.5.2 | Synergy Software |
References
- Linke, P., et al. An Automated Microscale Thermophoresis Screening Approach for Fragment-Based Lead Discovery. J Biomol Screen. 21 (4), 414-421 (2015).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
- Zillner, K., et al. Microscale thermophoresis as a sensitive method to quantify protein: nucleic acid interactions in solution. Methods Mol Biol. 815, 241-252 (2012).
- Zhang, W., Duhr, S., Baaske, P., Laue, E. Microscale thermophoresis for the assessment of nuclear protein-binding affinities. Methods Mol Biol. 1094, 269-276 (2014).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun. 1, 100 (2010).
- Seidel, S. A., et al. Label-free microscale thermophoresis discriminates sites and affinity of protein-ligand binding. Angew Chem Int Ed Engl. 51 (42), 10656-10659 (2012).
- Seidel, S. A., et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59 (3), 301-315 (2013).
- Schubert, T., et al. Df31 protein and snoRNAs maintain accessible higher-order structures of chromatin. Mol Cell. 48 (3), 434-444 (2012).
- McKeague, M., Derosa, M. C. Challenges and opportunities for small molecule aptamer development. J Nucleic Acids. 2012, 748913 (2012).
- Ruscito, A., DeRosa, M. C. Small-Molecule Binding Aptamers: Selection Strategies, Characterization, and Applications. Front Chem. 4, 14 (2016).
- Chang, A. L., McKeague, M., Liang, J. C., Smolke, C. D. Kinetic and equilibrium binding characterization of aptamers to small molecules using a label-free, sensitive, and scalable platform. Anal Chem. 86 (7), 3273-3278 (2014).
- Chang, A. L., McKeague, M., Smolke, C. D. Facile characterization of aptamer kinetic and equilibrium binding properties using surface plasmon resonance. Methods Enzymol. 549, 451-466 (2014).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1-2), 9-18 (2011).
- Sokoloski, J. E., Dombrowski, S. E., Bevilacqua, P. C. Thermodynamics of ligand binding to a heterogeneous RNA population in the malachite green aptamer. Biochemistry. 51 (1), 565-572 (2012).
- Burnouf, D., et al. kinITC: a new method for obtaining joint thermodynamic and kinetic data by isothermal titration calorimetry. J Am Chem Soc. 134 (1), 559-565 (2012).
- Mannironi, C., Scerch, C., Fruscoloni, P., Tocchini-Valentini, G. P. Molecular recognition of amino acids by RNA aptamers: the evolution into an L-tyrosine binder of a dopamine-binding RNA motif. RNA. 6 (4), 520-527 (2000).
- Jenison, R. D., Gill, S. C., Pardi, A., Polisky, B. High-resolution molecular discrimination by RNA. Science. 263 (5152), 1425-1429 (1994).
- Huizenga, D. E., Szostak, J. W. A DNA aptamer that binds adenosine and ATP. Biochemistry. 34 (2), 656-665 (1995).
- Lee, E. R., Baker, J. L., Weinberg, Z., Sudarsan, N., Breaker, R. R. An allosteric self-splicing ribozyme triggered by a bacterial second messenger. Science. 329 (5993), 845-848 (2010).
- Wickiser, J. K., Cheah, M. T., Breaker, R. R., Crothers, D. M. The kinetics of ligand binding by an adenine-sensing riboswitch. Biochemistry. 44 (40), 13404-13414 (2005).
- Jucker, F. M., Phillips, R. M., McCallum, S. A., Pardi, A. Role of a heterogeneous free state in the formation of a specific RNA-theophylline complex. Biochemistry. 42 (9), 2560-2567 (2003).
- Zhao, Q., Lv, Q., Wang, H. Aptamer fluorescence anisotropy sensors for adenosine triphosphate by comprehensive screening tetramethylrhodamine labeled nucleotides. Biosens Bioelectron. 70, 188-193 (2015).
- Zhang, D., et al. A sensitive fluorescence anisotropy method for detection of lead (II) ion by a G-quadruplex-inducible DNA aptamer. Anal Chim Acta. 812, 161-167 (2014).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule imaging of an in vitro-evolved RNA aptamer reveals homogeneous ligand binding kinetics. J Am Chem Soc. 131 (29), 9866-9867 (2009).
- Elenko, M. P., Szostak, J. W., van Oijen, A. M. Single-molecule binding experiments on long time scales. Rev Sci Instrum. 81 (8), 083705 (2010).
- Zichel, R., Chearwae, W., Pandey, G. S., Golding, B., Sauna, Z. E. Aptamers as a sensitive tool to detect subtle modifications in therapeutic proteins. PLoS One. 7 (2), 31948 (2012).
- Baaske, P., Wienken, C. J., Reineck, P., Duhr, S., Braun, D. Optical thermophoresis for quantifying the buffer dependence of aptamer binding. Angew Chem Int Ed Engl. 49 (12), 2238-2241 (2010).
- Entzian, C., Schubert, T. Studying small molecule-aptamer interactions using MicroScale Thermophoresis (MST). Methods. 97, 27-34 (2016).
- Valenzano, S., et al. Screening and Identification of DNA Aptamers to Tyramine Using in Vitro Selection and High-Throughput Sequencing. ACS Comb Sci. 18 (6), 302-313 (2016).
- Jauset Rubio, M., et al. beta-Conglutin dual aptamers binding distinct aptatopes. Anal Bioanal Chem. 408 (3), 875-884 (2016).
- Breitsprecher, D., et al. Aptamer Binding Studies Using MicroScale Thermophoresis. Methods Mol Biol. 1380, 99-111 (2016).
- Stoltenburg, R., Schubert, T., Strehlitz, B. In vitro Selection and Interaction Studies of a DNA Aptamer Targeting Protein A. PLoS One. 10 (7), 0134403 (2015).
- Kinghorn, A. B., et al. Aptamer Affinity Maturation by Resampling and Microarray Selection. Anal Chem. 88 (14), 6981-6985 (2016).
- Duhr, S., Braun, D. Why molecules move along a temperature gradient. Proc Natl Acad Sci U S A. 103 (52), 19678-19682 (2006).
- Braun, D., Libchaber, A. Trapping of DNA by thermophoretic depletion and convection. Phys Rev Lett. 89 (18), 188103 (2002).
- Duhr, S., Arduini, S., Braun, D. Thermophoresis of DNA determined by microfluidic fluorescence. Eur Phys J E Soft Matter. 15 (3), 277-286 (2004).
- Jerabek-Willemsen, M., Wienken, C. J., Braun, D., Baaske, P., Duhr, S. Molecular interaction studies using microscale thermophoresis. Assay Drug Dev Technol. 9 (4), 342-353 (2011).
- He, K., Dragnea, V., Bauer, C. E. Adenylate Charge Regulates Sensor Kinase CheS3 To Control Cyst Formation in Rhodospirillum centenum. MBio. 6 (3), 00546 (2015).
- Brvar, M., et al. Structure-based discovery of substituted 4,5′-bithiazoles as novel DNA gyrase inhibitors. J Med Chem. 55 (14), 6413-6426 (2012).
- Pogorelcnik, B., et al. 4,6-Substituted-1,3,5-triazin-2(1H)-ones as monocyclic catalytic inhibitors of human DNA topoisomerase IIalpha targeting the ATP binding site. Bioorg Med Chem. 23 (15), 4218-4229 (2015).
- Jhaveri, S., Rajendran, M., Ellington, A. D. In vitro selection of signaling aptamers. Nat Biotechnol. 18 (12), 1293-1297 (2000).
- Khavrutskii, L., et al. Protein purification-free method of binding affinity determination by microscale thermophoresis. J Vis Exp. (78), (2013).
- Ramakrishnan, M., et al. Probing cocaine-antibody interactions in buffer and human serum. PLoS One. 7 (7), 40518 (2012).
- Chen, M., et al. Antiviral activity and interaction mechanisms study of novel glucopyranoside derivatives. Bioorg Med Chem Lett. 25 (18), 3840-3844 (2015).
- Wan, C., et al. Insights into the molecular recognition of the granuphilin C2A domain with PI(4,5)P2. Chem Phys Lipids. 186 (4,5), 61-67 (2015).
- Harazi, A., et al. The Interaction of UDP-N-Acetylglucosamine 2-Epimerase/N-Acetylmannosamine Kinase (GNE) and Alpha-Actinin 2 Is Altered in GNE Myopathy M743T Mutant. Mol Neurobiol. , (2016).

