质谱法和基于发光的-途径表征阶段我代谢能力的<em>体外</em>细胞培养
Summary
体外系统的代谢能力是药物和毒物的生物转化和处置的一个关键要求。在这个协议中,我们描述的参考代谢探针的应用,以评估相我在细胞培养物代谢。
Abstract
异生代谢酶,通过添加提高溶解度和促进排泄的官能团发挥药物和有毒物质的生物转化的关键功能。在某些情况下这些结构的改变导致的新的有毒产物的生成。为了减少动物试验,化学危险,可以通过代谢感受态细胞进行评估。代谢酶的表达,然而,这不是随时间稳定在许多体外原代培养系统和经常是在细胞系中的部分或不存在。因此,药品,添加剂,并在体外环境污染物代谢的研究应当理想地在细胞系统中,其中代谢活性进行了表征进行。我们在这里介绍的方法使用UPLC质谱定量的化学探针及其代谢产物来衡量一类代谢酶的2D细胞系和原代3D文化活动(人类一期)和辉度。该方法可被实现,以测试在细胞系和来自各种组织来源的原代细胞的代谢活性。
Introduction
异生素代谢是通过该化学品外国到主体通过加入亲水性基团和缀合物的修饰,以促进其排泄1的过程。典型地,外源物的代谢是与I由具有添加一个或多个羟基1,2的氧化的主要相的两步骤的过程。在第二阶段中,使用羟基作为受体为亲水性共轭,如葡糖苷酸或硫酸酯部分含1,2。如果一个受体基团是已经存在于分子中,结合步骤可独立阶段I代谢的发生。各反应通过一组特定的酶, 例如 ,的CYP(细胞色素P450的),即催化羟基化( 图1)和脱烷基化化学基片3的执行。 Conjugation由磺基转移酶催化的,UDP-葡糖醛酸( 图1),谷胱甘肽-S-转移酶和N-乙酰转移酶4。每个组织和器官将有一个特定的代谢酶的表达谱,用表达最那些蛋白质的肝脏。
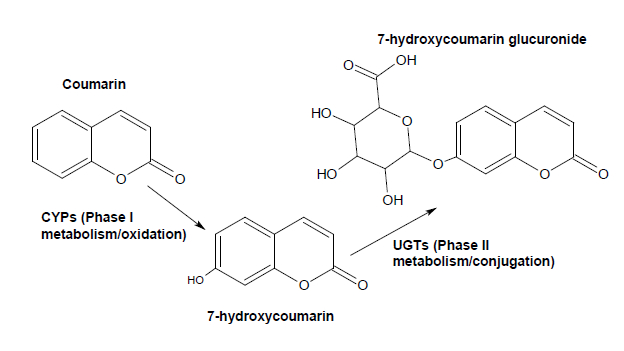
图1:阶段I和阶段II代谢香豆素的实施例。 CYP2A6 / CYP2A13催化香豆素7-羟化。 7-羟基香豆素是由第II相酶转移酶缀合于葡萄糖醛酸部分,与UGT1A6和UGT1A9显示出最高的活性。
了解外源性物质的代谢是在药物安全性评价及化学品风险评估的原因有两个关键:反应动力学将确定药物或化学多久会留在体内的活性或非活性形式B安伏排泄;和母体化合物可通过代谢酶被修饰以一个更具反应性的,不稳定的和有毒的物质。这样的反应也被称为“生物活化”主要是由相位我CYP酶还基于通过相位共轭II 5罕见的场合驱动。
在此基础上, 在体外模型的精确预测与药物或化学相关的风险的能力是高度依赖于电池系统的代谢能力。从患病组织或从正常细胞的转化的细胞系常常失去部分即使不是所有的代谢代表原籍6的组织的酶轮廓。正常代谢酶轮廓的维护出现在原代细胞培养更好(至少在短期培养物),并且如果所述组织是在基质允许它保持其三维结构1培养的进一步提高。因此,焦炭体外细胞系统的代谢能力的acterization是指导有关决定哪些细胞模型适合于进行化学安全性评估的一个重要预备步骤。
在本文中,我们提出了一个协议与它们与肝细胞系7和3D主肺细胞培养物8应用实例来分析在体外的活性和期CYP酶的表达。 CYP特异性底物,其代谢产物和抑制剂控制是与质量spectrometry-和发光的基础的定量方法沿着所述。由于一些的CYP是诱导和其他人组成,例子也将给予这两个场景。
Protocol
Representative Results
Discussion
目前,许多标准化毒理学测试系统使用工程菌,细胞系,或胚胎细胞是不能代表正常人体新陈代谢1。这可能导致化学或医学的潜在的毒性活动的不准确的预测。 在体外模型中 ,如三维细胞培养物和器官在一个芯片上的创新,在尝试更好地复制人体组织21,22,23的正常形态和代谢活性被开发。代谢能力是可以用来破译这些机型最适合用于毒理评估和的药物生物转化研究的一个标准。
我们在这个文件中提出的方案是用来测量使用活细胞的CYP酶的活性。它是柔性的并且可用于在二维或三维文化性不同的细胞系统ES并提供了使用一个发光的探针 – 或质谱为基础的方法的选项。这两种方法足够敏感以检测材料纳克量,只需要少量在多孔格式中生长的细胞的。它们也可以应用到球状体或复杂基质中生长的细胞。探针基底的选择显然是该协议的一个关键因素。所述测定的特异性依赖于探针具有选择性的CYP酶和保证的另一层可以通过使用选择性CYP抑制剂来获得。底物和本文列出的抑制剂是只是几个例子,但是其他人可以在文献中找到。
用新的细胞类型为负CYP活动成果工作时,酶在较低水平被表达可能是由于考虑多种孵育时间是很重要的。添加可使用的作为阳性对照的细胞类型的建议,以确保一阴性结果未链接到一个技术问题,并与任何以帮助解决问题。原发性肝细胞代谢能力和可以被用作控制,用于在悬浮例如原代肝细胞是非常容易使用,但它们的生存能力是在时间上有限的。肝细胞系是它们相对容易,因为在这个方案中所述使用可能的替代方案,但在代谢活性6,21方面一些比另一些更好。
由于该测定是无损的,除非总蛋白进行定量,能够追随随时间的CYP活性在纵向研究20。这一点很重要,因为某些细胞会具有可变CYP活动在在培养时间。阴性结果可能与缺乏汇合,进步在体外分化或去分化有关。在这种情况下,该方法为半quantitati已经由于数据不被蛋白在各细胞培养物的总量归一化。这不总是可能的或推荐的测量CYP活性暴露于探针,抑制剂或诱导可对组织具有毒性作用如对于TCDD的情况之后重新使用组织。
细胞级分如微粒也可用于表征一个给定的细胞类型的CYP活性。微粒制剂,然而,需要大量的细胞材料,添加适当的辅因子和缓冲,以确保酶保持活性。使用活细胞消除了棘手的微粒准备步骤和工作哪个缓冲和辅助因子效果最好。
作为一般的建议,这是进一步表征的CYP的表达谱中的细胞培养物,以验证它相匹配的酶活性的最佳实践。这种额外的验证级别建议鉴于代谢探头不ENTI依靠特定于单个CYP,它给增加的置信度所测量的代谢活性被相应的酶表达匹配。由于的CYP为膜蛋白它们相对难以用于蛋白质印迹准备,因此定量RT-PCR已剖析这些酶20的优选方法。
要注意,该协议描述了测定CYP酶的活性,仅表示代谢酶中的一种家族,虽然是重要的一项所述的方法是重要的。质谱方法的灵活性允许为探针底物的其他代谢转化采集方法的发展。然而,这些已被开发一次一个,并且当前有较少的已知的特定的探针和用于其他代谢酶家族选择性抑制剂。这种差距应该给允许在体外细胞SYSTE的代谢能力进行全面评估女士。
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Epithelix Sarl and Biopredic International for providing the airway cells and hepatic cells micrographies and Neil Smith for the figure illustrating the experimental procedure.
Materials
| Reagent & Cells | |||
| 2 μm syringe filter | Whatman | UN203NPEORG | |
| 24 well plate | Corning | 3524 | |
| 4-methylumbelliferone | Sigma Aldrich | M1381 | |
| 5-phenyl pentyne | Sigma Aldrich | CD5001437 | |
| 6-hydroxybupropion | Sigma Aldrich | H3167 | |
| 6-hydroxychlorzoxazone | Sigma Aldrich | UC148 | |
| 7-ethoxycoumarin | Sigma Aldrich | 195642 | |
| 7-hydroxycoumarin | Sigma Aldrich | H24003 | |
| 8-methoxypsoralen | Sigma Aldrich | M3501 | |
| acetic acid | Sigma Aldrich | 695092 | |
| acetonitrile | Fisher | A/0626/17 | |
| α-naphthoflavone | Sigma Aldrich | N5757 | |
| BCA kit | Thermo Scientific | 23227 | |
| b-glucuronidase/arylsulfatase | Sigma Aldrich | G0876 | |
| Bupropion | Sigma Aldrich | B102 | |
| Carbamazepine | Sigma Aldrich | C4024 | |
| chlorzoxasone | Sigma Aldrich | C4397 | |
| collagen | Cell Systems | 5005-B | |
| coumarin | Sigma Aldrich | C4261 | |
| disulfiram | Sigma Aldrich | 86720 | |
| fluvoxamine | Sigma Aldrich | F2802 | |
| Glutamax (Glutamine supplement) | Fisher | 35050061 | |
| HepaRG metabolism supplement | Merck | MMAD621 | |
| HepaRG thaw media supplement | Merck | MMADD671 | |
| HepaRG | Merck | MMHPR116 | |
| Luciferin-CEE | Promega | V8751 | |
| methanol | Fisher | M/4056/17 | |
| MucilAir airway cells | Epithelix | EP01 | |
| MucilAir airway cells maintenance media | Epithelix | EP04MM | |
| Phenomenex Kinetex 2.6μm, PFP 100A | Phenomenex | 00B-4477-AN | |
| TCDD | Sigma Aldrich | 48599 | |
| thioTEPA | Sigma Aldrich | T6069 | |
| Waters Acquity UPLC HSS T3 1.8µm 2.1 x 50mm | Waters | 86003538 | |
| Williams’ E media | Fisher | 17704-024 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| UPLC | Waters | Acquity | |
| QTRAP MS | Sciex | ABI Sciex 4000 | |
| QTRAP MS software | Sciex | Analyst 1.4.2 | |
| luminometer | Molecular Devices | SpectraMax M3 | |
| spectrophotometer | Molecular Devices | SpectraMax M3 | |
| cell counter | Beckman Coulter | Vi-Cell XR | |
| rotary evaporator | Eppendorf | Eppendorf-5301 |
References
- Garcia-Canton, C., Minet, E. Metabolic Characterization of Cell Systems Used in In Vitro Toxicology Testing. Encyclopedia of Drug Metabolism and Interactions. , 1-31 (2016).
- Croom, E. Metabolism of xenobiotics of human environments. Prog. Mol. Biol. Transl. Sci. 112, 31-88 (2012).
- Lewis, D. F. 57 varieties: the human cytochromes P450. Pharmacogenomics. 5, 305-318 (2004).
- Jancova, P., Anzenbacher, P., Anzenbacherova, E. Phase II drug metabolizing enzymes. Biomed. Pap. Med. Fac. Univ Palacky. 154, 103-116 (2010).
- Dekant, W. The role of biotransformation and bioactivation in toxicity. EXS. 99, 57-86 (2009).
- Donato, M. T., Lahoz, A., Castell, J. V., Gomez-Lechon, M. J. Cell lines: a tool for in vitro drug metabolism studies. Curr. Drug Metab. 9, 1-11 (2008).
- Guillouzo, A., et al. The human hepatoma HepaRG cells: a highly differentiated model for studies of liver metabolism and toxicity of xenobiotics. Chem. Biol. Interact. 168, 66-73 (2007).
- Huang, S., Wiszniewski, L., Constant, S., Roggen, E. Potential of in vitro reconstituted 3D human airway epithelia (MucilAir) to assess respiratory sensitizers. Toxicol. In Vitro. 27, 1151-1156 (2013).
- Sisson, J. H., Stoner, J. A., Ammons, B. A., Wyatt, T. A. All-digital image capture and whole-field analysis of ciliary beat frequency. J. Microsc. 211, 103-111 (2003).
- Kuehn, D., et al. Impact assessment of repeated exposure of organotypic 3D bronchial and nasal tissue culture models to whole cigarette smoke. J. Vis. Exp. , (2015).
- Draper, A. J., Madan, A., Parkinson, A. Inhibition of coumarin 7-hydroxylase activity in human liver microsomes. Arch. Biochem. Biophys. 341, 47-61 (1997).
- Jensen, K. G., Poulsen, H. E., Doehmer, J., Loft, S. Kinetics and inhibition by fluvoxamine of phenacetin O-deethylation in V79 cells expressing human CYP1A2. Pharmacol. Toxicol. 76, 286-288 (1995).
- Yamazaki, H., Tanaka, M., Shimada, T. Highly sensitive high-performance liquid chromatographic assay for coumarin 7-hydroxylation and 7-ethoxycoumarin O-deethylation by human liver cytochrome P450 enzymes. J. Chromatogr. B. Biomed. Sci. Appl. 721, 13-19 (1999).
- Turpeinen, M., Raunio, H., Pelkonen, O. The functional role of CYP2B6 in human drug metabolism: substrates and inhibitors in vitro, in vivo and in silico. Curr. Drug Metab. 7, 705-714 (2006).
- Kartha, J. S., Yost, G. S. Mechanism-based inactivation of lung-selective cytochrome P450 CYP2F enzymes. Drug Metab. Dispos. 36, 155-162 (2008).
- Sheets, P. L., Yost, G. S., Carlson, G. P. Benzene metabolism in human lung cell lines BEAS-2B and A549 and cells overexpressing CYP2F1. J. Biochem. Mol. Toxicol. 18, 92-99 (2004).
- Kharasch, E. D., Thummel, K. E., Mhyre, J., Lillibridge, J. H. Single-dose disulfiram inhibition of chlorzoxazone metabolism: a clinical probe for P450 2E1. Clin. Pharmacol. Ther. 53, 643-650 (1993).
- Graef, V., Furuya, E., Nishikaze, O. Hydrolysis of steroid glucuronides with beta-glucuronidase preparations from bovine liver, Helix pomatia, and E. coli. Clin. Chem. 23, 532-535 (1977).
- Baxter, A., et al. Targeted omics analyses, and metabolic enzyme activity assays demonstrate maintenance of key mucociliary characteristics in long term cultures of reconstituted human airway epithelia. Toxicol. In Vitro. 29, 864-875 (2015).
- Gomez-Lechon, M. J., Tolosa, L., Conde, I., Donato, M. T. Competency of different cell models to predict human hepatotoxic drugs. Expert. Opin. Drug Metab. Toxicol. 10, 1553-1568 (2014).
- Li, Z., et al. Assessment of metabolism-dependent drug efficacy and toxicity on a multilayer organs-on-a-chip. Integr. Biol. 8, 1022-1029 (2016).
- Takahashi, Y., et al. Three-dimensional (3D) spheroid cultures improve the metabolic gene expression profiles of HepaRG cells. Biosci. Rep. , (2015).

