מחקרים מבניים אטומי בקנה מידה של הרכבות Macromolecular על ידי תהודה מגנטית גרעינית solid-state ספקטרוסקופיה
Summary
מבנים של חלבון סופרא מולקולרית הרכבות ברזולוציה אטומית הם רלוונטיות גבוהה בשל התפקידים מכריע שלהם במגוון רחב של תופעות ביולוגיות. במסמך זה, אנו מציגים פרוטוקול לבצע מחקרים מבניים ברזולוציה גבוהה על הרכבות לא מסיסים, הבלתי גבישי החלבון macromolecular על-ידי קסם-זווית ספינינג ספקטרוסקופיה של מצב מוצק תהודה מגנטית גרעינית (MAS SSNMR).
Abstract
חלבון סופרא מולקולרית הרכבות ממלאים תפקידים מהותי בתהליכים ביולוגיים החל פתוגן-פונדקאי אינטראקציה, זיהום נגיפי כדי התפשטות של מחלות ניווניות. כזה מכלולים מורכבים ב מרובים החלבוניות מאורגנות בדרך שאינה קוולנטיות כדי ליצור אובייקטים macromolecular גדולים זה יכול לבצע מגוון רחב של פונקציות הסלולר או לגרום לכך השלכות מזיקות. אטומי תובנות המנגנונים הרכבה לבין תפקוד הרכבות macromolecular האלה נשארים לעיתים קרובות נדיר מאז שלהם insolubility הגלום ומפחית הלא-crystallinity לעיתים קרובות באופן דרסטי את איכות הנתונים המתקבלים רוב טכניקות בשימוש הביולוגיה המבנית כדוגמת קריסטלוגרפיה באמצעות קרני רנטגן והפתרון תהודה מגנטית גרעינית (NMR). אנו מציגים כאן הקסם-זווית ספינינג NMR של מצב מוצק ספקטרוסקופיה (SSNMR) כשיטת רבי עוצמה כדי לחקור מבנים מכלולים macromolecular ברזולוציה אטומית. SSNMR יכול לחשוף פרטים אטומית על המתחם שהורכב ללא מגבלות גודל, המסיסות. פרוטוקול המובאת כאן מתאר את השלבים החיוניים מן הייצור של 13C /15N התווית על-ידי איזוטופ חלבון macromolecular להרכבות רכישת סטנדרטי SSNMR ספקטרה, שלהם ניתוח ופרשנות. לדוגמה, אנו מראים את הצינור של ניתוח מבני SSNMR של אסיפה חלבון filamentous.
Introduction
ההתקדמות קסם-זווית ספינינג ספקטרוסקופיה של מצב מוצק תהודה מגנטית גרעינית (SSNMR) מציעים כלי יעיל עבור אפיון מבניים חלבון macromolecular הרכבות ברזולוציה האטום. מהרכבות חלבונים אלה הן מערכות בכל מקום זה ממלאים תפקידים חיוניים תהליכים ביולוגיים רבים. מבנים מולקולריים שלהם, אינטראקציות, דינמיקה הינן נגישות באמצעות מחקרים SSNMR, כפי שהוצגה עבור נגיפי (capsids1) ואת מנגנוני זיהום חיידקי (הפרשת מערכות2,3, pili4), קרום חלבון מתחמי5,6,7,8 , amyloids תפקודית 9,10,11. הרכבה מולקולרי מסוג זה יכול גם לעורר פתולוגיות כגון מחלות ניווניות היכן חלבונים להרכיב במדינות misfolded, עמילואיד ולגרום בהתנהגות התא חריגה או לתא המוות 12,13. חלבון הרכבות, שנבנו על ידי oligomerization סימטרי עותקים בכפולות של החלבוניות לעצמים סופרא מולקולרית גדולים של צורות שונות כולל הסיבים, חוטים, נקבוביות, צינורות או חלקיקים. הארכיטקטורה רבעוני מוגדרת על ידי החלשים האינטראקציות בין החלבוניות כדי לארגן את מכלול יכולות וכדי לאפשר תפקודים ביולוגיים מתוחכמים. חקירות מבניים בקנה מידה אטומי על מהרכבות אלה הם אתגר עבור טכניקות ברזולוציה גבוהה מאז insolubility מהותי שלהם, לעיתים קרובות שלהם crystallinity ללא הגבלת השימוש קריסטלוגרפיה באמצעות קרני רנטגן קונבנציונאלי או פתרון NMR גישות. קסם-זווית ספינינג (MAS) SSNMR המתעוררים הטכניקה כדי לקבל נתונים ברזולוציה אטומית על הרכבות macromolecular לא מסיסים, הוכיחה את יעילותה לפתרון אטומי דגמי תלת-ממד עבור מספר גדל והולך של מערכות למערכות ביולוגיות מורכבות כולל חוטים חיידקי, הרכבות עמילואיד, נגיפים 14,15,16,17,18,19,20, 21,22. ההתקדמות הטכנית על שדות מגנטיים גבוהה, התפתחויות מתודולוגיות הכנת הדוגמא הקימה MAS SSNMR לתוך שיטה חזקה לחקור חלבונים לא מסיסים בסביבות שונות, ובייחוד ב שלהם מבחינה ביולוגית רלוונטיות macromolecular התאספו המדינה או ממברנות הסלולר, ביצוע הטכניקה מאוד משלים הקפאה-מיקרוסקופ. במקרים רבים, רמה גבוהה מאוד של סימטריה מאפיינת את הרכבות חלבון כזה. MAS SSNMR מנצל תכונה זו, כמו כל החלבוניות בהרכבה homomolecular באותו מבנה מקומי, ולכן כמעט זהה SSNMR חתימה, באופן דרסטי הפחתת המורכבות של הניתוח.
פרוטוקול יעילה ללימודי מבנית של חלבון macromolecular הרכבות על ידי MAS מתונה (< 25 kHz) SSNMR מוצג בסרטון הזה, נחלקים שלבים שונים (איור 1). נדגים את השלבים הקריטיים של זרימת העבודה של מחקר מבנית SSNMR ביטוי על חלבון filamentous אסיפה (ראה מודגש צעדים באיור1), למעט חלבון יחידה משנית-טיהור, שונות עבור כל חלבון הרכבה, אבל חשיבות קריטית ללימודי מבניים, ומבלי אכנס לפרטי פרטים טכניים/מתודולוגיים SSNMR ספקטרוסקופיה ומבנה חישוב עבור מה הדרכות מיוחדות זמינים באינטרנט. בעוד בפרוטוקול הנוכחי יתמקד בעיקר ניסויים NMR של מצב מוצק תחת תנאים MAS, השימוש מיושר סביבות ביולוגי 23,24,25,26 , 27, כגון bicelles מיושר, לאפשר החקירה של חלבון קונפורמציה ואינטראקציה דינמי חלבון קרום דמוי בתקשורת ללא טכנולוגיית MAS. אנחנו נראה את הביטוי חלבון, מכלול צעדים, כמו גם את ההקלטה של ספקטרום SSNMR מכריע, ניתוח ופרשנות שלהם. המטרה שלנו היא לספק תובנות לתוך הצינור ניתוח מבנה המאפשר לקורא לבצע מחקר מבנית של אטומי ברזולוציה של אסיפה macromolecular בטכניקות SSNMR.
הפרוטוקול כוללת 3 סעיפים:
1. מוצק NMR לדוגמה ייצור
תנאי לביצוע ניתוח NMR של מצב מוצק, רכיבי חלבון בצורך הרכבה macromolecular לבוא לידי ביטוי, התווית על-ידי איזוטופ, מטוהרים, שהורכבו במבחנה למצב מורכב כמו מקורי (עבור לדוגמה ראה איור 2) . כדי להבטיח רגישות גבוהה NMR, איזוטופ העשרה 13C ו 15N תיוג נדרש באמצעות מדיה ביטוי חיידקי מינימלי בתוספת 13C ו 15N מקורות, כגון בצורה אחידה 13 התווית על-ידי C גלוקוז/גליצרול ו -15NH4Cl בהתאמה. בשלב מאוחר יותר של הפרוטוקול, באופן סלקטיבי 13התווית על-ידי C דגימות הופק באופן סלקטיבי 13מקורות התווית על-ידי C כגון (1, 3 –13ג)- ו (2 –13C)-גליצרול (או (1 –13ג)- ו (2 –13ג)- גלוקוז) נעשה שימוש כדי להקל על הניתוח NMR. מעורבות מדגם שכותרתו המתאים תערובת equimolar של 50% 15N – או 50% 13התווית על-ידי ג או 50% (1, 3 –13C)-50% (2 –13C)-גלוקוז מוצגים כדי לתאר את הגילוי של הבין-מולקולרי אינטראקציות. רמה גבוהה של חלבון טוהר, כמו גם תנאים קפדניים במהלך השלב הרכבה הם גורמי מפתח כדי להבטיח צו מבניים הומוגנית של המדגם הסופי.
2. ראשוני אפיון מבניים בהתבסס על מימדי NMR solid-state (1 ד)
אנו מציגים את הניסויים חיוני עבור ניתוח מבניים על-ידי SSNMR. (1 ד) חד-ממדי קרוס-קיטוב (CP), INEPT / RINEPT28 ניסויים, שאותרו על הגרעינים 13C משמשים כדי לזהות מקטעי חלבון גמיש הנוקשה בהרכבה, בהתאמה, הערכת מידת מבנית הומוגניות, פולימורפיזם המקומי (עבור לדוגמה ראה איור 3).
רונג > 3. ניתוח הסתגלותי ותלת מימד מבנה נחישות
סעיפים קטנים 1 ו-2 נוגע הניתוח הסתגלותי, אשר מבוססת על ההקצאה תהודה SSNMR של כל שאריות נוקשה ההרכבה חלבון, כמו המשמרות כימיים הם רגשים רגיש מאוד בסביבה המקומית והוא יכול לשמש כדי לחזות את פי/psi דו-מישור זוויות, ובכך לקבוע את מבנה שניוני. איור 4 מתארת דוגמה הקצאת תהודה רציפים הליבה נוקשה של אסיפה חלבון. קביעת מבנה תלת-ממדי מבוסס על האוסף של נתונים מבניים כגון מרחק ריסון קידוד קרוב proximities (< Å 7-9), המכיל גם אינטרה – וגם מידע הבין-מולקולרי. 3 ו- 4 מתארים איפוק מרוחק לטווח ארוך אוסף ופרשנות. קשרים ארוכי טווח מוגדרים התפלגות 13C –13C proximities הנובעות שאריות אני כדי ג’יי, עם | i-j | ≥4, הגדרת ובכך הקיפול חלבון שלישוני של יחידת משנה monomeric את, או הבין-מולקולרי 13C –13C proximities, הגדרת הממשקים הבין-מולקולרי בין החלבוניות בהרכבה. אינטרה – וממשקים הבין-מולקולרי מומחשים באיור5. SSNMR ריסון זוהה עד 13C –13C ו 15N –13C recoupling ניסויים בדרך כלל לקודד למרחקים internuclear < 1 ננומטר. סעיף קטן 4 מסביר את הגילוי של ריסון המרחק הבין-מולקולרי. בהרכבות חלבון סימטרית, השימוש homogeneously שכותרתו דגימות (כלומר 100% בצורה אחידה, או בצורה סלקטיבית עם התווית) עבור זיהוי האינטראקציות הבין-מולקולרי יחידה משנית-יחידת משנה הוא מוגבל, כמו שני אינטרה – ולא בין – molecular אנשי קשר להוביל הסימנים לזיהוי. גילוי ברורה וחד משמעית של proximities הבין-מולקולרי מושגת באמצעות דגימות שכותרתו מעורבת, המכיל תערובת equimolar של שני מדגמים שכותרתו באופן שונה, בשילוב לפני צבירת. סעיף קטן 5 מציג בקצרה את מבנה דוגמנות.
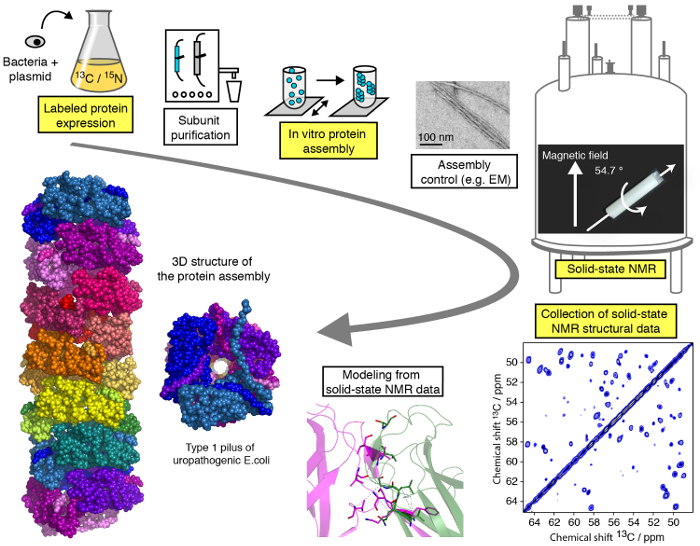
איור 1 : זרימת העבודה ברזולוציה אטומית המחקר המבני מאת NMR של מצב מוצק. 13 ג’, 15N איזוטופ שכותרתו ייצור החלבון, טיהור יחידה משנית, יחידת משנה הרכבה, שליטה על היווצרות הרכבה, ניסויים SSNMR, SSNMR ניסוי ניתוח והפקת מרחק ריסון, מידול המבנה מוצגות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
Representative Results
Discussion
NMR solid-state (SSNMR) היא שיטה של בחירה עבור אפיון חלבון macromolecular מכלולים ברמה האטומית. אחד הנושאים המרכזיים בקביעת מבנה המבוסס על SSNMR היא איכות ספקטרלי של המערכת ובדוקים, המאפשר הקמת תלת-ממד מודלים מבניים של דיוק שונים, החל בדרך כלל מודלים ברזולוציה נמוכה (המכיל המשני מבנה קטן נתוני תלת-ממד ורכיבי) כדי מדומים הבראבה תלת-ממד. כמות ואיכות המידע המבני המופק ניסויים SSNMR רב ממדית היא המפתח לחישוב מבנה NMR ברזולוציה גבוהה של ההרכבה.
הפרוטוקול המתואר מסתמך על הגילוי של 13C –13C ו 15N –13C מבניים ריסון הדורשים את ההקלטה של מספר ספקטרה 2D (וגם לפעמים 3D) עם גבוהה אות לרעש. בתדרים MAS מתונה (< 25 קילו-הרץ), המדגם מוחדרים הרוטורים עם גדלים מקוטר 3.2-4 מ מ ומאפשר חלבון בכמויות של עד ~ 50 מ”ג, תלויים הידרציה מדגם. כמות הדגימה בתוך הרוטור היא ביחס ישר את יחס אות לרעש ספקטרה SSNMR, גורם מכריע עבור הגילוי של ריסון ארוכי טווח מרחק והקצאה ברורה וחד משמעית שלהם.
הרזולוציה ספקטרלי הוא פרמטר קריטי במהלך ההקצאה תהודה רציפים ואת האוסף ריסון. כדי להשיג תוצאות אופטימליות, הפרמטרים הכנת המדגם צריך להיות מותאם במיוחד, בפרט הטיהור של יחידת משנה את ואת התנאים הרכבה (pH, מאגר, רועדת, טמפרטורה וכדומה). למיטוב לדוגמה, מומלץ להכין דוגמאות ללא תווית עבור מספר תנאים ברורים אשר נצפתה הרכבה, וכדי להקליט 1D 1H –13ג CP קשת (שמתואר בשלב 2.1) על כל מדגם מוכן. הספקטרום לשרת השווה רזולוציה ספקטרלי ואת פיזור בין ההכנות שונה, המבוססת על אשר ניתן לקבוע את התנאים אופטימליים.
איכות הנתונים SSNMR תלוי בחום על בחירת הפרמטרים רכישה NMR, במיוחד עבור השלבים העברה קיטוב. השימוש של עוצמות שדה מגנטי גבוה (≥600 מגה-הרץ 1H תדירות) חיוני עבור רגישות גבוהה ורזולוציה ספקטרלי, נדרש כאשר מול יעדים מורכבים כגון חלבון macromolecular הרכבות.
גורם מגביל במקרים רבים הוא הזמינות ספקטרומטר. לכן, בחירה הביוספירה הדגימות כדי להיות מוכנים צריך להקדים את ההפעלה ספקטרומטר. בכל מקרה, בצורה אחידה 13C 15מדגם התווית על-ידי N הוא תנאי הכרחי לביצוע המשימה תהודה רציפות ואף התוך שיורית. חלבונים שהוקצה על-ידי טכניקות NMR של מצב מוצק ראה71. מכשור לקביעת קשיות ומבנה macromolecular להרכבות בתדרים MAS מתון מחייבת באופן סלקטיבי דגימות התווית על-ידי ג 13; עבור זיהוי ארוכי טווח 13C –13C ו- 13C –15N יוצר קשר הדגימות מבוסס על 1, 3 –13C – ו 2 –13C-gylcerol או 1 –13ג – ו 2 –13C-גלוקוז תיוג? נפוץ, כמתואר לעיל. הבחירה בין שתי הערכות תיוג מבוסס על יחס אות לרעש ספקטרלי והרזולוציה. כדי להבחין בין אינטרה – ואנשי קשר ארוך הטווח הבין-מולקולרי, מעורבות דגימות שכותרתו מדולל נחשפו יעיל.
בקיצור, השלבים הקריטיים למחקר מבנית SSNMR אטומי הם: (א) הכנת את subunits והצורך הרכבה ניתן למטב כדי להשיג דגימה מעולה ובאיכות, (ii) ספקטרומטר שדה כוח ורכישה פרמטרים צריכים להיות נבחרו בקפידה; (iii) אסטרטגיות תיוג סלקטיבית נדרשים עבור החלטה במבנה התלת-ממדי, כמות הנתונים הנדרשת תלויה איכות הנתונים ואת הזמינות של נתונים משלימים.
למרות את תחולתן למגוון רחב של מערכות סופרא מולקולרית ועד קרום חלבונים homomultimeric ננו-אובייקטים, SSNMR לעיתים קרובות מוגבל על ידי הצורך mg-כמויות של חומר isotopically עם תוויות. ההתפתחויות הטכנולוגיות ב- SSNMR MAS (≥100 kHz) אולטרה מהיר פתוח במעלה השדרה 1H מזוהה NMR, רודיש המגבלה של כמות מינימלית מדגם / sub-mg- 72,–73,–74. למרות זאת, ללימודי מבני נתונים היסטוריים הם דוגמאות התווית על-ידי C 13הכרחי, אשר מגביל את היישום של SSNMR דגימות נאסף במבחנה או מערכות לידי ביטוי המיקרואורגניזמים לשרוד על בינונית מזערי שם בתא SSNMR היא שיטה המתעוררים (עבור הדעת ראו 75,76,77,78).
גורם חשוב ביישום SSNMR להשיג מבנים תלת-ממד ברזולוציה גבוהה הוא הרזולוציה ספקטראליים: מהותי הטרוגניות הסתגלותי בהרכבה יכול להגביל את הרזולוציה ספקטרלי וניתוח ספקטרום. שאריות תיוג ספציפית 13C עשוי במקרים מסוימים לספק אלטרנטיבה לקבל מידע מרחק מסוים על שאריות אסטרטגי על מנת לקבל מודלים מבניים (עבור האחרונות דוגמאות ראה 79,80).
SSNMR לקביעת במבנה התלת-ממדי עדיין דורש האוסף של מספר datasets עם נתונים לעתים קרובות רב פעמים אוסף על מכשירים מתוחכמים, בהתאם את הגישה ואת המערכת מספר ימים עד שבועות ב 600-1000 MHz (תדירות1H) ספקטרומטר. לכן, הגישה ספקטרומטר הזמן יכול להיות גורם מגביל בכל מחקר מעמיק SSNMR.
במקרה של מכלולים חלבון homomultimeric, המוביל SSNMR נתונים באיכות מספיקה כדי לזהות מספר גבוה של ריסון מבניים כגון 3,57,64,70, SSNMR עדיין נותן אין גישה לממדים מיקרוסקופיים. לכן, בקביעת דה נובו SSNMR מבנה אסיפה homomultimeric, אותם או מסה לכל-(הזט ב) נתונים באורך אידיאלי משלימים SSNMR נתונים כדי להפיק את הפרמטרים סימטריה. SSNMR הנתונים לבד לספק את אטומי אינטרה – ממשקים הבין-מולקולרי
SSNMR משלימה ביותר עם טכניקות מבניים כגון EM או הזט ב מדידות, אבל הנתונים באופן מושלם גם יכול להיות משולב עם הבראבה מתקבל על ידי קריסטלוגרפיה באמצעות קרני רנטגן או NMR פתרון על מוטציה או חתוכים subunits. מספר גדל והולך של מחקרים ניתן למצוא בספרות שבו אפשרה המפגש של נתונים מבניים שונים לקביעת אטומי דגמי תלת-ממד מכלולים macromolecular (ראה איור 6 דוגמאות מיצגות).
בתחום הביולוגיה המבנית, SSNMR מתגלה טכניקה מבטיח ללמודהרכבות לא מסיסים, הבלתי גבישי-אטומית רמה, קרי מתן מבני הנתונים את המשקל האטומי. במובן זה, SSNMR הוא התליון פתרון NMR, קריסטלוגרפיה באמצעות קרני רנטגן עבור הרכבות מולקולרית, כולל ממברנה חלבונים בהרכבות שלהם ילידי הסביבה וחלבון כגון מעטפות ויראלי, חיידקי חוטים או amyloids, כמו גם RNA ו- מתחמי RNA-חלבון (ראה לדוגמה81). שלה יישומים רב תכליתי במבחנה בהקשר הסלולר, כגון מעקב אחר שינויים מבניים המשני, שלישוני, רבעוני, לזהות משטחים אינטראקציה עם השותף מולקולות על המשקל האטומי (לדוגמה 82), מיפוי דינמיקה מולקולרית בהקשר של קומפלקסים מורכבים, ציין את הפוטנציאל החשוב של SSNMR במחקרים מבניים עתידיים על מכלולים מורכבים למערכות ביולוגיות.
| רכיב | M9 בינוני |
| NaCl | 0.5 g/L |
| 2פו ח’4 | 3 g/L |
| נה2HPO4 | 6.7 g/L |
| MgSO4 | 1 מ מ |
| ZnCl2 | 10 ΜM |
| FeCl3 | 1 ΜM |
| CaCl2 | 100 ΜM |
| תערובת ויטמינים MEM 100 X | 10 מ ל/L |
| 13 C-גלוקוז | 2 g/L |
| 15 מלון NH4קלרנית | 1 g/L |
טבלה 1: ההרכב של בינוני ביטוי מינימלית של חלבון רקומביננטי ייצור E. coli תאים BL21.
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו ממומנת על ידי ANR (13-PDOC-0017-01 ועד B.H. ANR-14-CE09-0020-01 ל א. ל), “השקעות לעתיד” תוכנית IdEx בורדו/CNRS (PEPS 2016 ל B.H.) הפניה ANR-10-IDEX-03-02 כדי B.H., שופכים Fondation la Recherche Médicale ( AJE20140630090 לא. ל), עקרות, התוכנית האיחוד FP7 (האיחוד FP7-אנשים-2013-סיגריה על א. ל) ואת אירופה מחקר המועצה (ERC) תחת של האיחוד האירופי אופק 2020 מחקר וחדשנות התוכנית (ERC החל גרנט על א. ל., ההסכם לא 639020) ופרוייקט ” WEAKINTERACT.”
Materials
| Instruments | |||
| NMR Spectrometer (> 11.7 Tesla) | Bruker | – | |
| triple resonance MAS SSNMR probehead | Bruker | – | |
| SSNMR rotors 4mm | Bruker | K1910 | |
| Centrifuge 5804 R | Eppendorf | 5805000629 | |
| GeneQuant 1300 spectrometer | Dutscher | 28-9182-13 | |
| IGS60 INCUBATEUR HERATHERM 75 L | Dutscher | 228001 | |
| MaxQ 4450 bench top orbital shaker | Dutscher | 78376 | |
| Tube Revolver Agitator | Dutscher | 79547 | |
| sonopuls HD 3100 | Bandelin | 3680 | |
| MicroPulser electroporator | Biorad | 165-2100 | |
| mini-PROTEAN tetra cell system | Biorad | 165-8000 | |
| AKTA pure system | GE Healthcare | 29-0182-24 | |
| capillary microman M25 pipet | Gilson | F148502 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| amiconR ultra-15 | sigma | Z740199-8EA | |
| capillaries and pistons | Gilson | F148112 | |
| spatula | Fisher | 13263799 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| D-glucose 13C6 | Sigma | 389374 | |
| Ammonium-15N-chloride | Sigma | 299251 | |
| 1,3 13C2 glycerol | Sigma | 492639 | |
| 2 13C glycerol | Sigma | 489484 | |
| Kanamycin | Sigma | K1876 | |
| Carbenicillin | Sigma | C3416 | |
| Sodium phosphate dibasic | Sigma | S7907 | |
| Potassium phosphate monobasic | Sigma | P5655 | |
| Sodium chloride | Sigma | 71380 | |
| calcium chloride | Sigma | C1016 | |
| Magnesium sulfate | Sigma | 208094 | |
| Iron Chloride | Sigma | 157740 | |
| Zinc chloride | Sigma | 793523 | |
| MEM Vitamin Solution (100×) | Sigma | M68954 | |
| IPTG | Fisher | BP1755 | |
| Trizma base | Sigma | T1503 | |
| Tricine | Sigma | T0377 | |
| SDS | Sigma | 436143 | |
| sodium azide | sigma | 71289 | |
| 4,4-dimethyl-4-silapentane-1-sulfonic acid | Sigma | 178837 | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Unicorn 6.3 | GE Healthcare | Akta systems | |
| ccpNMR | CCPN | spectrometer systems |
References
- Morag, O., Sgourakis, N. G., Baker, D., Goldbourt, A. The NMR-Rosetta capsid model of M13 bacteriophage reveals a quadrupled hydrophobic packing epitope. Proc Natl Acad Sci U S A. 112 (4), 971-976 (2015).
- Loquet, A., et al. Atomic model of the type III secretion system needle. Nature. 486 (7402), 276-279 (2012).
- Demers, J. P., et al. High-resolution structure of the Shigella type-III secretion needle by solid-state NMR and cryo-electron microscopy. Nat Commun. 5 (4976), (2014).
- Habenstein, B., et al. Hybrid Structure of the Type 1 Pilus of Uropathogenic Escherichia coli. Angew Chem Int Ed Engl. 54 (40), 11691-11695 (2015).
- Cady, S. D., et al. Structure of the amantadine binding site of influenza M2 proton channels in lipid bilayers. Nature. 463 (7281), 689-692 (2010).
- Park, S. H., et al. Structure of the chemokine receptor CXCR1 in phospholipid bilayers. Nature. 491 (7426), 779-783 (2012).
- Kaplan, M., et al. Probing a cell-embedded megadalton protein complex by DNP-supported solid-state NMR. Nat Methods. 12 (7), 649-652 (2015).
- Wang, S., et al. Solid-state NMR spectroscopy structure determination of a lipid-embedded heptahelical membrane protein. Nat Methods. 10 (10), 1007-1012 (2013).
- Daskalov, A., et al. Signal transduction by a fungal NOD-like receptor based on propagation of a prion amyloid fold. PLoS Biol. 13 (2), e1002059 (2015).
- Daskalov, A., et al. Identification of a novel cell death-inducing domain reveals that fungal amyloid-controlled cell death is related to necroptosis. Proc Natl Acad Sci U S A. , (2016).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nat Rev Mol Cell Biol. 15 (6), 384-396 (2014).
- Aguzzi, A., Lakkaraju, A. K. Cell Biology of Prions and Prionoids: A Status Report. Trends Cell Biol. 26 (1), 40-51 (2016).
- Habenstein, B., Loquet, A. Solid-state NMR: An emerging technique in structural biology of self-assemblies. Biophys Chem. , (2015).
- Meier, B. H., Bockmann, A. The structure of fibrils from ‘misfolded’ proteins. Curr Opin Struct Biol. 30, 43-49 (2015).
- Miao, Y., Cross, T. A. Solid state NMR and protein-protein interactions in membranes. Curr Opin Struct Biol. 23 (6), 919-928 (2013).
- Tang, M., Comellas, G., Rienstra, C. M. Advanced solid-state NMR approaches for structure determination of membrane proteins and amyloid fibrils. Acc Chem Res. 46 (9), 2080-2088 (2013).
- Weingarth, M., Baldus, M. Solid-state NMR-based approaches for supramolecular structure elucidation. Acc Chem Res. 46 (9), 2037-2046 (2013).
- Loquet, A., Habenstein, B., Lange, A. Structural investigations of molecular machines by solid-state NMR. Acc Chem Res. 46 (9), 2070-2079 (2013).
- Yan, S., Suiter, C. L., Hou, G., Zhang, H., Polenova, T. Probing structure and dynamics of protein assemblies by magic angle spinning NMR spectroscopy. Acc Chem Res. 46 (9), 2047-2058 (2013).
- Tycko, R., Wickner, R. B. Molecular structures of amyloid and prion fibrils: consensus versus controversy. Acc Chem Res. 46 (7), 1487-1496 (2013).
- Hong, M., Zhang, Y., Hu, F. Membrane protein structure and dynamics from NMR spectroscopy. Annu Rev Phys Chem. 63, 1-24 (2012).
- Jelinek, R., Ramamoorthy, A., Opella, S. J. High-Resolution Three-Dimensional Solid-state NMR Spectroscopy of a Uniformly 15N-Labeled Protein. J Am Chem Soc. 117, 12348-12349 (1995).
- Xu, J., et al. Bicelle-enabled structural studies on a membrane-associated cytochrome B5 by solid-state MAS NMR spectroscopy. Angew Chem Int Ed Engl. 47 (41), 7864-7867 (2008).
- Durr, U. H., Gildenberg, M., Ramamoorthy, A. The magic of bicelles lights up membrane protein structure. Chem Rev. 112 (11), 6054-6074 (2012).
- Yamamoto, K., et al. Probing the transmembrane structure and topology of microsomal cytochrome-p450 by solid-state NMR on temperature-resistant bicelles. Sci Rep. 3, 2556 (2013).
- Huang, R., et al. Probing the transmembrane structure and dynamics of microsomal NADPH-cytochrome P450 oxidoreductase by solid-state NMR. Biophys J. 106 (10), 2126-2133 (2014).
- Durr, U. H., Yamamoto, K., Im, S. C., Waskell, L., Ramamoorthy, A. Solid-state NMR reveals structural and dynamical properties of a membrane-anchored electron-carrier protein, cytochrome b5. J Am Chem Soc. 129 (21), 6670-6671 (2007).
- Hong, M. Determination of multiple phi-torsion angles in proteins by selective and extensive (13)C labeling and two-dimensional solid-state NMR. J Magn Reson. 139 (2), 389-401 (1999).
- Lundstrom, P., et al. Fractional 13C enrichment of isolated carbons using [1-13C]- or [2- 13C]-glucose facilitates the accurate measurement of dynamics at backbone Calpha and side-chain methyl positions in proteins. J Biomol NMR. 38 (3), 199-212 (2007).
- Loquet, A., Lv, G., Giller, K., Becker, S., Lange, A. 13C spin dilution for simplified and complete solid-state NMR resonance assignment of insoluble biological assemblies. J Am Chem Soc. 133 (13), 4722-4725 (2011).
- Castellani, F., et al. Structure of a protein determined by solid-state magic-angle-spinning NMR spectroscopy. Nature. 420 (6911), 98-102 (2002).
- Higman, V. A., et al. Assigning large proteins in the solid state: a MAS NMR resonance assignment strategy using selectively and extensively 13C-labelled proteins. J Biomol NMR. 44 (4), 245-260 (2009).
- Bockmann, A., et al. Characterization of different water pools in solid-state NMR protein samples. J Biomol NMR. 45 (3), 319-327 (2009).
- Cavanagh, J., Fairbrother, W. J., Palmer, A. G., Skelton, N. J. . Protein NMR spectroscopy, principles and practice. , (1996).
- Hartman, S. R., Hahn, E. L. Nuclear Double Resonance in the Rotating Frame. Phys Rev. 128 (5), 2042-2053 (1962).
- Harris, R. K., et al. Further conventions for NMR shielding and chemical shifts IUPAC recommendations 2008. Solid State Nucl Magn Reson. 33 (3), 41-56 (2008).
- Wang, Y., Jardetzky, O. Probability-based protein secondary structure identification using combined NMR chemical-shift data. Protein Sci. 11 (4), 852-861 (2002).
- Shaka, A. J., Baker, P. B., Freeman, R. Computer-Optimized Scheme for Wideband Applications and Low-Level Operation. J Magn Reson. 64, 547-552 (1985).
- Szeverenyi, N. M., Sullivan, M. J., Maciel, G. E. Observation of Spin Exchange by Two-Dimensional Fourier-Transform C-13 Cross Polarization-Magic-Angle Spinning. J Magn Reson. 47, 462-475 (1982).
- Baldus, M., Petkova, A. T., Herzfeld, J., Griffin, R. G. Cross polarization in the tilted frame: assignment and spectral simplification in heteronuclear spin systems. Mol Phys. 95 (5), 1197-1207 (1998).
- Verel, R., Ernst, M., Meier, B. H. Adiabatic dipolar recoupling in solid-state NMR: the DREAM scheme. J Magn Reson. 150 (1), 81-99 (2001).
- . Sparky – NMR Assignment and Integration Software Available from: https://www.cgl.ucsf.edu/home/sparky/ (2017)
- Luca, S., et al. Secondary chemical shifts in immobilized peptides and proteins: a qualitative basis for structure refinement under magic angle spinning. J Biomol NMR. 20 (4), 325-331 (2001).
- Shen, Y., Bax, A. SPARTA+: a modest improvement in empirical NMR chemical shift prediction by means of an artificial neural network. J Biomol NMR. 48 (1), 13-22 (2010).
- Berjanskii, M. V., Neal, S., Wishart, D. S. PREDITOR: a web server for predicting protein torsion angle restraints. Nucleic Acids Res. 34 (Web Server issue), W63-W69 (2006).
- Bardiaux, B., Malliavin, T., Nilges, M. ARIA for solution and solid-state NMR. Methods Mol Biol. 831, 453-483 (2012).
- Guerry, P., Herrmann, T. Comprehensive automation for NMR structure determination of proteins. Methods Mol Biol. 831, 429-451 (2012).
- Vasa, S., et al. beta-Helical architecture of cytoskeletal bactofilin filaments revealed by solid-state NMR. Proc Natl Acad Sci U S A. 112 (2), E127-E136 (2015).
- He, L., et al. Structure determination of helical filaments by solid-state NMR spectroscopy. Proc Natl Acad Sci U S A. 113 (3), E272-E281 (2016).
- Tang, M., et al. High-resolution membrane protein structure by joint calculations with solid-state NMR and X-ray experimental data. J Biomol NMR. 51 (3), 227-233 (2011).
- Paravastu, A. K., Leapman, R. D., Yau, W. M., Tycko, R. Molecular structural basis for polymorphism in Alzheimer’s beta-amyloid fibrils. Proc Natl Acad Sci U S A. 105 (47), 18349-18354 (2008).
- Schutz, A. K., et al. Atomic-resolution three-dimensional structure of amyloid beta fibrils bearing the Osaka mutation. Angew Chem Int Ed Engl. 54 (1), 331-335 (2015).
- Sgourakis, N. G., Yau, W. M., Qiang, W. Modeling an in-register, parallel "iowa" abeta fibril structure using solid-state NMR data from labeled samples with rosetta. Structure. 23 (1), 216-227 (2015).
- Lewandowski, J. R., De Paepe, G., Griffin, R. G. Proton assisted insensitive nuclei cross polarization. J Am Chem Soc. 129 (4), 728-729 (2007).
- Carlon, A., et al. How to tackle protein structural data from solution and solid state: An integrated approach. Prog Nucl Magn Reson Spectrosc. 92-93, 54-70 (2016).
- Judge, P. J., Taylor, G. F., Dannatt, H. R., Watts, A. Solid-state nuclear magnetic resonance spectroscopy for membrane protein structure determination. Methods Mol Biol. 1261, 331-347 (2015).
- Wang, S., Ladizhansky, V. Recent advances in magic angle spinning solid state NMR of membrane proteins. Prog Nucl Magn Reson Spectrosc. 82, 1-26 (2014).
- Sborgi, L., et al. Structure and assembly of the mouse ASC inflammasome by combined NMR spectroscopy and cryo-electron microscopy. Proc Natl Acad Sci U S A. 112 (43), 13237-13242 (2015).
- Loquet, A., et al. Atomic structure and handedness of the building block of a biological assembly. J Am Chem Soc. 135 (51), 19135-19138 (2013).
- Walti, M. A., et al. Atomic-resolution structure of a disease-relevant Abeta(1-42) amyloid fibril. Proc Natl Acad Sci U S A. 113 (34), E4976-E4984 (2016).
- Colvin, M. T., et al. Atomic Resolution Structure of Monomorphic Abeta42 Amyloid Fibrils. J Am Chem Soc. 138 (30), 9663-9674 (2016).
- Xiao, Y., et al. Abeta(1-42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer’s disease. Nat Struct Mol Biol. 22 (6), 499-505 (2015).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human alpha-synuclein. Nat Struct Mol Biol. 23 (5), 409-415 (2016).
- Wasmer, C., et al. Amyloid fibrils of the HET-s(218-289) prion form a beta solenoid with a triangular hydrophobic core. Science. 319 (5869), 1523-1526 (2008).
- Van Melckebeke, H., et al. Atomic-resolution three-dimensional structure of HET-s(218-289) amyloid fibrils by solid-state NMR spectroscopy. J Am Chem Soc. 132 (39), 13765-13775 (2010).
- Lamley, J. M., et al. Solid-state NMR of a protein in a precipitated complex with a full-length antibody. J Am Chem Soc. 136 (48), 16800-16806 (2014).
- Agarwal, V., et al. De novo 3D structure determination from sub-milligram protein samples by solid-state 100 kHz MAS NMR spectroscopy. Angew Chem Int Ed Engl. 53 (45), 12253-12256 (2014).
- Stanek, J., et al. NMR Spectroscopic Assignment of Backbone and Side-Chain Protons in Fully Protonated Proteins: Microcrystals, Sedimented Assemblies, and Amyloid Fibrils. Angew Chem Int Ed Engl. 55 (50), 15504-15509 (2016).
- Baker, L. A., Baldus, M. Characterization of membrane protein function by solid-state NMR spectroscopy. Curr Opin Struct Biol. 27, 48-55 (2014).
- Luchinat, E., Banci, L. In-cell NMR: a topical review. IUCrJ. 4 (Pt 2), 108-118 (2017).
- Freedberg, D. I., Selenko, P. Live cell NMR. Annu Rev Biophys. 43, 171-192 (2014).
- Selenko, P., Wagner, G. Looking into live cells with in-cell NMR spectroscopy. J Struct Biol. 158 (2), 244-253 (2007).
- Qiang, W., Yau, W. M., Luo, Y., Mattson, M. P., Tycko, R. Antiparallel beta-sheet architecture in Iowa-mutant beta-amyloid fibrils. Proc Natl Acad Sci U S A. 109 (12), 4443-4448 (2012).
- Bateman, D. A., Tycko, R., Wickner, R. B. Experimentally derived structural constraints for amyloid fibrils of wild-type transthyretin. Biophys J. 101 (10), 2485-2492 (2011).
- Marchanka, A., Simon, B., Althoff-Ospelt, G., Carlomagno, T. RNA structure determination by solid-state NMR spectroscopy. Nat Commun. 6, 7024 (2015).
- Schutz, A. K., et al. The amyloid-Congo red interface at atomic resolution. Angew Chem Int Ed Engl. 50 (26), 5956-5960 (2011).

