Estudios estructurales de escala atómica de asambleas macromoleculares por espectroscopia de estado sólido de resonancia magnética Nuclear
Summary
Estructuras de conjuntos supramoleculares proteína a resolución atómica son de alta relevancia debido a su papel crucial en una variedad de fenómenos biológicos. Adjunto, presentamos un protocolo para llevar a cabo estudios estructurales de alta resolución en asambleas de proteína macromolecular insoluble y no-cristalino magic-angle spinning estado sólido de resonancia magnética nuclear espectroscopia (MAS SSNMR).
Abstract
Asambleas supramolecular proteínas desempeñan un papel fundamental en procesos biológicos que van desde la interacción huésped-patógeno, infección viral a la propagación de enfermedades neurodegenerativas. Estos conjuntos consisten en múltiples subunidades de la proteína organizados de forma no covalente para formar objetos macromoleculares grandes que puedan ejecutar una variedad de funciones celulares o producir consecuencias perjudiciales. Penetraciones atómicas en los mecanismos de montaje y el funcionamiento de las Asambleas macromoleculares siguen siendo a menudo escasas desde su inherente insolubilidad y cristalinidad no reduce a menudo drásticamente la calidad de los datos obtenidos de la mayoría de las técnicas utilizada en biología estructural, tales como Cristalografía de rayos x y resonancia magnética Nuclear (RMN) de solución. Aquí presentamos RMN Espectroscopia de estado sólida magic-angle spinning (SSNMR) como un potente método para investigar las estructuras de asambleas macromoleculares a resolución atómica. SSNMR puede revelar detalles atómicos del complejo montado sin limitaciones de tamaño y solubilidad. El protocolo que presentamos describe los pasos esenciales de la producción de 13C / asambleas de proteína macromolecular marcado con el isótopo15N a la adquisición de espectros SSNMR estándar y su análisis e interpretación. Como ejemplo, mostramos la tubería de un análisis estructural de SSNMR de un conjunto de proteínas filamentosas.
Introduction
Avances en magic-angle spinning espectroscopia de estado sólido de resonancia magnética nuclear (SSNMR) ofrecen una herramienta eficaz para la caracterización estructural de asambleas macromoleculares de proteínas con una resolución atómica. Estas asambleas de proteína son sistemas ubicuos que desempeñan un papel esencial en muchos procesos biológicos. Sus estructuras moleculares, las interacciones y la dinámica es accesible por los estudios SSNMR, como se ha demostrado para viral (cápsida1) y mecanismos de infección bacteriana (secreción sistemas2,3, pili4), membrana proteína complejos5,6,7,8 y amiloides funcionales 9,10,11. Este tipo de montaje molecular también puede provocar patologías como enfermedades neurodegenerativas donde proteínas montan en Estados mal plegados, amiloides y comportamiento celular aberrante o célula muerte 12,13. Asambleas de proteína son construidos a menudo por la Oligomerización simétrico de copias múltiples de subunidades de la proteína en grandes objetos supramoleculares de varias formas incluyendo fibrillas, filamentos, poros, tubos o nanopartículas. La arquitectura cuaternaria está definida por las interacciones débiles entre las subunidades de la proteína para organizar el montaje espacial y temporal y para permitir funciones biológicas sofisticadas. Investigaciones estructurales a escala atómica en estas asambleas son un desafío para las técnicas de alta resolución desde su indisolubilidad intrínseca y muy a menudo su no-cristalinidad restringe el uso de solución NMR o Cristalografía de rayos x convencional se acerca. Magic-angle spinning SSNMR (MAS) es una técnica emergente para obtener datos de resolución atómica de asambleas macromoleculares insolubles y ha demostrado su eficacia para resolver modelos atómicos 3D para un creciente número de sistemas biomoleculares complejos, incluyendo filamentos bacterianos, las asambleas y partículas virales 14,15,16,17,18,19,20, 21,22. Avances técnicos en campos magnéticos altos, desarrollos metodológicos y preparación de la muestra ha establecido MAS SSNMR en un método robusto para investigar proteínas insolubles en varios ambientes, en particular en su biológicamente relevantes macromoleculares armados estatales o en las membranas celulares, haciendo la técnica altamente complementarias a microscopia del cryo-electrón. En muchos casos, un alto grado de simetría caracteriza tales asambleas de proteína. MAS SSNMR explota esta característica, como todas subunidades de la proteína en una Asamblea de homomolecular tendría la misma estructura local y por lo tanto, prácticamente la misma SSNMR firma, reduciendo drásticamente la complejidad del análisis.
Un protocolo eficiente para estudios estructurales de los conjuntos de proteínas macromoleculares por MAS moderadas (< 25 kHz) SSNMR se presenta en este video y se puede subdividir en diferentes pasos (figura 1). Le mostraremos las etapas críticas del flujo de trabajo de un estudio estructural de SSNMR ejemplificado en un conjunto de proteínas filamentosas (pasos ver resaltado en la figura 1), con la excepción de purificación de la subunidad de la proteína, diferentes para cada proteína Asamblea pero de vital importancia para los estudios estructurales y sin entrar en detalles técnicos/metodológicos del cálculo de la espectroscopia y estructura de la SSNMR para qué tutoriales especializados están disponible en línea. Mientras que el presente Protocolo se concentrará principalmente en estado sólidos experimentos NMR realizados en condiciones de MAS, el uso de alineado entornos biológicos 23,24,25,26 , 27, como bicelles alineadas, permiten la investigación de la conformación de la proteína y la interacción dinámica de proteínas en membrana-como medios sin tecnología MAS. Vamos a mostrar la expresión de la proteína y los pasos de ensamblaje así como la grabación de los espectros SSNMR cruciales y su análisis e interpretación. Nuestro objetivo es proporcionar penetraciones en la tubería de análisis estructural que permite al lector a realizar un estudio estructural de resolución atómica de una Asamblea macromolecular mediante técnicas SSNMR.
El protocolo comprende 3 secciones:
1. estado sólido producción NMR de la muestra
Como un requisito previo a un análisis de NMR de estado sólido, los componentes proteicos de la necesidad de ensamblaje macromolecular a expresarse, marcado con el isótopo, purificada y montado en vitro en el estado complejo nativo (para un ejemplo véase figura 2) . Para asegurar la alta sensibilidad de NMR, enriquecimiento del isótopo en 13C y 15N etiquetado es necesario mediante el uso de los medios de expresión bacteriana mínima complementados con 13C y 15N fuentes, tales como uniforme 13 Etiquetado C glucosa/glicerol y 15NH4Cl respectivamente. En la etapa posterior del Protocolo, selectivamente muestras marcada con C 13producción con selectivamente 13fuentes C-etiquetados como (1, 3 –13C)- y (2 –13C)-glicerol (o (1 –13C)- y (2 –13C)- glucosa) se utilizan para facilitar el análisis de NMR. Muestra etiquetada mixta correspondiente a una mezcla equimolar de 50% 13C-etiquetado o 50% y 50% 15N – (1, 3 –13C)- y el 50% (2 –13C)-glucosa se introducen para describir la detección de intermolecular interacciones. Un alto grado de pureza de proteína así como condiciones rigurosas durante el paso de montaje son factores clave para asegurar un orden estructural homogénea de la muestra final.
2. preliminar caracterización estructural basado en unidimensional NMR de estado sólido (1D)
Presentamos los experimentos esenciales para un análisis estructural de SSNMR. Unidimensional (1D) polarización transversal (CP) y INEPT / experimentos de28 RINEPT, detectados en núcleos de 13C se utilizan para detectar segmentos de proteína rígida y flexible en la Asamblea, respectivamente y para estimar el grado de estructural homogeneidad y polimorfismo local (para una ejemplo véase figura 3).
Rong > 3. Determinación de la estructura del análisis conformacional y 3D
Incisos 1 y 2 refieren al análisis conformacional, que se basan en la asignación de la resonancia SSNMR de todos los residuos rígidos de la Asamblea de la proteína, como los cambios químicos son sondas muy sensibles con el medio ambiente local y pueden utilizarse para predecir la phi/psi diedro de los ángulos y así determinar la estructura secundaria. Figura 4 ilustra un ejemplo de una asignación de resonancia secuencial en la base rígida de un conjunto de proteína. La determinación de la estructura 3D se basa en la recopilación de datos estructurales tales como las restricciones de distancia codificación cerca de cercanías (< 7-9 Å), que contiene tanto intra – e intermolecular información. Incisos 3 y 4 describen interpretación y colección de moderación distante a largo plazo. Contactos de largo alcance se definen como intramolecular 13C –13C cercanías derivados residuos de i a j, con | i-j | ≥4, definiendo así el pliegue de terciaria de la proteína de la subunidad monomérica o como intermoleculares 13C –13C cercanías, definiendo las interfaces intermoleculares entre las subunidades de proteína en la Asamblea. Intra – e intermoleculares interfaces se ilustran en la figura 5. Restricciones SSNMR detectaron a través de 13C –13C y 15N –13C Asociación experimentos generalmente codifican para distancias internuclear < 1 nm. Subsección 4 explica la detección de las limitaciones de la distancia intermolecular. En las Asambleas de proteína simétrica, el uso de muestras etiquetados homogéneo (es decir, 100% etiquetada uniformemente o selectivamente) para identificar las interacciones intermoleculares subunidad-subunidad es limitada, como tanto intra – y inter – molecular contactos conducen a señales detectables. La detección inequívoca de cercanías intermoleculares se logra utilizando muestras etiquetadas mixtas, que contiene una mezcla equimolar de dos muestras etiquetadas diferentemente, combinado antes de la agregación. Inciso 5 presenta brevemente modelado de la estructura.
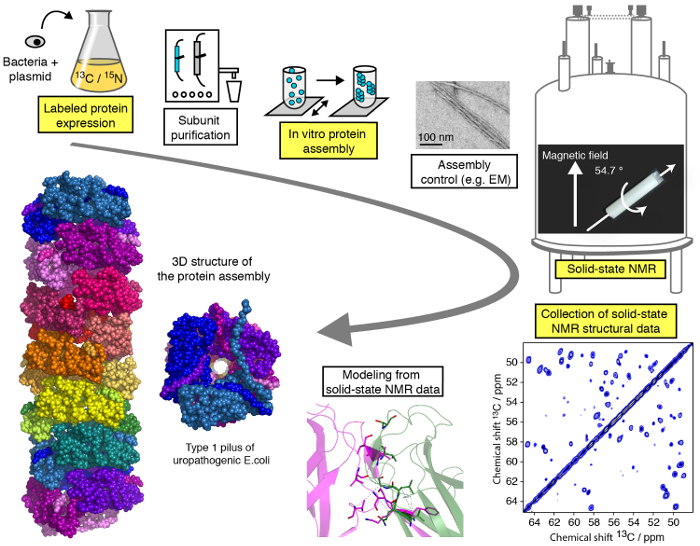
Figura 1 : Flujo de trabajo de un estudio estructural de resolución atómica por NMR de estado sólido. 13 C, isótopo 15N marcada producción de proteínas, purificación de la subunidad, montaje de la subunidad, control de formación de la Asamblea, SSNMR experimentos, análisis de experimento SSNMR y extracción de las restricciones de distancia, y se muestran modelos de estructura. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
NMR de estado sólido (SSNMR) es un método de elección para la caracterización de conjuntos de proteínas macromoleculares en un nivel atómico. Uno de los temas centrales en la determinación de la estructura basada en la SSNMR es la calidad espectral del sistema investigado, que permite crear modelos estructurales 3D de precisión diferentes, generalmente que van desde modelos de baja resolución (contiene el secundario estructura elementos y poca información 3D) a pseudo-atómicas estructuras 3D. La cantidad y calidad de información estructural extraída de experimentos SSNMR multidimensionales es la clave para calcular una estructura de NMR de alta resolución de la Asamblea.
El protocolo descrito se basa en la detección de 13C –13C y 15N –13C estructural las restricciones que requiere la grabación de varios espectros 2D (y a veces 3D) con alta señal a ruido. A frecuencias MAS moderadas (< 25 kHz), se introduce la muestra en rotores con tamaños de 3.2-4 mm de diámetro permitiendo cantidades de proteína de hasta ~ 50 mg, depende de la hidratación de la muestra. La cantidad de muestra dentro del rotor es directamente proporcional a la relación de señal a ruido en espectros SSNMR, un factor decisivo para la detección de las limitaciones de distancia de largo alcance y la asignación inequívoca.
La resolución espectral es un parámetro crucial durante la asignación secuencial de la resonancia y la colección de restricciones. Para obtener resultados óptimos, los parámetros de preparación de la muestra necesitan ser optimizado, particularmente en la purificación de la subunidad y las condiciones de montaje (pH, buffer, agitación, temperatura, etc.). Para la optimización de la muestra, se recomienda para preparar muestras sin etiqueta para varias condiciones distintas para las que se ha observado la Asamblea y para grabar un 1D 1H –13C CP espectro (descrito en el paso 2.1) en cada muestra preparada. Los espectros sirven para comparar la dispersión entre las diferentes preparaciones, basado en que se pueden determinar las condiciones óptimas y resolución espectral.
La calidad de los datos SSNMR depende fuertemente de la elección de los parámetros de adquisición de NMR, especialmente para los pasos de transferencia de polarización. El uso de altas fuerzas del campo magnético (≥600 MHz 1H de frecuencia) es esencial para la alta sensibilidad y resolución espectral, necesaria frente a objetivos complejos tales como asambleas de proteína macromolecular.
Un factor limitante en muchos casos es la disponibilidad de espectrómetro. Por lo tanto, una elección juiciosa de las muestras a ser preparado debe preceder a la sesión del espectrómetro. En cualquier caso, uniformemente 13C, 15muestra marcada con el N es un requisito previo para realizar la asignación secuencial y la residual de resonancia. Asignado por estado sólidas técnicas de RMN de proteínas ver71. Determinación de la estructura de asambleas macromoleculares en frecuencias MAS moderadas requiere selectivamente las muestras marcada con C 13; para la detección de largo alcance 13C –13C y 13C –15N en contacto con las muestras basadas en 1, 3 –13C – y 2 –13C-gylcerol o 1 –13C – y 2 –13C-glucosa etiquetado son de uso general, como se describe anteriormente. La elección entre los dos sistemas de etiquetado se basa en la relación de señal a ruido espectral y resolución. Para distinguir entre el intra – e intermoleculares contactos a largo plazo, mixtas muestras etiquetadas y diluidas han revelado eficientes.
En Resumen, los pasos críticos para un estudio estructural atómico de SSNMR son: (i) la preparación de las subunidades y la necesidad de la Asamblea a ser optimizada para obtener la muestra excelente cantidad y calidad, (ii) Espectrómetro campo fuerza y adquisición de los parámetros deben ser escogido cuidadosamente; III selectivos Etiquetadoras estrategias se requieren para una determinación de la estructura 3D y la cantidad de datos requeridos depende de la calidad de los datos y la disponibilidad de datos complementarios.
A pesar de su aplicabilidad a una amplia gama de sistemas supramoleculares, que van desde proteínas de la membrana homomultimeric nano-objetos, SSNMR es a menudo limitada por la necesidad de cantidades de mg de material isotópicamente etiquetado. Los recientes desarrollos tecnológicos en ultra rápido SSNMR MAS (≥100 kHz) abrir la Avenida 1detectado H NMR y empujar el límite de la cantidad de muestra mínima para sub-mg 72,73,74. Sin embargo, para estudios estructurales detallados 13C-etiquetado muestras son indispensables, que limita la aplicación de SSNMR para las muestras montadas en vitro o sistemas expresados en los organismos que sobreviven en un medio mínimo, donde en las células SSNMR es un método emergente (para comentarios ver 75,76,77,78).
Un factor importante en el uso de SSNMR para obtener estructuras 3D de alta resolución es la resolución espectral: intrínseca heterogeneidad conformacional en una Asamblea puede limitar el análisis de espectros y resolución espectral. Residuo específico 13C etiquetado puede en algunos casos ofrecer una alternativa para obtener información de la distancia específica sobre residuos estratégicos con el fin de obtener modelos estructurales (para una reciente ejemplos véase 79,80).
SSNMR para la determinación de la estructura 3D todavía requiere la colección de varios conjuntos de datos con tiempos de recogida de datos a menudo mucho en instrumentos sofisticados, dependiendo el enfoque y el sistema varios días a semanas en un 600-1000 MHz (frecuencia de1H) Espectrómetro de. Por lo tanto, el acceso a tiempo de espectrómetro puede ser un factor limitante en un profundo estudio de la SSNMR.
En el caso de conjuntos de proteínas homomultimeric, llevando a datos SSNMR de calidad suficiente para identificar un gran número de limitaciones estructurales como en 3,57,64,70, SSNMR no da todavía tienen acceso a las dimensiones microscópicas. Por lo tanto, en una determinación de novo de SSNMR estructura de un conjunto de homomultimeric, EM o datos de masa por longitud (MPL) idealmente complementan datos SSNMR para derivar los parámetros de la simetría. SSNMR datos solo proporcionan la atómica intra – e intermoleculares interfaces
SSNMR es altamente complementario con técnicas estructurales como la EM o MPL medidas pero los datos también perfectamente se pueden combinar con las estructuras atómicas obtenidas por cristalografía de rayos x o solución NMR en subunidades truncados o mutados. Un número creciente de estudios puede encontrarse en la literatura donde la conjunción de diferentes datos estructurales ha permitido determinar modelos atómicos 3D de asambleas macromoleculares (ver figura 6 para ejemplos representativos).
En el campo de la biología estructural, SSNMR surge como una técnica prometedora para el estudio deinsolubles y no-cristalino asambleas en el atómico nivel, es decir, proporcionar datos estructurales a escala atómica. En este sentido, SSNMR es el colgante a solución NMR y Cristalografía de rayos x para conjuntos moleculares, incluyendo proteínas de membrana en sus asambleas de medio ambiente y de la proteína nativas como sobres virales, bacterianas filamentos o amiloides, así como RNA y Complejos RNA-proteína (véase por ejemplo81). Su gran versatilidad de aplicaciones en vitro y en el contexto celular, como el seguimiento de los cambios estructurales secundarios, terciarios y cuaternarios, identificar superficies de interacción con las moléculas del socio en la escala atómica (por ejemplo 82) y asignación dinámica molecular en el contexto de complejos montados, indican el importante potencial de SSNMR en futuros estudios estructurales sobre conjuntos de complejos biomoleculares.
| Componente | Medio M9 |
| NaCl | 0,5 g/L |
| KH2PO4 | 3 g/L |
| Na2HPO4 | 6,7 g/L |
| MgSO4 | 1 mM |
| Vivencias2 | 10 ΜM |
| FECLAS3 | 1 ΜM |
| CaCl2 | 100 ΜM |
| MEM vitamina mezcla 100 X | 10 mL/L |
| 13 C glucosa | 2 g/L |
| 15 NH4Cl | 1 g/L |
Tabla 1: Composición del medio de la mínima expresión de proteínas recombinantes de producción de E. coli células BL21.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo es financiado por la ANR (13-PDOC-0017-01 B.H. y ANR-14-CE09-0020-01 para A.L.), “Inversiones para el futuro” programa IdEx Bordeaux/CNRS (PEPS 2016 a B.H.) referencia ANR-10-IDEX-03-02 a B.H., la Fondation pour la Recherche Médicale ( FRM-AJE20140630090 a A.L.), el programa FP7 (FP7-PEOPLE-2013-CIG a A.L.) y el Consejo Europeo de investigación (CEI) bajo el programa de investigación e innovación a los horizonte 2020 de la Unión Europea (ERC Starting Grant para A.L., acuerdo No 639020) y proyecto ” WEAKINTERACT.”
Materials
| Instruments | |||
| NMR Spectrometer (> 11.7 Tesla) | Bruker | – | |
| triple resonance MAS SSNMR probehead | Bruker | – | |
| SSNMR rotors 4mm | Bruker | K1910 | |
| Centrifuge 5804 R | Eppendorf | 5805000629 | |
| GeneQuant 1300 spectrometer | Dutscher | 28-9182-13 | |
| IGS60 INCUBATEUR HERATHERM 75 L | Dutscher | 228001 | |
| MaxQ 4450 bench top orbital shaker | Dutscher | 78376 | |
| Tube Revolver Agitator | Dutscher | 79547 | |
| sonopuls HD 3100 | Bandelin | 3680 | |
| MicroPulser electroporator | Biorad | 165-2100 | |
| mini-PROTEAN tetra cell system | Biorad | 165-8000 | |
| AKTA pure system | GE Healthcare | 29-0182-24 | |
| capillary microman M25 pipet | Gilson | F148502 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| amiconR ultra-15 | sigma | Z740199-8EA | |
| capillaries and pistons | Gilson | F148112 | |
| spatula | Fisher | 13263799 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| D-glucose 13C6 | Sigma | 389374 | |
| Ammonium-15N-chloride | Sigma | 299251 | |
| 1,3 13C2 glycerol | Sigma | 492639 | |
| 2 13C glycerol | Sigma | 489484 | |
| Kanamycin | Sigma | K1876 | |
| Carbenicillin | Sigma | C3416 | |
| Sodium phosphate dibasic | Sigma | S7907 | |
| Potassium phosphate monobasic | Sigma | P5655 | |
| Sodium chloride | Sigma | 71380 | |
| calcium chloride | Sigma | C1016 | |
| Magnesium sulfate | Sigma | 208094 | |
| Iron Chloride | Sigma | 157740 | |
| Zinc chloride | Sigma | 793523 | |
| MEM Vitamin Solution (100×) | Sigma | M68954 | |
| IPTG | Fisher | BP1755 | |
| Trizma base | Sigma | T1503 | |
| Tricine | Sigma | T0377 | |
| SDS | Sigma | 436143 | |
| sodium azide | sigma | 71289 | |
| 4,4-dimethyl-4-silapentane-1-sulfonic acid | Sigma | 178837 | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Unicorn 6.3 | GE Healthcare | Akta systems | |
| ccpNMR | CCPN | spectrometer systems |
References
- Morag, O., Sgourakis, N. G., Baker, D., Goldbourt, A. The NMR-Rosetta capsid model of M13 bacteriophage reveals a quadrupled hydrophobic packing epitope. Proc Natl Acad Sci U S A. 112 (4), 971-976 (2015).
- Loquet, A., et al. Atomic model of the type III secretion system needle. Nature. 486 (7402), 276-279 (2012).
- Demers, J. P., et al. High-resolution structure of the Shigella type-III secretion needle by solid-state NMR and cryo-electron microscopy. Nat Commun. 5 (4976), (2014).
- Habenstein, B., et al. Hybrid Structure of the Type 1 Pilus of Uropathogenic Escherichia coli. Angew Chem Int Ed Engl. 54 (40), 11691-11695 (2015).
- Cady, S. D., et al. Structure of the amantadine binding site of influenza M2 proton channels in lipid bilayers. Nature. 463 (7281), 689-692 (2010).
- Park, S. H., et al. Structure of the chemokine receptor CXCR1 in phospholipid bilayers. Nature. 491 (7426), 779-783 (2012).
- Kaplan, M., et al. Probing a cell-embedded megadalton protein complex by DNP-supported solid-state NMR. Nat Methods. 12 (7), 649-652 (2015).
- Wang, S., et al. Solid-state NMR spectroscopy structure determination of a lipid-embedded heptahelical membrane protein. Nat Methods. 10 (10), 1007-1012 (2013).
- Daskalov, A., et al. Signal transduction by a fungal NOD-like receptor based on propagation of a prion amyloid fold. PLoS Biol. 13 (2), e1002059 (2015).
- Daskalov, A., et al. Identification of a novel cell death-inducing domain reveals that fungal amyloid-controlled cell death is related to necroptosis. Proc Natl Acad Sci U S A. , (2016).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nat Rev Mol Cell Biol. 15 (6), 384-396 (2014).
- Aguzzi, A., Lakkaraju, A. K. Cell Biology of Prions and Prionoids: A Status Report. Trends Cell Biol. 26 (1), 40-51 (2016).
- Habenstein, B., Loquet, A. Solid-state NMR: An emerging technique in structural biology of self-assemblies. Biophys Chem. , (2015).
- Meier, B. H., Bockmann, A. The structure of fibrils from ‘misfolded’ proteins. Curr Opin Struct Biol. 30, 43-49 (2015).
- Miao, Y., Cross, T. A. Solid state NMR and protein-protein interactions in membranes. Curr Opin Struct Biol. 23 (6), 919-928 (2013).
- Tang, M., Comellas, G., Rienstra, C. M. Advanced solid-state NMR approaches for structure determination of membrane proteins and amyloid fibrils. Acc Chem Res. 46 (9), 2080-2088 (2013).
- Weingarth, M., Baldus, M. Solid-state NMR-based approaches for supramolecular structure elucidation. Acc Chem Res. 46 (9), 2037-2046 (2013).
- Loquet, A., Habenstein, B., Lange, A. Structural investigations of molecular machines by solid-state NMR. Acc Chem Res. 46 (9), 2070-2079 (2013).
- Yan, S., Suiter, C. L., Hou, G., Zhang, H., Polenova, T. Probing structure and dynamics of protein assemblies by magic angle spinning NMR spectroscopy. Acc Chem Res. 46 (9), 2047-2058 (2013).
- Tycko, R., Wickner, R. B. Molecular structures of amyloid and prion fibrils: consensus versus controversy. Acc Chem Res. 46 (7), 1487-1496 (2013).
- Hong, M., Zhang, Y., Hu, F. Membrane protein structure and dynamics from NMR spectroscopy. Annu Rev Phys Chem. 63, 1-24 (2012).
- Jelinek, R., Ramamoorthy, A., Opella, S. J. High-Resolution Three-Dimensional Solid-state NMR Spectroscopy of a Uniformly 15N-Labeled Protein. J Am Chem Soc. 117, 12348-12349 (1995).
- Xu, J., et al. Bicelle-enabled structural studies on a membrane-associated cytochrome B5 by solid-state MAS NMR spectroscopy. Angew Chem Int Ed Engl. 47 (41), 7864-7867 (2008).
- Durr, U. H., Gildenberg, M., Ramamoorthy, A. The magic of bicelles lights up membrane protein structure. Chem Rev. 112 (11), 6054-6074 (2012).
- Yamamoto, K., et al. Probing the transmembrane structure and topology of microsomal cytochrome-p450 by solid-state NMR on temperature-resistant bicelles. Sci Rep. 3, 2556 (2013).
- Huang, R., et al. Probing the transmembrane structure and dynamics of microsomal NADPH-cytochrome P450 oxidoreductase by solid-state NMR. Biophys J. 106 (10), 2126-2133 (2014).
- Durr, U. H., Yamamoto, K., Im, S. C., Waskell, L., Ramamoorthy, A. Solid-state NMR reveals structural and dynamical properties of a membrane-anchored electron-carrier protein, cytochrome b5. J Am Chem Soc. 129 (21), 6670-6671 (2007).
- Hong, M. Determination of multiple phi-torsion angles in proteins by selective and extensive (13)C labeling and two-dimensional solid-state NMR. J Magn Reson. 139 (2), 389-401 (1999).
- Lundstrom, P., et al. Fractional 13C enrichment of isolated carbons using [1-13C]- or [2- 13C]-glucose facilitates the accurate measurement of dynamics at backbone Calpha and side-chain methyl positions in proteins. J Biomol NMR. 38 (3), 199-212 (2007).
- Loquet, A., Lv, G., Giller, K., Becker, S., Lange, A. 13C spin dilution for simplified and complete solid-state NMR resonance assignment of insoluble biological assemblies. J Am Chem Soc. 133 (13), 4722-4725 (2011).
- Castellani, F., et al. Structure of a protein determined by solid-state magic-angle-spinning NMR spectroscopy. Nature. 420 (6911), 98-102 (2002).
- Higman, V. A., et al. Assigning large proteins in the solid state: a MAS NMR resonance assignment strategy using selectively and extensively 13C-labelled proteins. J Biomol NMR. 44 (4), 245-260 (2009).
- Bockmann, A., et al. Characterization of different water pools in solid-state NMR protein samples. J Biomol NMR. 45 (3), 319-327 (2009).
- Cavanagh, J., Fairbrother, W. J., Palmer, A. G., Skelton, N. J. . Protein NMR spectroscopy, principles and practice. , (1996).
- Hartman, S. R., Hahn, E. L. Nuclear Double Resonance in the Rotating Frame. Phys Rev. 128 (5), 2042-2053 (1962).
- Harris, R. K., et al. Further conventions for NMR shielding and chemical shifts IUPAC recommendations 2008. Solid State Nucl Magn Reson. 33 (3), 41-56 (2008).
- Wang, Y., Jardetzky, O. Probability-based protein secondary structure identification using combined NMR chemical-shift data. Protein Sci. 11 (4), 852-861 (2002).
- Shaka, A. J., Baker, P. B., Freeman, R. Computer-Optimized Scheme for Wideband Applications and Low-Level Operation. J Magn Reson. 64, 547-552 (1985).
- Szeverenyi, N. M., Sullivan, M. J., Maciel, G. E. Observation of Spin Exchange by Two-Dimensional Fourier-Transform C-13 Cross Polarization-Magic-Angle Spinning. J Magn Reson. 47, 462-475 (1982).
- Baldus, M., Petkova, A. T., Herzfeld, J., Griffin, R. G. Cross polarization in the tilted frame: assignment and spectral simplification in heteronuclear spin systems. Mol Phys. 95 (5), 1197-1207 (1998).
- Verel, R., Ernst, M., Meier, B. H. Adiabatic dipolar recoupling in solid-state NMR: the DREAM scheme. J Magn Reson. 150 (1), 81-99 (2001).
- . Sparky – NMR Assignment and Integration Software Available from: https://www.cgl.ucsf.edu/home/sparky/ (2017)
- Luca, S., et al. Secondary chemical shifts in immobilized peptides and proteins: a qualitative basis for structure refinement under magic angle spinning. J Biomol NMR. 20 (4), 325-331 (2001).
- Shen, Y., Bax, A. SPARTA+: a modest improvement in empirical NMR chemical shift prediction by means of an artificial neural network. J Biomol NMR. 48 (1), 13-22 (2010).
- Berjanskii, M. V., Neal, S., Wishart, D. S. PREDITOR: a web server for predicting protein torsion angle restraints. Nucleic Acids Res. 34 (Web Server issue), W63-W69 (2006).
- Bardiaux, B., Malliavin, T., Nilges, M. ARIA for solution and solid-state NMR. Methods Mol Biol. 831, 453-483 (2012).
- Guerry, P., Herrmann, T. Comprehensive automation for NMR structure determination of proteins. Methods Mol Biol. 831, 429-451 (2012).
- Vasa, S., et al. beta-Helical architecture of cytoskeletal bactofilin filaments revealed by solid-state NMR. Proc Natl Acad Sci U S A. 112 (2), E127-E136 (2015).
- He, L., et al. Structure determination of helical filaments by solid-state NMR spectroscopy. Proc Natl Acad Sci U S A. 113 (3), E272-E281 (2016).
- Tang, M., et al. High-resolution membrane protein structure by joint calculations with solid-state NMR and X-ray experimental data. J Biomol NMR. 51 (3), 227-233 (2011).
- Paravastu, A. K., Leapman, R. D., Yau, W. M., Tycko, R. Molecular structural basis for polymorphism in Alzheimer’s beta-amyloid fibrils. Proc Natl Acad Sci U S A. 105 (47), 18349-18354 (2008).
- Schutz, A. K., et al. Atomic-resolution three-dimensional structure of amyloid beta fibrils bearing the Osaka mutation. Angew Chem Int Ed Engl. 54 (1), 331-335 (2015).
- Sgourakis, N. G., Yau, W. M., Qiang, W. Modeling an in-register, parallel "iowa" abeta fibril structure using solid-state NMR data from labeled samples with rosetta. Structure. 23 (1), 216-227 (2015).
- Lewandowski, J. R., De Paepe, G., Griffin, R. G. Proton assisted insensitive nuclei cross polarization. J Am Chem Soc. 129 (4), 728-729 (2007).
- Carlon, A., et al. How to tackle protein structural data from solution and solid state: An integrated approach. Prog Nucl Magn Reson Spectrosc. 92-93, 54-70 (2016).
- Judge, P. J., Taylor, G. F., Dannatt, H. R., Watts, A. Solid-state nuclear magnetic resonance spectroscopy for membrane protein structure determination. Methods Mol Biol. 1261, 331-347 (2015).
- Wang, S., Ladizhansky, V. Recent advances in magic angle spinning solid state NMR of membrane proteins. Prog Nucl Magn Reson Spectrosc. 82, 1-26 (2014).
- Sborgi, L., et al. Structure and assembly of the mouse ASC inflammasome by combined NMR spectroscopy and cryo-electron microscopy. Proc Natl Acad Sci U S A. 112 (43), 13237-13242 (2015).
- Loquet, A., et al. Atomic structure and handedness of the building block of a biological assembly. J Am Chem Soc. 135 (51), 19135-19138 (2013).
- Walti, M. A., et al. Atomic-resolution structure of a disease-relevant Abeta(1-42) amyloid fibril. Proc Natl Acad Sci U S A. 113 (34), E4976-E4984 (2016).
- Colvin, M. T., et al. Atomic Resolution Structure of Monomorphic Abeta42 Amyloid Fibrils. J Am Chem Soc. 138 (30), 9663-9674 (2016).
- Xiao, Y., et al. Abeta(1-42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer’s disease. Nat Struct Mol Biol. 22 (6), 499-505 (2015).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human alpha-synuclein. Nat Struct Mol Biol. 23 (5), 409-415 (2016).
- Wasmer, C., et al. Amyloid fibrils of the HET-s(218-289) prion form a beta solenoid with a triangular hydrophobic core. Science. 319 (5869), 1523-1526 (2008).
- Van Melckebeke, H., et al. Atomic-resolution three-dimensional structure of HET-s(218-289) amyloid fibrils by solid-state NMR spectroscopy. J Am Chem Soc. 132 (39), 13765-13775 (2010).
- Lamley, J. M., et al. Solid-state NMR of a protein in a precipitated complex with a full-length antibody. J Am Chem Soc. 136 (48), 16800-16806 (2014).
- Agarwal, V., et al. De novo 3D structure determination from sub-milligram protein samples by solid-state 100 kHz MAS NMR spectroscopy. Angew Chem Int Ed Engl. 53 (45), 12253-12256 (2014).
- Stanek, J., et al. NMR Spectroscopic Assignment of Backbone and Side-Chain Protons in Fully Protonated Proteins: Microcrystals, Sedimented Assemblies, and Amyloid Fibrils. Angew Chem Int Ed Engl. 55 (50), 15504-15509 (2016).
- Baker, L. A., Baldus, M. Characterization of membrane protein function by solid-state NMR spectroscopy. Curr Opin Struct Biol. 27, 48-55 (2014).
- Luchinat, E., Banci, L. In-cell NMR: a topical review. IUCrJ. 4 (Pt 2), 108-118 (2017).
- Freedberg, D. I., Selenko, P. Live cell NMR. Annu Rev Biophys. 43, 171-192 (2014).
- Selenko, P., Wagner, G. Looking into live cells with in-cell NMR spectroscopy. J Struct Biol. 158 (2), 244-253 (2007).
- Qiang, W., Yau, W. M., Luo, Y., Mattson, M. P., Tycko, R. Antiparallel beta-sheet architecture in Iowa-mutant beta-amyloid fibrils. Proc Natl Acad Sci U S A. 109 (12), 4443-4448 (2012).
- Bateman, D. A., Tycko, R., Wickner, R. B. Experimentally derived structural constraints for amyloid fibrils of wild-type transthyretin. Biophys J. 101 (10), 2485-2492 (2011).
- Marchanka, A., Simon, B., Althoff-Ospelt, G., Carlomagno, T. RNA structure determination by solid-state NMR spectroscopy. Nat Commun. 6, 7024 (2015).
- Schutz, A. K., et al. The amyloid-Congo red interface at atomic resolution. Angew Chem Int Ed Engl. 50 (26), 5956-5960 (2011).

