الحجم الذري الدراسات الهيكلية للتجميعات الجزيئات بالتحليل الطيفي الرنين المغناطيسي النووي الصلبة
Summary
هياكل الجمعيات البروتين سوبراموليكولار في قرار الذرية ذات أهمية عالية نظراً لدورهم الحاسم في مجموعة متنوعة من الظواهر البيولوجية. وهنا، نقدم بروتوكولا لإجراء دراسات الهيكلية ذات الدقة العالية على التجميعات البروتين الجزيئات غير قابلة للذوبان وغير البلورية بالسحر-زاوية الغزل مطيافية الرنين المغناطيسي النووي الصلبة (سنمر ماس).
Abstract
التجميعات البروتين supramolecular أدواراً أساسية في العمليات البيولوجية التي تتراوح بين المضيف الممرض التفاعل، العدوى الفيروسية للدعوة لاضطرابات الأعصاب. هذه التجميعات تتألف من عدة مفارز البروتين نظمت بطريقة غير التساهمية لتشكل الأجسام الجزيئات الكبيرة التي يمكن تنفيذ مجموعة متنوعة من الوظائف الخلوية أو التسبب في آثار ضارة. الذرية ثاقبة آليات الجمعية وسير عمل هذه الجمعيات الجزيئات تظل غالباً النادرة منذ بهم إينسولوبيليتي الأصيل وغير كريستالينيتي يخفض بشكل كبير وكثيراً ما نوعية البيانات التي تم الحصول عليها من معظم التقنيات وتستخدم في علم الأحياء الهيكلية، مثل حل “الرنين المغناطيسي النووي” (الرنين المغناطيسي النووي) وعلم البلورات بالأشعة السينية. ونقدم هنا الغزل ماجيك-زاوية أطياف الرنين المغناطيسي النووي الصلبة (سنمر) كوسيلة قوية للتحقيق في هياكل الجمعيات الجزيئات في القرار الذري. سنمر يمكن أن تكشف عن تفاصيل الذري في المجمع تجميعها دون قيود الحجم والقابلية للذوبان. البروتوكول المقدمة هنا توضح الخطوات الأساسية من إنتاج 13ج/التجميعات المسماة النظائر الجزيئات بروتين15N للحصول على معيار سنمر الأطياف وتحليلها وتفسيرها. على سبيل مثال، نعرض الأنبوب التحليل الهيكلي سنمر جمعية البروتينات الخيطية.
Introduction
التقدم في الزاوية ماجيك الغزل مطيافية الرنين المغناطيسي النووي الصلبة (سنمر) توفر أداة فعالة لتحديد خصائص الهيكلية للتجميعات البروتين الجزيئات في قرار ذرية. هذه التجميعات البروتين هي نظم في كل مكان التي تلعب دوراً أساسيا في العديد من العمليات البيولوجية. هياكلها الجزيئي والتفاعلات والديناميات يتم الوصول إليها عن طريق الدراسات سنمر، كما أظهرت الفيروسية (كابسيدس1) وآليات العدوى البكتيرية (إفراز أنظمة2،3، بيلي4)، والغشاء البروتين المجمعات5،6،،من78 والوظيفية أميلويدس 9،،من1011. يمكن أيضا أن تثير هذا النوع من الجمعية الجزيئية الأمراض كما هو الحال في أمراض الأعصاب حيث التجمع في تجمعات، اميلويد الدول البروتينات ويسبب السلوك الشاذ الخلية أو الخلايا وفاة 12،13. غالباً ما يتم بناؤها التجميعات البروتين قبل أوليجوميريزاتيون متماثل من مضاعفات نسخاً من مفارز البروتين في الكائنات سوبراموليكولار كبيرة من مختلف الأشكال بما في ذلك ييفات، خيوط، المسام، وأنابيب، أو جسيمات نانوية. ويعرف هيكل رباعي التفاعلات الضعيفة بين مفارز البروتين لتنظيم الجمعية المكانية والزمانية والسماح للوظائف البيولوجية المتطورة. التحقيقات الهيكلية على نطاق الذري في هذه التجميعات تحديا لتقنيات عالية الدقة منذ على إينسولوبيليتي الذاتية وفي كثير من الأحيان على غير كريستالينيتي يقيد استخدام علم البلورات بالأشعة السينية التقليدية أو حل الرنين المغناطيسي النووي النهج. زاوية ماجيك الغزل سنمر (ماس) هو أسلوب ناشئة للحصول على بيانات القرار الذري على التجميعات الجزيئات غير قابلة للذوبان وأثبتت كفاءتها لحل نماذج ثلاثية الأبعاد الذرية لعدد متزايد من الأنظمة الجزيئية البيولوجية المعقدة، بما في ذلك خيوط البكتيرية وجمعيات اميلويد والجسيمات الفيروسية 14،،من1516،17،،من1819،20، ،من 2122. وقد أنشأت التقدم التقني في مجالات مغناطيسية عالية والتطورات المنهجية وإعداد نموذج “سنمر ماس” إلى وسيلة قوية للتحقيق في البروتينات غير قابلة للذوبان في بيئات مختلفة، لا سيما في تلك الناحية البيولوجية ذات الصلة بالجزيئات جمعت الدولة أو في الأغشية الخلوية، مما يجعل التقنية عالية مكملة الميكروسكوب الإلكتروني cryo. في كثير من الحالات، تميز بدرجة عالية جداً من التماثل هذه التجميعات البروتين. سنمر ماس يستغل هذه الميزة، كما أن جميع وحدات البروتين في تجميع هوموموليكولار نفس الهيكل المحلي وبالتالي تقريبا نفس سنمر التوقيع، الحد بشكل كبير إلى تعقيد التحليل.
بروتوكولا تتسم بكفاءة للدراسات الهيكلية للتجميعات البروتين الجزيئات بماس معتدلة (< 25 كيلو هرتز) سنمر يرد في هذا الفيديو، ويمكن تقسيمها إلى خطوات مختلفة (الشكل 1). وسوف نظهر المراحل الحرجة لسير العمل لدراسة هيكلية سنمر مثالاً على تجميع البروتينات الخيطية (انظر أبرز الخطوات في الشكل رقم 1)، باستثناء تنقية البروتين الوحيدات، مختلفة لكل بروتين الجمعية العامة ولكن من الأهمية الحاسمة للدراسات الهيكلية، ودون الخوض في التفاصيل التقنية/المنهجية سنمر حساب التحليل الطيفي، وهيكل لما البرامج التعليمية المتخصصة على شبكة الإنترنت. في حين أن هذا البروتوكول سوف تركز في المقام الأول على تجارب الرنين المغناطيسي النووي الصلبة المؤداة بموجب شروط ماس، الاستخدام محاذاة البيئات البيولوجية 23،24،،من2526 , 27، مثل محاذاة بيسيليس، تسمح للتحقيق في تشكيل البروتين والتفاعل البروتين البروتين الحيوي في وسائل الإعلام مثل الغشاء دون تكنولوجيا ماس. ونحن سوف تظهر تعبير البروتين وخطوات الجمعية، فضلا عن تسجيل الأطياف سنمر الحاسمة، والتحليل والتفسير. أن هدفنا تقديم رؤى في خط الأنابيب التحليل الهيكلي مما يتيح للقارئ لإجراء دراسة هيكلية الذرية قرار جمعية الجزيئات بتقنيات سنمر.
ويشمل البروتوكول 3 أقسام:
1-الحالة الصلبة إنتاج نموذج الرنين المغناطيسي النووي
شرطا مسبقاً لإجراء تحليل الرنين المغناطيسي النووي الصلبة، مكونات البروتين من الجزيئات الجمعية الحاجة إلى التعبير عن، المسماة النظائر والمنقاه وتجميعها في المختبر في الدولة معقدة مثل أصلي (بالنسبة مثال انظر الشكل 2) . مطلوب تخصيب النظائر في 13ج و 15ن وسم لضمان حساسية الرنين المغناطيسي عالية، من خلال استخدام وسائط التعبير البكتيرية الحد الأدنى تستكمل مع 13ج و 15ن المصادر، مثل شكل موحد 13 ج-يسمى الجلوكوز/الجلسرين و 15NH4Cl على التوالي. في مرحلة لاحقة من البروتوكول، بشكل انتقائي عينات المسمى ج 13المنتجة بشكل انتقائي 13ج-وصفت مصادر مثل (1، 3-13ج)-و (2-13ج)-الجلسرين (أو (1-13ج)-و (2-13ج)- الجلوكوز) وتستخدم لتسهيل تحليل الرنين المغناطيسي النووي. عينة المسمى مختلطة المقابلة لأن خليط اكويمولار أما من 50% 15N-و 50% 13ج المسمى أو 50% (1، 3-13ج)-و 50% (2-13ج)-يتم إدخال الجلوكوز لوصف الكشف عن الجزيئات التفاعلات. درجة عالية من النقاء البروتين، فضلا عن شروط صارمة أثناء الخطوة الجمعية هي العوامل الرئيسية لضمان نظام هيكلية متجانسة من العينة النهائية.
2-أولى توصيف الهيكلية استناداً إلى الحالة الصلبة الرنين المغناطيسي النووي أحادي البعد (1-د)
نحن نقدم هذه التجارب ضرورية لإجراء تحليل هيكلية التي سنمر. أحادي البعد (1-د) عبر الاستقطاب (CP) وعنبة/رينيبت28 التجارب، والكشف عن نواة 13ج تستخدم للكشف عن شرائح البروتين جامدة ومرنة في الجمعية العامة، على التوالي، وتقدير درجة الهيكلية التجانس وتعدد الأشكال المحلية (بالنسبة مثال انظر الشكل 3).
رونغ > 3. تحليل كونفورماشونال و 3D تصميم هيكل
قلق الفقرتين الفرعيتين 1 و 2 في التحليل كونفورماشونال، الذي يرتكز على إحالة جميع المخلفات الصلبة الجمعية البروتين، صدى سنمر التحولات الكيميائية هي تحقيقات حساسة جداً للبيئة المحلية، ويمكن استخدامها للتنبؤ phi/المبادرة زوايا زوجية وثم تحديد هيكل الثانوية. ويبين الشكل 4 مثال على مهمة الرنين متسلسلة في صلب جامد جمعية البروتين. تحديد هيكل 3D يستند إلى جمع البيانات الهيكلية مثل إغلاق قيود المسافة ترميز التقارب (< Å 7-9)، التي تتضمن على حد سواء داخل ومعلومات الجزيئات. تصف الفقرتان الفرعيتان 3 و 4 جمع النفس بعيدة المدى وتفسيرها. يتم تعريف اتصالات بعيدة المدى كالتقارب13ج إينتراموليكولار 13ج-الناجمة عن بقايا أنا إلى ياء، مع | i-ي | إيه فور، تحديد وبالتالي إضعاف البروتين العالي فرعية أحادي، أو ك الجزيئات 13ج-13ج التقارب، وتعريف الواجهات الجزيئات بين مفارز البروتين في الجمعية العامة. داخلها وواجهات الجزيئات موضحة في الشكل 5. الكشف عن القيود سنمر من خلال 13ج-13ج وترميز 15N-13ج ريكوبلينج التجارب عادة لمسافات إينتيرنوكليار < 1 نانومتر. ويوضح البند الفرعي 4 الكشف عن قيود المسافة الجزيئات. في التجميعات البروتين متناظرة، استخدام عينات البلوتينيوم المسمى (أي 100% شكل موحد أو بشكل انتقائي المسمى) لتحديد التفاعلات بين الجزيئات وحدة فرعية-فرعية محدودة، ككل داخل-وبينها-موليكولار اتصالات تؤدي إلى إشارات قابلة للاكتشاف. ويتحقق الكشف لا لبس فيه عن التقارب الجزيئات باستخدام عينات المسمى المختلطة، التي تحتوي على خليط مادة اكويمولار من عينتين مسماة بشكل مختلف، جنبا إلى جنب قبل التجميع. ويدخل الجزء الفرعي 5 بإيجاز النمذجة هيكل.
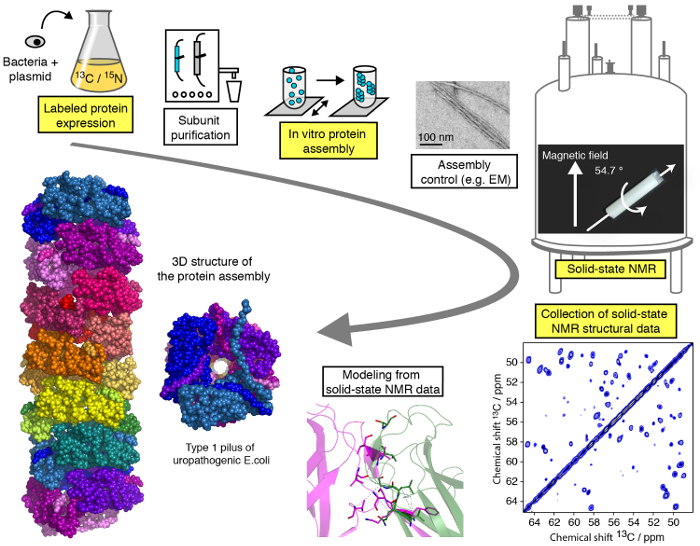
الشكل 1 : سير العمل دراسة الهيكلية الذرية القرار بالرنين المغناطيسي النووي الصلبة. 13 ج، 15ن النظائر المسمى إنتاج البروتين، تنقية وحدة فرعية، فرعية للجمعية العامة، والسيطرة على تشكيل الجمعية وسنمر التجارب وتحليل التجربة سنمر والاستخراج من قيود المسافة، وتظهر بنية النمذجة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
Representative Results
Discussion
الرنين المغناطيسي النووي الصلبة (سنمر) أسلوب الاختيار لوصف الجمعيات البروتين الجزيئات على مستوى الذري. واحدة من القضايا المركزية في تصميم هيكل على أساس سنمر هو نوعية الطيفية نظام التحقيق، الذي يسمح لإنشاء نماذج ثلاثية الأبعاد الهيكلية للدقة المختلفة، وعادة ما تتراوح بين نماذج ذات الدقة المنخفضة (التي تحتوي على الثانوية تنظيم العناصر والقليل من المعلومات 3D) لهياكل ثلاثية الأبعاد الذرية الزائفة. كمية ونوعية المعلومات الهيكلية المستخرجة من تجارب سنمر متعدد الأبعاد هو المفتاح لحساب هيكل الرنين المغناطيسي عالية الدقة للجمعية.
وصف البروتوكول يعتمد على الكشف عن 13ج-13ج و 15N-13ج الهيكلية القيود التي تتطلب تسجيل عدة أطياف 2D (وفي بعض الأحيان 3D) مع إشارة عالية للضوضاء. ترددات ماس معتدلة (< 25 كيلو هرتز)، يتم إدخال العينة في دوار مع أحجام من 3، 2-4 مم مما يسمح لكميات البروتين يصل إلى ~ 50 ملغ، تعتمد على ترطيب عينة. كمية العينة داخل الدوار طرديا مع نسبة الإشارة إلى الضوضاء في أطياف سنمر، عاملاً حاسما للكشف عن قيود المسافة البعيدة المدى وهذه الإحالة لا لبس فيها.
القرار الطيفية معلمة حاسمة أثناء التعيين الرنين متسلسلة وجمع القيود. للحصول على أفضل النتائج، تحتاج معلمات إعداد نموذج الأمثل، لا سيما في تنقية وحدة فرعية وشروط الجمعية (درجة الحموضة، المخزن المؤقت، والهز، درجة الحرارة، إلخ). للنموذج الأمثل، من المستحسن لتحضير عينات غير مسمى وقد لوحظ لعدة شروط متميزة للجمعية، وتسجيل د 1 1ح13ج CP طيف (كما هو موضح في الخطوة 2، 1) في كل عينة استعداد. خدمة الأطياف مقارنة الاستبانة الطيفية والتشتت بين الإعداد المختلفة، استناداً إلى الظروف المثلى التي يمكن تحديد.
نوعية البيانات سنمر يعتمد بشدة على الاختيار لبارامترات الرنين المغناطيسي النووي، خاصة بالنسبة لخطوات نقل الاستقطاب. استخدام قوة الحقل المغناطيسي عالية (إيه سيكس زيرو زيرو ميجاهرتز 1ح التردد) ضروري لحساسية عالية والاستبانة الطيفية، المطلوبة عند مواجهة الأهداف المعقدة مثل التجميعات البروتين الجزيئات.
عاملاً مقيداً في كثير من الحالات هو توافر مطياف. ولذلك، ينبغي أن تسبق اختيار العينات حكيم لإعداد الدورة مطياف. في أي حال، شكل موحد 13ج، 15عينة المسمى ن شرط مسبق لإجراء التعيين الرنين متسلسلة والمتبقية داخل. للحصول على البروتينات التي تم تعيينها باستخدام تقنيات الرنين المغناطيسي النووي الصلبة راجع71. يتطلب تصميم هيكل الجزيئات التجميعات ترددات ماس معتدلة بشكل انتقائي 13ج المسمى العينات؛ للكشف عن المدى 13ج-13ج و 13ج-15N الاتصالات عينات استناداً إلى 1، 3-13ج-و 2-13ج-جيلسيرول و/أو 1-13ج-و 2-13ج-الجلوكوز العلامات ويشيع استخدام، كما هو موضح أعلاه. الاختيار بين النظامين التوسيم يستند إلى نسبة الإشارة إلى الضوضاء الطيفية والقرار. للتمييز بين داخل والجزيئات الاتصالات البعيدة المدى، قد كشفت عن عينات المسمى والمخفف مختلطة كفاءة.
باختصار، خطوات حاسمة لدراسة هيكلية سنمر الذري: (ط) إعداد الوحدات الفرعية وحاجة الجمعية يكون الأمثل للحصول على عينة ممتازة كمية ونوعية، الحقل (ثانيا) مطياف القوة وحيازة المعلمات يجب أن تكون اختيرت بعناية؛ (ثالثا) استراتيجيات التوسيم انتقائية مطلوبة لتحديد هيكل ثلاثي الأبعاد، وكمية البيانات المطلوبة يعتمد على نوعية البيانات وتوافر البيانات التكميلية.
رغم انطباقها على طائفة واسعة من نظم supramolecular تتراوح بين بروتينات الغشاء هومومولتيميريك نانو-الكائنات، هو غالباً ما تكون محدودة سنمر بالحاجة إلى مغ-كميات المواد نظير مسماة. التطورات التكنولوجية الحديثة في سرعة فائقة سنمر ماس (إيه وان زيرو زيرو كيلو هرتز) تفتح السبيل إلى 1الرنين المغناطيسي الكشف عن ح، ودفع الحد الأقصى لكمية العينة الحد الأدنى إلى sub-مغ 72،،من7374. على الرغم من ذلك، هي عينات المسمى ج 13للدراسات الهيكلية التفصيلية ضرورية، مما يحد من تطبيق سنمر إلى عينات جمعت في المختبر أو إلى نظم المعرب عنها في الكائنات الحية التي البقاء على قيد الحياة في المتوسط الأدنى حيث في الخلية سنمر أسلوب ناشئة (للاطلاع انظر ملاحظات 75،،من7677،78).
هو عامل هام في تطبيق سنمر للحصول على هياكل ثلاثية الأبعاد ذات الدقة العالية الاستبانة الطيفية: التغاير conformational المضمنة في تجميع يمكن أن تحد من التحليل الطيفي القرار والأطياف. العلامات المحددة 13ج بقايا يمكن في بعض الحالات توفير بديل للحصول على معلومات المسافة المحددة على بقايا الاستراتيجي بغية الحصول على النماذج الهيكلية (بالنسبة الأخيرة أمثلة انظر 79،80).
سنمر لتصميم هيكل ثلاثي الأبعاد لا يزال يحتاج إلى جمع عدة مجموعات البيانات مع البيانات طويلة وكثيراً ما جمع الأوقات على أدوات متطورة، تبعاً للنهج والنظام عدة أيام إلى أسابيع 600-1000 ميغاهيرتز (تردد1ح) مطياف. ولذلك، يمكن الوصول إلى وقت مطياف عاملاً مقيداً في سنمر دراسة متعمقة.
وفي حالة الجمعيات البروتين هومومولتيميريك، مما أدى إلى البيانات سنمر من نوعية كافية لتحديد عدد كبير من القيود الهيكلية كما هو الحال في 3،57،،من6470, سنمر لا يزال يعطي لا الوصول إلى الأبعاد المجهرية. ولذلك، في تصميم هيكل سنمر حيثياته جمعية هومومولتيميريك، م أو الكتلة الواحدة طول البيانات (MPL) مثالي تكمل البيانات سنمر لاشتقاق المعلمات التماثل. وتوفر البيانات سنمر وحدها داخل الذري وواجهات الجزيئات
سنمر تكميلية عالية مع تقنيات الهيكلية مثل القياسات EM أو المكتبة ولكن يمكن أيضا تماما الجمع بين البيانات مع الهياكل الذرية التي حصل عليها علم البلورات بالأشعة السينية أو الرنين المغناطيسي النووي الحل على مفارز تحور أو مبتوراً. يمكن العثور على عدد متزايد من الدراسات في الأدب حيث سمح تزامن البيانات الهيكلية المختلفة لتحديد نماذج ثلاثية الأبعاد الذرية من الجزيئات الجمعيات (انظر الشكل 6 للأمثلة التمثيلية).
في ميدان “البيولوجيا الهيكلية”، سنمر يبرز كتقنية واعدة لدراسةغير قابلة للذوبان وغير البلورية التجميعات في الذرية المستوى، أي توفير هيكلية البيانات في الجدول الذري. وفي هذا الصدد، هو سنمر القلادة إلى حل الرنين المغناطيسي النووي وعلم البلورات بالأشعة السينية للتجميعات الجزيئي، بما في ذلك البروتينات الغشاء على جمعيات البيئة والبروتين الأصلي مثل مغلفات الفيروسية، وخيوط البكتيرية أو أميلويدس، فضلا عن الجيش الملكي النيبالي و الجيش الملكي النيبالي-البروتين المجمعات (انظر على سبيل المثال81). في تطبيقات متعدد الاستخدامات بدرجة في المختبر وفي سياق الخلوية، مثل تعقب التغييرات الهيكلية والثانوي والتعليم العالي ورباعي، تحديد الأسطح التفاعل مع جزيئات شريك في المقياس الذري (على سبيل المثال 82) و رسم الخرائط ديناميات الجزيئية في سياق مجمعات المجمعة، تشير إلى إمكانيات هامة سنمر في المستقبل دراسات الهيكلية على التجميعات الجزيئية البيولوجية المعقدة.
| المكون | M9 المتوسطة |
| كلوريد الصوديوم | 0.5 غرام/لتر |
| خ2ص4 | 3 غرام/لتر |
| غ2هبو4 | 6.7 غرام/لتر |
| مجسو4 | 1 مم |
| زنكل2 | 10 ميكرومتر |
| فيكل3 | 1 ميكرومتر |
| كاكل2 | 100 ميكرومتر |
| MEM فيتامين ميكس 100 X | 10 مل/لتر |
| 13 ج-الجلوكوز | 2 غرام/لتر |
| 15 NH4Cl | 1 غرام/لتر |
الجدول 1: تكوين التعبير أدنى متوسط للبروتين المؤتلف الإنتاج في كولاي الخلايا BL21-
Disclosures
The authors have nothing to disclose.
Acknowledgements
هذا العمل وتمول وكالة الاستخبارات الوطنية (13-بدك-0017-01 ووكالة الاستخبارات الوطنية-14-CE09-0020-01 للجامعة العربية)، وبرنامج “الاستثمار في المستقبل” أيدكس بوردو/يزار (2016 البارزة إلى) مرجع ANR-10-معرض أيدكس-03-02 إلى، المؤسسة من أجل البحوث لوس أنجليس (ميديكال FRM-AJE20140630090 للجامعة العربية)، برنامج FP7 (FP7-الناس-2013-CIG إلى أ. ل.) ومجلس البحوث الأوروبي (المنسق) ضمن أفق 2020 البحث والابتكار البرنامج الاتحاد الأوروبي في (منحة ابتداء من منسق الإغاثة الطارئة إلى الجامعة العربية، اتفاق لا 639020)، ومشروع ” ويكينتيراكت. “
Materials
| Instruments | |||
| NMR Spectrometer (> 11.7 Tesla) | Bruker | – | |
| triple resonance MAS SSNMR probehead | Bruker | – | |
| SSNMR rotors 4mm | Bruker | K1910 | |
| Centrifuge 5804 R | Eppendorf | 5805000629 | |
| GeneQuant 1300 spectrometer | Dutscher | 28-9182-13 | |
| IGS60 INCUBATEUR HERATHERM 75 L | Dutscher | 228001 | |
| MaxQ 4450 bench top orbital shaker | Dutscher | 78376 | |
| Tube Revolver Agitator | Dutscher | 79547 | |
| sonopuls HD 3100 | Bandelin | 3680 | |
| MicroPulser electroporator | Biorad | 165-2100 | |
| mini-PROTEAN tetra cell system | Biorad | 165-8000 | |
| AKTA pure system | GE Healthcare | 29-0182-24 | |
| capillary microman M25 pipet | Gilson | F148502 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| amiconR ultra-15 | sigma | Z740199-8EA | |
| capillaries and pistons | Gilson | F148112 | |
| spatula | Fisher | 13263799 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| D-glucose 13C6 | Sigma | 389374 | |
| Ammonium-15N-chloride | Sigma | 299251 | |
| 1,3 13C2 glycerol | Sigma | 492639 | |
| 2 13C glycerol | Sigma | 489484 | |
| Kanamycin | Sigma | K1876 | |
| Carbenicillin | Sigma | C3416 | |
| Sodium phosphate dibasic | Sigma | S7907 | |
| Potassium phosphate monobasic | Sigma | P5655 | |
| Sodium chloride | Sigma | 71380 | |
| calcium chloride | Sigma | C1016 | |
| Magnesium sulfate | Sigma | 208094 | |
| Iron Chloride | Sigma | 157740 | |
| Zinc chloride | Sigma | 793523 | |
| MEM Vitamin Solution (100×) | Sigma | M68954 | |
| IPTG | Fisher | BP1755 | |
| Trizma base | Sigma | T1503 | |
| Tricine | Sigma | T0377 | |
| SDS | Sigma | 436143 | |
| sodium azide | sigma | 71289 | |
| 4,4-dimethyl-4-silapentane-1-sulfonic acid | Sigma | 178837 | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Unicorn 6.3 | GE Healthcare | Akta systems | |
| ccpNMR | CCPN | spectrometer systems |
References
- Morag, O., Sgourakis, N. G., Baker, D., Goldbourt, A. The NMR-Rosetta capsid model of M13 bacteriophage reveals a quadrupled hydrophobic packing epitope. Proc Natl Acad Sci U S A. 112 (4), 971-976 (2015).
- Loquet, A., et al. Atomic model of the type III secretion system needle. Nature. 486 (7402), 276-279 (2012).
- Demers, J. P., et al. High-resolution structure of the Shigella type-III secretion needle by solid-state NMR and cryo-electron microscopy. Nat Commun. 5 (4976), (2014).
- Habenstein, B., et al. Hybrid Structure of the Type 1 Pilus of Uropathogenic Escherichia coli. Angew Chem Int Ed Engl. 54 (40), 11691-11695 (2015).
- Cady, S. D., et al. Structure of the amantadine binding site of influenza M2 proton channels in lipid bilayers. Nature. 463 (7281), 689-692 (2010).
- Park, S. H., et al. Structure of the chemokine receptor CXCR1 in phospholipid bilayers. Nature. 491 (7426), 779-783 (2012).
- Kaplan, M., et al. Probing a cell-embedded megadalton protein complex by DNP-supported solid-state NMR. Nat Methods. 12 (7), 649-652 (2015).
- Wang, S., et al. Solid-state NMR spectroscopy structure determination of a lipid-embedded heptahelical membrane protein. Nat Methods. 10 (10), 1007-1012 (2013).
- Daskalov, A., et al. Signal transduction by a fungal NOD-like receptor based on propagation of a prion amyloid fold. PLoS Biol. 13 (2), e1002059 (2015).
- Daskalov, A., et al. Identification of a novel cell death-inducing domain reveals that fungal amyloid-controlled cell death is related to necroptosis. Proc Natl Acad Sci U S A. , (2016).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nat Rev Mol Cell Biol. 15 (6), 384-396 (2014).
- Aguzzi, A., Lakkaraju, A. K. Cell Biology of Prions and Prionoids: A Status Report. Trends Cell Biol. 26 (1), 40-51 (2016).
- Habenstein, B., Loquet, A. Solid-state NMR: An emerging technique in structural biology of self-assemblies. Biophys Chem. , (2015).
- Meier, B. H., Bockmann, A. The structure of fibrils from ‘misfolded’ proteins. Curr Opin Struct Biol. 30, 43-49 (2015).
- Miao, Y., Cross, T. A. Solid state NMR and protein-protein interactions in membranes. Curr Opin Struct Biol. 23 (6), 919-928 (2013).
- Tang, M., Comellas, G., Rienstra, C. M. Advanced solid-state NMR approaches for structure determination of membrane proteins and amyloid fibrils. Acc Chem Res. 46 (9), 2080-2088 (2013).
- Weingarth, M., Baldus, M. Solid-state NMR-based approaches for supramolecular structure elucidation. Acc Chem Res. 46 (9), 2037-2046 (2013).
- Loquet, A., Habenstein, B., Lange, A. Structural investigations of molecular machines by solid-state NMR. Acc Chem Res. 46 (9), 2070-2079 (2013).
- Yan, S., Suiter, C. L., Hou, G., Zhang, H., Polenova, T. Probing structure and dynamics of protein assemblies by magic angle spinning NMR spectroscopy. Acc Chem Res. 46 (9), 2047-2058 (2013).
- Tycko, R., Wickner, R. B. Molecular structures of amyloid and prion fibrils: consensus versus controversy. Acc Chem Res. 46 (7), 1487-1496 (2013).
- Hong, M., Zhang, Y., Hu, F. Membrane protein structure and dynamics from NMR spectroscopy. Annu Rev Phys Chem. 63, 1-24 (2012).
- Jelinek, R., Ramamoorthy, A., Opella, S. J. High-Resolution Three-Dimensional Solid-state NMR Spectroscopy of a Uniformly 15N-Labeled Protein. J Am Chem Soc. 117, 12348-12349 (1995).
- Xu, J., et al. Bicelle-enabled structural studies on a membrane-associated cytochrome B5 by solid-state MAS NMR spectroscopy. Angew Chem Int Ed Engl. 47 (41), 7864-7867 (2008).
- Durr, U. H., Gildenberg, M., Ramamoorthy, A. The magic of bicelles lights up membrane protein structure. Chem Rev. 112 (11), 6054-6074 (2012).
- Yamamoto, K., et al. Probing the transmembrane structure and topology of microsomal cytochrome-p450 by solid-state NMR on temperature-resistant bicelles. Sci Rep. 3, 2556 (2013).
- Huang, R., et al. Probing the transmembrane structure and dynamics of microsomal NADPH-cytochrome P450 oxidoreductase by solid-state NMR. Biophys J. 106 (10), 2126-2133 (2014).
- Durr, U. H., Yamamoto, K., Im, S. C., Waskell, L., Ramamoorthy, A. Solid-state NMR reveals structural and dynamical properties of a membrane-anchored electron-carrier protein, cytochrome b5. J Am Chem Soc. 129 (21), 6670-6671 (2007).
- Hong, M. Determination of multiple phi-torsion angles in proteins by selective and extensive (13)C labeling and two-dimensional solid-state NMR. J Magn Reson. 139 (2), 389-401 (1999).
- Lundstrom, P., et al. Fractional 13C enrichment of isolated carbons using [1-13C]- or [2- 13C]-glucose facilitates the accurate measurement of dynamics at backbone Calpha and side-chain methyl positions in proteins. J Biomol NMR. 38 (3), 199-212 (2007).
- Loquet, A., Lv, G., Giller, K., Becker, S., Lange, A. 13C spin dilution for simplified and complete solid-state NMR resonance assignment of insoluble biological assemblies. J Am Chem Soc. 133 (13), 4722-4725 (2011).
- Castellani, F., et al. Structure of a protein determined by solid-state magic-angle-spinning NMR spectroscopy. Nature. 420 (6911), 98-102 (2002).
- Higman, V. A., et al. Assigning large proteins in the solid state: a MAS NMR resonance assignment strategy using selectively and extensively 13C-labelled proteins. J Biomol NMR. 44 (4), 245-260 (2009).
- Bockmann, A., et al. Characterization of different water pools in solid-state NMR protein samples. J Biomol NMR. 45 (3), 319-327 (2009).
- Cavanagh, J., Fairbrother, W. J., Palmer, A. G., Skelton, N. J. . Protein NMR spectroscopy, principles and practice. , (1996).
- Hartman, S. R., Hahn, E. L. Nuclear Double Resonance in the Rotating Frame. Phys Rev. 128 (5), 2042-2053 (1962).
- Harris, R. K., et al. Further conventions for NMR shielding and chemical shifts IUPAC recommendations 2008. Solid State Nucl Magn Reson. 33 (3), 41-56 (2008).
- Wang, Y., Jardetzky, O. Probability-based protein secondary structure identification using combined NMR chemical-shift data. Protein Sci. 11 (4), 852-861 (2002).
- Shaka, A. J., Baker, P. B., Freeman, R. Computer-Optimized Scheme for Wideband Applications and Low-Level Operation. J Magn Reson. 64, 547-552 (1985).
- Szeverenyi, N. M., Sullivan, M. J., Maciel, G. E. Observation of Spin Exchange by Two-Dimensional Fourier-Transform C-13 Cross Polarization-Magic-Angle Spinning. J Magn Reson. 47, 462-475 (1982).
- Baldus, M., Petkova, A. T., Herzfeld, J., Griffin, R. G. Cross polarization in the tilted frame: assignment and spectral simplification in heteronuclear spin systems. Mol Phys. 95 (5), 1197-1207 (1998).
- Verel, R., Ernst, M., Meier, B. H. Adiabatic dipolar recoupling in solid-state NMR: the DREAM scheme. J Magn Reson. 150 (1), 81-99 (2001).
- . Sparky – NMR Assignment and Integration Software Available from: https://www.cgl.ucsf.edu/home/sparky/ (2017)
- Luca, S., et al. Secondary chemical shifts in immobilized peptides and proteins: a qualitative basis for structure refinement under magic angle spinning. J Biomol NMR. 20 (4), 325-331 (2001).
- Shen, Y., Bax, A. SPARTA+: a modest improvement in empirical NMR chemical shift prediction by means of an artificial neural network. J Biomol NMR. 48 (1), 13-22 (2010).
- Berjanskii, M. V., Neal, S., Wishart, D. S. PREDITOR: a web server for predicting protein torsion angle restraints. Nucleic Acids Res. 34 (Web Server issue), W63-W69 (2006).
- Bardiaux, B., Malliavin, T., Nilges, M. ARIA for solution and solid-state NMR. Methods Mol Biol. 831, 453-483 (2012).
- Guerry, P., Herrmann, T. Comprehensive automation for NMR structure determination of proteins. Methods Mol Biol. 831, 429-451 (2012).
- Vasa, S., et al. beta-Helical architecture of cytoskeletal bactofilin filaments revealed by solid-state NMR. Proc Natl Acad Sci U S A. 112 (2), E127-E136 (2015).
- He, L., et al. Structure determination of helical filaments by solid-state NMR spectroscopy. Proc Natl Acad Sci U S A. 113 (3), E272-E281 (2016).
- Tang, M., et al. High-resolution membrane protein structure by joint calculations with solid-state NMR and X-ray experimental data. J Biomol NMR. 51 (3), 227-233 (2011).
- Paravastu, A. K., Leapman, R. D., Yau, W. M., Tycko, R. Molecular structural basis for polymorphism in Alzheimer’s beta-amyloid fibrils. Proc Natl Acad Sci U S A. 105 (47), 18349-18354 (2008).
- Schutz, A. K., et al. Atomic-resolution three-dimensional structure of amyloid beta fibrils bearing the Osaka mutation. Angew Chem Int Ed Engl. 54 (1), 331-335 (2015).
- Sgourakis, N. G., Yau, W. M., Qiang, W. Modeling an in-register, parallel "iowa" abeta fibril structure using solid-state NMR data from labeled samples with rosetta. Structure. 23 (1), 216-227 (2015).
- Lewandowski, J. R., De Paepe, G., Griffin, R. G. Proton assisted insensitive nuclei cross polarization. J Am Chem Soc. 129 (4), 728-729 (2007).
- Carlon, A., et al. How to tackle protein structural data from solution and solid state: An integrated approach. Prog Nucl Magn Reson Spectrosc. 92-93, 54-70 (2016).
- Judge, P. J., Taylor, G. F., Dannatt, H. R., Watts, A. Solid-state nuclear magnetic resonance spectroscopy for membrane protein structure determination. Methods Mol Biol. 1261, 331-347 (2015).
- Wang, S., Ladizhansky, V. Recent advances in magic angle spinning solid state NMR of membrane proteins. Prog Nucl Magn Reson Spectrosc. 82, 1-26 (2014).
- Sborgi, L., et al. Structure and assembly of the mouse ASC inflammasome by combined NMR spectroscopy and cryo-electron microscopy. Proc Natl Acad Sci U S A. 112 (43), 13237-13242 (2015).
- Loquet, A., et al. Atomic structure and handedness of the building block of a biological assembly. J Am Chem Soc. 135 (51), 19135-19138 (2013).
- Walti, M. A., et al. Atomic-resolution structure of a disease-relevant Abeta(1-42) amyloid fibril. Proc Natl Acad Sci U S A. 113 (34), E4976-E4984 (2016).
- Colvin, M. T., et al. Atomic Resolution Structure of Monomorphic Abeta42 Amyloid Fibrils. J Am Chem Soc. 138 (30), 9663-9674 (2016).
- Xiao, Y., et al. Abeta(1-42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer’s disease. Nat Struct Mol Biol. 22 (6), 499-505 (2015).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human alpha-synuclein. Nat Struct Mol Biol. 23 (5), 409-415 (2016).
- Wasmer, C., et al. Amyloid fibrils of the HET-s(218-289) prion form a beta solenoid with a triangular hydrophobic core. Science. 319 (5869), 1523-1526 (2008).
- Van Melckebeke, H., et al. Atomic-resolution three-dimensional structure of HET-s(218-289) amyloid fibrils by solid-state NMR spectroscopy. J Am Chem Soc. 132 (39), 13765-13775 (2010).
- Lamley, J. M., et al. Solid-state NMR of a protein in a precipitated complex with a full-length antibody. J Am Chem Soc. 136 (48), 16800-16806 (2014).
- Agarwal, V., et al. De novo 3D structure determination from sub-milligram protein samples by solid-state 100 kHz MAS NMR spectroscopy. Angew Chem Int Ed Engl. 53 (45), 12253-12256 (2014).
- Stanek, J., et al. NMR Spectroscopic Assignment of Backbone and Side-Chain Protons in Fully Protonated Proteins: Microcrystals, Sedimented Assemblies, and Amyloid Fibrils. Angew Chem Int Ed Engl. 55 (50), 15504-15509 (2016).
- Baker, L. A., Baldus, M. Characterization of membrane protein function by solid-state NMR spectroscopy. Curr Opin Struct Biol. 27, 48-55 (2014).
- Luchinat, E., Banci, L. In-cell NMR: a topical review. IUCrJ. 4 (Pt 2), 108-118 (2017).
- Freedberg, D. I., Selenko, P. Live cell NMR. Annu Rev Biophys. 43, 171-192 (2014).
- Selenko, P., Wagner, G. Looking into live cells with in-cell NMR spectroscopy. J Struct Biol. 158 (2), 244-253 (2007).
- Qiang, W., Yau, W. M., Luo, Y., Mattson, M. P., Tycko, R. Antiparallel beta-sheet architecture in Iowa-mutant beta-amyloid fibrils. Proc Natl Acad Sci U S A. 109 (12), 4443-4448 (2012).
- Bateman, D. A., Tycko, R., Wickner, R. B. Experimentally derived structural constraints for amyloid fibrils of wild-type transthyretin. Biophys J. 101 (10), 2485-2492 (2011).
- Marchanka, A., Simon, B., Althoff-Ospelt, G., Carlomagno, T. RNA structure determination by solid-state NMR spectroscopy. Nat Commun. 6, 7024 (2015).
- Schutz, A. K., et al. The amyloid-Congo red interface at atomic resolution. Angew Chem Int Ed Engl. 50 (26), 5956-5960 (2011).

