L'effet de la liaison chimique interfaciale dans le TiO<sub> 2</sub> -SiO<sub> 2</sub> Composites sur leur performance de réduction des NOx photocatalytiques
Summary
L'objectif du présent travail est d'établir des moyens de générer et de quantifier les niveaux de liaisons Ti-O-Si et de les corréler avec les propriétés photocatalytiques du TiO 2 supporté.
Abstract
La liaison chimique des photocatalyseurs particulaires aux surfaces de matériaux de support revêt une grande importance dans l'ingénierie de structures photocatalytiques plus efficaces et plus pratiques. Cependant, l'influence d'une telle liaison chimique sur les propriétés optiques et superficielles du photocatalyseur et donc son comportement photocatalytique / sélectivité de réaction n'a pas été systématiquement étudiée. Dans cette étude, le TiO 2 a été supporté à la surface de SiO 2 au moyen de deux méthodes différentes: (i) par la formation in situ de TiO 2 en présence de quartz de sable par un procédé sol-gel utilisant du tétrabutyl orthotitanium (TBOT ); Et (ii) en liant la poudre TiO 2 commerciale au quartz sur une couche de gel de silice de surface formée à partir de la réaction du quartz avec l'orthosilicate de tétraéthyle (TEOS). A titre de comparaison, des nanoparticules de TiO 2 ont également été déposées sur les surfaces d'un SiO 2 plus réactif préparé par unLa technique de sol-gel contrôlée par hydrolyse ainsi que par une voie sol-gel à partir de précurseurs de TiO 2 et de SiO 2 . La combinaison du TiO 2 et du SiO 2 , grâce aux liaisons Ti-O-Si interfaciales, a été confirmée par la spectroscopie FTIR et les activités photocatalytiques des composites obtenues ont été testées pour la dégradation photocatalytique du NO selon la méthode ISO standard (ISO 22197-1) . Les images du microscope électronique des matériaux obtenus ont montré que la couverture variable du photocatalyseur de la surface de support peut être réalisée avec succès, mais l'activité photocatalytique vis-à-vis de l'élimination du NO a été affectée par la méthode de préparation et la sélectivité des nitrates est affectée négativement par Ti-O-Si Liaison.
Introduction
Les structures en béton sont omniprésentes dans notre société. Typiquement associés à nos centres urbains, leur surface importante représente une interface importante avec l'atmosphère urbaine 1 , 2 . Les préoccupations croissantes concernant les impacts économiques et sanitaires de la qualité de l'air urbain en détérioration sont une occasion importante pour l'assainissement atmosphérique. Les photocatalyseurs à base de TiO 2 ont été utilisés pendant un certain temps dans l'assainissement de l'air contaminé par les NOx et leur appui sur ces structures en béton à haute surface permet de concrétiser les fonctionnalités supplémentaires précédemment associées aux matériaux photocatalytiques: (i) nettoyage facile, matériaux Qui lient la saleté aux surfaces sont dégradées photocatalytiquement, ce qui permet à la saleté de se laver aisément avec de l'eau de pluie 3 ; (Ii) hydrophilie photo-induite, qui renforce également l'effet autonettoyant 3; Et (iii) la purification de l'atmosphère urbaine aujourd'hui, est généralement polluée par les émissions des véhicules à des niveaux qui dépassent de manière significative les niveaux maximaux autorisés, en particulier en ce qui concerne les NOx 4 . Le TiO 2 est le photocatalyseur le plus couramment utilisé dans les applications environnementales en raison de sa stabilité chimique, de son prix relativement bas, de son activité photocatalytique élevée et, plus important encore, de son éco-sécurité, comme l'indiquent les données toxicologiques TiO 2 actuellement disponibles 5 .
Les bétons photocatalytiques ont déjà démontré leur potentiel d'assainissement atmosphérique sur les sites d'essai en Europe et ailleurs. De nombreuses études sur les matériaux cimentiques photocatalytiques au cours des deux dernières décennies ont principalement porté sur l'activité du catalyseur, souvent exprimée en termes de réduction de concentration de NOx 1 , 6 , 7 <sup>, 8 , 9 . Cependant, l'activité seule est un indicateur insuffisant de l'efficacité photocatalytique. Une réduction de la concentration en NOx, définie comme la somme des concentrations des oxydes d'azote atmosphérique, ne représente pas par elle-même un impact utile sur la qualité de l'air car les toxicités relatives des gaz constitutifs ne sont pas équivalentes 10 .
L'oxydation photocatalytique des gaz NOx suit l'ordre
NO → HONO → NO 2 → HONO 2 (NO 3 – )
La toxicité plus élevée du NO 2 par rapport au NO (par un facteur conservateur de 3 10 ) signifie que la conversion oxydante du NO par le nitrate ( c'est -à- dire la sélectivité des nitrates ) doit être optimisée. En conséquence, les moyens d'offrir à la fois des activités élevées et des nitrates élevés Les sélectivités doivent être ciblées.
En ce qui concerne la catalyse en général, des surfaces élevées sont nécessaires pour l'adsorption des molécules réactives. Le TiO 2 nanoparticulé assure la surface spécifique élevée requise pour une activité photocatalytique élevée, à condition que les particules soient dispersées de manière adéquate 9 . Cependant, lorsqu'il est appliqué à des bétons en mélangeant dans le liant de ciment, une agglomération peut se produire, en réduisant la surface effective et les réactions d'hydratation du ciment peuvent conduire à une occlusion de photocatalyseur, réduisant ainsi la surface de surface accessible et bloquant le catalyseur de l'activation de la lumière du soleil 1 , 11 .
Des performances significativement améliorées peuvent donc être attendues lorsque la surface de surface du catalyseur accessible est mieux conservée dans des structures photocatalytiques plus efficaces. Ceux-ci incluent des catalyseurs supportés sur des granulats exposés à la surface de béton et dans des structures de zéoliteAss = "xref"> 2 , 12 . La durabilité de ces structures dépend beaucoup de la façon dont le catalyseur est bien lié aux différents supports. Les avantages de la liaison chimique du TiO 2 aux substrats ont souvent été mentionnés dans la littérature 8 , 13 mais les moyens de caractériser le degré de liaison ont été ambigus. Néanmoins, l'intégrité d'une liaison chimique par rapport à une attraction physique est l'occasion de développer des structures robustes à la surface du béton. Cependant, l'influence d'une liaison chimique entre TiO 2 et un substrat, par exemple le quartz, pour fournir une liaison Ti-O-Si, sur les propriétés optiques et photocatalytiques du TiO 2 supporté n'a pas encore été étudiée. Par conséquent, l'objectif du présent travail a été d'établir des moyens de générer et de quantifier les niveaux de liaisons Ti-O-Si et de les corréler avec le photocatalytiquePropriétés du TiO 2 supporté. A cet effet, le TiO 2 commercial et synthétisé a été collé, par différentes méthodes, sur du sable de SiO 2 de quartz (Q, comme exemple simple d'un agrégat).
Protocol
Representative Results
Discussion
La figure 8 montre des différences assez significatives entre les efficacités photoniques NO pour chacun des matériaux photocatalytiques. Les avantages de soutenir le photocatalyseur pour augmenter l'accessibilité à la surface réactive sont maintenant bien établis et il convient de noter la différence entre les rendements photoniques pour l'oxydation des NO mesurés pour PC105 et pour PC105 supportés sur quartz traité (QT2). Ξ NO (QT2) a été mesuré à 73% de celui pour PC105, mais QT2 n'avait que 6,5% du chargement de TiO 2 . De toute évidence, les améliorations de l'activité sont significatives sur les systèmes supportés, mais il faut s'occuper de l'interprétation des mesures avec des différences morphologiques significatives.
Une caractéristique clé du système de test photocatalytique qui peut s'attendre à influencer la mesure est la texture de surface de l'échantillon supporté dans le réacteur photocatalyseur. Cela influence la surface efficace. Le calculDe ξ comprend un terme de zone, mais il s'agit d'une zone d'illumination bidimensionnelle définie par le support d'échantillon de réacteur. La distribution granulométrique des poudres de TiO 2 , à savoir PC105, T1 et T2, est très différente des composites, où TiO 2 'poudre' est supporté sur SiO 2 de diamètre dans la plage de 0,4 à 50 μm. Cela signifie que les textures de surface du photocatalyseur sont assez variables et devraient influencer l'efficacité photonique déclarée. Cela influence également les caractéristiques des écoulements du réacteur. Plus la texture est rugueuse, en raison des caractéristiques d'emballage, plus le système de flux laminaire requis est perturbé. On s'attend à ce que cela influence les taux de diffusion de la molécule de gaz en surface et par conséquent la mesure de l'efficacité photonique.
En conséquence de ces effets, la comparaison la plus utile des types de photocatalyseurs doit être basée sur les propriétés dérivées des mesures sur les catalyseurs individuels. Dans cette étude,La sélectivité des nitrates, basée sur ξ NO et ξ NO 2 (équation 10), toutes deux mesurées sur le même échantillon sont utilisées lors de la discussion ultérieure.
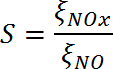 (dix)
(dix)
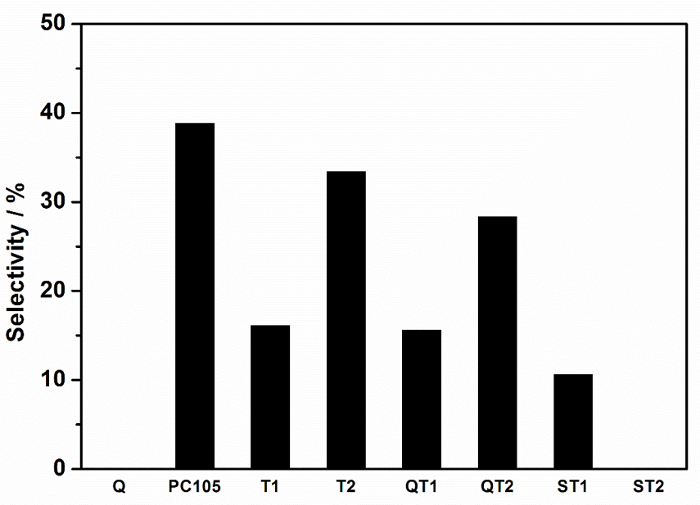
Figure 9: sélectivité vers l'élimination totale des NOx, c'est -à- dire la sélectivité des nitrates, enregistrée pour différentes poudres composites TiO 2 et TiO 2 -SiO 2 . Les systèmes directement comparables sont identifiés avec les mêmes symboles, les paires supportées contre les paires non supportées. Cliquez ici pour voir une version plus grande de ce chiffre.
Les facteurs qui contrôlent la sélectivité des nitrates semblent être des variables complexes et pertinentes inclusLe polymorphisme de TiO 2 , l'état des défauts, la disponibilité de l'eau, etc. 7 , mais le rôle de la liaison du substrat, souvent considéré comme avantageux pour les performances photocatalytiques, peut maintenant être considéré. Il est donc utile de discuter des différences de sélectivité des nitrates entre les systèmes non collés et liés, c'est-à-dire photocatalyseur autonome contre les composites de support de photocatalyseur, par exemple PC105 vs QT2; Où QT2 représente PC105 supporté dans un revêtement de silicate sur quartz. Ces différences de sélectivité des nitrates sont résumées dans le tableau 1 .
| Photocatalyseur | Photocatalyseur | DSelectivité (%); (Réduction de la sélectivité relative (%)) | Ratio de surface de pic FTIR; (Ti-O-Si) / SiO2 | Ti-O-Si peCentre ak (cm -1 ) |
| PC105 | QT2 | (38,8-28,3) = 10,5; (-27) | 0,0088 | 960 |
| T1 | ST1 | (16.0-10.6) = 5.4; (-34) | 0,0184 | 960 |
| T2 | ST2 | (33,4-0) = 33,4; (-100) | 0.6566 | 920 |
| T1 | QT1 | (16,0-15,6) = 0,4; (-3) | 0,0014 | 930 |
Tableau 1: Influence de la formation composite et du collage Ti-O-Si sur la performance des photocatalyseurs. Les zones de pointe de FTIR corrigées en arrière-plan pour les pics affectés à Ti-O-Si (920-960 cm -1 ) et pour SiO 2 (990-1230 cm -1 ) ont été obtenues à partir de la Figure 5 en utilisant le logiciel Origin Peak Analyze. La zone sans dimension rAtio indiqué dans le tableau 1 est pris comme une mesure du degré de liaison Ti-O-Si dans les systèmes composites. Les positions de centre de pic associées à la liaison Ti-O-Si sont également indiquées. Ces données sont résumées à la figure 10 .
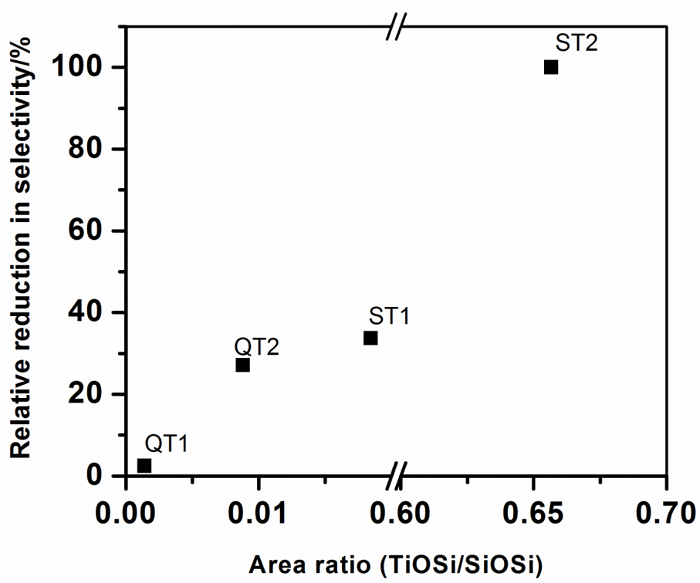
Figure 10: Réduction relative de la sélectivité des nitrates pour différents matériaux de TiO 2 combinés avec du SiO 2 en fonction de la liaison de Ti-O-Si dans les composites de support de photocatalyseur. Cliquez ici pour voir une version plus grande de ce chiffre.
La plus grande réduction de la sélectivité sur la formation composite, c'est-à – dire celle qui montrerait le plus grand impact négatif sur la qualité de l'air ambiant, est indiquée pour le photocatalyseur T2 lorsqu'il est combinéAvec un précurseur de silicate. Un gel hautement dispersé est produit dans lequel les liaisons Ti-O-Si sont maximisées. Les analyses de la zone de pointe indiquent qu'environ 65% en moles du TiO 2 est associé au SiO 2 par des liaisons Ti-O-Si, qui s'approche du rapport stoechiométrique TiO 2 : SiO 2 de la préparation (80%) et en assurant la confiance Analyse du ratio de surface du pic. Il est également à noter que le centre de pointe de Ti-O-Si est situé au plus petit nombre d'onde observé pour les composites et suggère que l'information de composition peut être intégrée dans les caractéristiques de pointe de Ti-O-Si. Tous les autres composites affichent des rapports de surface de pic considérablement inférieurs (Ti-O-Si) / SiO 2 , indiquant des niveaux inférieurs de liaison Ti-O-Si. La figure 10 montre que ce niveau de liaison est corrélé avec la sélectivité, exprimée en pourcentage de réduction de la sélectivité libre du catalyseur, ce qui indique que la liaison Ti-O-Si a un impact négatif sur la réduction des NOx photocatalytiques.
Les conséquences de ces résultats sont qu'un compromis doit être respecté pour assurer la durabilité physique d'un système collé sans perte significative de performance photocatalytique. Les approches possibles pourraient inclure: (i) l'augmentation de la taille de particule TiO 2 supportée de sorte que la liaison Ti-O-Ti bénéfique, qui définit les propriétés photocatalytiques intrinsèques des photocatalyseurs "autonomes", ne soit pas diluée par le Ti-O-Si Des liaisons et / ou (ii) l'ingénierie d'un enduit de surface mince, poreux et durable pour le substrat de sorte que le photocatalyseur soit piégé dans des pores accessibles aux molécules de gaz réactifs et à l'éclairage.
La silice sous forme de sable de quartz ou de sphères de silice réactives a été modifiée avec succès avec du TiO 2 soit via un photocatalyseur commercial TiO 2 commercial (PC105), en utilisant un liant à base de silicate ou par les réactions d'hydrolyse-condensation de différents précurseurs de Ti. Le photocatalytiC des composites résultantes a été comparée à celle d'un système d'oxyde mixte dérivé de sol-gel favorisant des niveaux élevés de liaisons de liaison Ti-O-Si. Les résultats clés montrent que: (i) le degré de liaison de TiO 2 -SiO 2 dans la préparation d'oxyde mixte est élevé (65%) comme prévu et s'approche du rapport stoechiométrique TiO 2 : SiO 2 dans la préparation. Ce système de gel composite n'a montré aucune sélectivité en nitrate par rapport au TiO 2 (T2) dérivé de sol-gel comparable qui a montré une sélectivité de 33%, (ii) à mesure que la réactivité de la surface du silicate diminue, le degré de liaison de Ti-O-Si Réduit; L'ordre est des sels de silice réactifs (ST1)> couche de gel de silicate sur quartz (QT2)> quartz nu, et (iii) la sélectivité en nitrate de TiO 2 est affectée par le taux de liaison Ti-O-Si.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs reconnaissent avec reconnaissance le financement du Conseil de recherches en ingénierie et en sciences physiques du Royaume-Uni (Grant Ref: EP / M003299 / 1) et le Projet de recherche conjointe international (EPSRC-NSFC) de Natural Science Foundation of China (n ° 51461135005).
Materials
| quartz | Aldrich | 31623 | |
| tetrabutylorthotitania (TBOT) | Aldrich | 244112 | |
| ethanol | Aldrich | absolute alcohol | |
| hydrochloric acid | Aldrich | ||
| deionised water | 18.2 MWΩ.cm | ||
| seives | Endecott | ||
| tetraethylorthosilicate (TEOS) | Aldrich | 86578 | |
| PC105 (TiO2) | Cristal Global | ||
| ammonia solution | Aldrich | ||
| titanium tetraisopropoxide (TTIP) | Aldrich | 87560 | |
| barium sulphate | Aldrich | ||
| NO in N2 | BOC | 100 ppm | |
| FTIR spectrophotometer | Perkin Elmer | Spectrum Two | equipped with UATR |
| X-ray diffractometer | PAN analytical | X'Pert3 Powder | equipped with a CuKa1 1.54 Å X-ray source |
| Scanning electron microscope | ISI | ABT55 | ED X-ray analyser and Link Analytical BSE detector |
| Transmission electron microscope | Jeol | JEM-2000EX | utilising a Gatan Erlangshen ES500W camera |
| UV-vis diffuse reflectance spectrophotometer | Agilent Technology | Cary 60 | |
| Mass flow controllers | Bronkhorst | ||
| Humidity monitor | Rotronic | Hygropalm | |
| Solar simulator | Sciencetech | SS0.5kW | 1.5 AM filter used |
| Broadband thermopile detector | Gentec EO | XLP12-3S-H2-D0 | |
| NOx analyser | Air Monitors Ltd | Thermo Scientific Model 42i-HL |
References
- Folli, A., et al. Understanding TiO2 Surface Chemistry to Control and Modulate Photocatalytic Performances. J Am Ceram Soc. 93 (10), 3360-3369 (2010).
- Wang, F. Z., Yang, L., Sun, G. X., Guan, L. Y., Hu, S. G. The Hierarchical Porous Structure of Substrate Enhanced Photocatalytic Activity of TiO2/Cementitious Materials. Constr Build Mater. 64, 488-495 (2014).
- Fateh, R., Dillert, R., Bahnemann, D. Preparation and Characterization of Transparent Hydrophilic Photocatalytic TiO2/SiO2 Thin Films on Polycarbonate. Langmuir. 29 (11), 3730-3739 (2013).
- Dillert, R., Engel, A., Grosse, J., Lindner, P., Bahnemann, D. W. Light Intensity Dependence of the Kinetics of the Photocatalytic Oxidation of Nitrogen(II) Oxide at the Surface of TiO2. Phys Chem Chem Phys. 15, 20876-20886 (2013).
- Shi, H. B., Magaye, R., Castranova, V., Zhao, J. S. Titanium Dioxide Nanoparticles: A Review of Current Toxicological Data. Part Fibre Toxicol. 10, (2013).
- Freitag, J., et al. Nitrogen(II) Oxide Charge Transfer Complexes on TiO2: A New Source for Visible-Light Activity. J Phys Chem C. 119 (9), 4488-4501 (2015).
- Ma, J. Z., Wu, H. M., Liu, Y. C., He, H. Photocatalytic Removal of NOx over Visible Light Responsive Oxygen-Deficient TiO2. J Phys Chem C. 118 (14), 7434-7441 (2014).
- Mendoza, C., Valle, A., Castellote, M., Bahamonde, A., Faraldos, M. TiO2 and TiO2-SiO2 Coated Cement: Comparison of Mechanic and Photocatalytic Properties. Appl Catal B-Environ. 178, 155-164 (2015).
- Kamaruddin, S., Stephan, D. Sol-gel Mediated Coating and Characterization of Photocatalytic Sand and Fumed Silica for Environmental Remediation. Water Air Soil Poll. 225, 1948 (2014).
- Bloh, J. Z., Folli, A., Macphee, D. E. Photocatalytic NOx Abatement: Why the Selectivity Matters. Rsc Adv. 4, (2014).
- Macphee, D. E., Folli, A. Photocatalytic Concretes – the Interface Between Photocatalysis and Cement Chemistry. Cement Concrete Res. 85, 48-54 (2016).
- Yang, L., et al. The Influence of Zeolites Fly Ash Bead/TiO2 Composite Material Surface Morphologies on Their Adsorption and Photocatalytic Performance. Appl Surf Sci. 392, 687-696 (2017).
- Pinho, L., Elhaddad, F., Facio, D. S., Mosquera, M. J. A Novel TiO2-SiO2 Nanocomposite Converts a Very Friable Stone into a Self-Cleaning Building Material. Appl Surf Sci. 275, 389-396 (2013).
- Stöber, W., Fink, A., Bohn, E. Controlled Growth of Monodisperse Silica Spheres in Micron Size Range. J Colloid Interf Sci. 26 (1), 62-69 (1968).
- Yamashita, H., et al. Characterization of Titanium-Silicon Binary Oxide Catalysts Prepared by the Sol-Gel Method and Their Photocatalytic Reactivity for The Liquid-Phase Oxidation of 1-Octanol. J Phys Chem B. 102 (30), 5870-5875 (1998).
- Tokarský, J., et al. A Low-Cost Photoactive Composite Quartz Sand/TiO2. Chem Eng J. 222, 488-497 (2013).
- Beranek, R., Kisch, H. Tuning the optical and photoelectrochemical properties of surface-modified TiO2. Photochem Photobiol Sci. 7 (1), 40-48 (2008).
- Kisch, H., Bahnemann, D. Best Practice in Photocatalysis: Comparing Rates or Apparent Quantum Yields?. J Phys Chem Lett. 6 (10), 1907-1910 (2015).

