Die Wirkung der interfacialen chemischen Bindung in TiO<sub> 2</sub> -SiO<sub> 2</sub> Verbundwerkstoffe über ihre photokatalytische NOx-Abfallleistung
Summary
Im Mittelpunkt der vorliegenden Arbeit steht die Etablierung von Mitteln zur Erzeugung und Quantifizierung von Ebenen von Ti-O-Si-Bindungen und deren Korrelation mit den photokatalytischen Eigenschaften des geträgerten TiO 2 .
Abstract
Die chemische Bindung von teilchenförmigen Photokatalysatoren an tragende Materialoberflächen ist bei der Konstruktion effizienter und praktischer photokatalytischer Strukturen von großer Bedeutung. Der Einfluss einer solchen chemischen Bindung auf die optischen und Oberflächeneigenschaften des Photokatalysators und damit dessen photokatalytisches Aktivitäts- / Reaktionsselektivitätsverhalten wurde jedoch nicht systematisch untersucht. In dieser Untersuchung wurde TiO 2 auf der Oberfläche von SiO 2 mittels zweier verschiedener Methoden unterstützt: (i) durch die in situ- Bildung von TiO 2 in Gegenwart von Sandquarz über ein Sol-Gel-Verfahren unter Verwendung von Tetrabutyl-orthotitan (TBOT ); Und (ii) durch Binden des handelsüblichen TiO 2 -Pulvers an Quarz auf einer aus der Reaktion von Quarz mit Tetraethylorthosilicat (TEOS) gebildeten Silicagelschicht. Zum Vergleich wurden auch TiO 2 -Nanopartikel auf den Oberflächen eines mehr reaktiven SiO 2, hergestellt durch a, abgeschiedenHydrolysegesteuerte Sol-Gel-Technik sowie durch einen Sol-Gel-Weg aus TiO 2 und SiO 2 -Vorläufern. Die Kombination von TiO 2 und SiO 2 durch Grenzflächen-Ti-O-Si-Bindungen wurde durch FTIR-Spektroskopie bestätigt und die photokatalytischen Aktivitäten der erhaltenen Verbundwerkstoffe wurden nach dem ISO-Standardverfahren (ISO 22197-1) auf den photokatalytischen Abbau von NO getestet, . Die Elektronenmikroskopbilder der erhaltenen Materialien zeigten, dass eine variable Photokatalysatorabdeckung der Trägeroberfläche erfolgreich erreicht werden kann, aber die photokatalytische Aktivität gegenüber der NO-Entfernung wurde durch das Herstellungsverfahren beeinflusst, und die Nitratselektivität wird durch Ti-O-Si nachteilig beeinflusst Bindung
Introduction
Konkrete Strukturen sind in unserer Gesellschaft allgegenwärtig. In der Regel mit unseren urbanen Zentren verbunden ist, ist ihre bedeutende Fläche eine wichtige Schnittstelle mit der städtischen Atmosphäre 1 , 2 . Mit zunehmender Besorgnis über die wirtschaftlichen und gesundheitlichen Auswirkungen der Verschlechterung der städtischen Luftqualität stellt diese Schnittstelle eine wichtige Chance für eine atmosphärische Sanierung dar. TiO 2 -basierte Photokatalysatoren werden seit einiger Zeit in der Sanierung von NOx-kontaminierter Luft eingesetzt, und ihre Unterstützung auf diesen Betonstrukturen mit hoher Oberfläche bietet Beton die zusätzliche Funktionalität, die zuvor mit photokatalytischen Materialien verbunden war: (i) einfaches Reinigen, wobei Materialien Die Schmutz an Oberflächen binden, werden photokatalytisch abgebaut, so dass Schmutz leicht mit Regenwasser abwaschen kann 3 ; (Ii) photoinduzierte Hydrophilie, die auch den Selbstreinigungseffekt verstärkt 3; Und (iii) die Reinigung der städtischen Atmosphäre, die heute typischerweise durch Emissionen von Fahrzeugen auf Niveaus verunreinigt wird, die die maximal zulässigen Werte, insbesondere in Bezug auf NOx 4 , deutlich übersteigen. TiO 2 ist der am häufigsten eingesetzte Photokatalysator in Umweltanwendungen aufgrund seiner chemischen Stabilität, seines relativ niedrigen Preises, seiner hohen photokatalytischen Aktivität und vor allem seiner Ökosicherheit, wie durch die derzeit verfügbaren TiO 2 -Toxikologie-Daten angedeutet 5 .
Photokatalytische Betone haben bereits ihr Potenzial für atmosphärische Sanierung an Versuchsstandorten in ganz Europa und anderswo gezeigt. Zahlreiche Untersuchungen an photokatalytischen zementhaltigen Materialien in den letzten zwei Jahrzehnten haben sich vorwiegend mit der Katalysatoraktivität befasst, oft ausgedrückt in Form der NOx-Konzentrationsreduktion 1 , 6 , 7 <sup>, 8 , 9 . Allerdings ist die Aktivität allein ein unzureichender Indikator für die photokatalytische Wirksamkeit. Eine Reduktion der NOx-Konzentration, definiert als Summe der Konzentrationen der atmosphärischen Stickoxide, stellt für sich genommen keine nützliche Auswirkung auf die Luftqualität dar, da die relativen Toxizitäten der konstituierenden Gase nicht gleich sind 10 .
Die photokatalytische Oxidation von NOx-Gasen folgt der Sequenz
NO → HONO → NO 2 → HONO 2 (NO 3 – )
Die höhere Toxizität von NO 2 im Vergleich zu NO (durch, konservativ ein Faktor von 3 10 ) bedeutet, dass die oxidative Umwandlung von NO bis Nitrat ( dh die Nitratselektivität ) maximiert werden muss. Folglich sind die Mittel, um sowohl hohe Aktivitäten als auch hohe Nitrat zu liefern Selektivitäten müssen gezielt sein.
Für die Katalyse im Allgemeinen sind hohe Oberflächenbereiche für die Adsorption von reagierenden Molekülen erforderlich. Nanopartikuläres TiO 2 sorgt für die hohe spezifische Oberfläche, die für eine hohe photokatalytische Aktivität erforderlich ist, wobei die Partikel ausreichend dispergiert sind 9 . Wenn jedoch auf Betone durch Einmischen in das Zementbindemittel angewendet wird, kann eine Agglomeration auftreten, wodurch eine wirksame Oberfläche verringert wird, und Zementhydratationsreaktionen können zu einer Photokatalysator-Okklusion führen, die zugängliche Oberfläche weiter reduzieren und den Katalysator daran hindern, das Sonnenlicht 1 , 11 zu aktivieren.
Eine signifikant verbesserte Leistung kann daher erwartet werden, wenn die zugängliche Katalysatoroberfläche besser in effizienteren photokatalytischen Strukturen konserviert wird. Diese haben Katalysatoren, die auf konkreten Oberflächenbelichtungsaggregaten und in Zeolithstrukturen getragen wurden, enthaltenAss = "xref"> 2 , 12 . Die Haltbarkeit dieser Strukturen hängt sehr stark davon ab, wie gut der Katalysator an die verschiedenen Träger gebunden ist. Die Vorteile der chemischen Bindung von TiO 2 an Substrate wurden in der Literatur 8 , 13 oft erwähnt , aber die Mittel zur Charakterisierung des Bindungsgrades waren zweideutig. Dennoch bietet die Integrität einer chemischen Bindung im Verhältnis zu einer physischen Anziehung die Möglichkeit, robuste Strukturen auf der Oberfläche des Betons zu entwickeln. Der Einfluss einer chemischen Bindung zwischen TiO 2 und einem Substrat, z. B. Quarz, um eine Ti-O-Si-Bindung auf die optischen und photokatalytischen Eigenschaften des geträgerten TiO 2 zu liefern, wurde bisher nicht untersucht. Daher liegt der Fokus der vorliegenden Arbeit darin, Mittel zur Erzeugung und Quantifizierung von Ebenen von Ti-O-Si-Bindungen zu schaffen und diese mit dem photokatalytischen zu korrelierenEigenschaften des geträgerten TiO 2 . Zu diesem Zweck wurden sowohl kommerzielles als auch synthetisiertes TiO 2 nach verschiedenen Methoden auf Quarz-SiO 2 -Sand (Q als einfaches Beispiel eines Aggregats) gebunden.
Protocol
Representative Results
Discussion
Fig. 8 zeigt signifikante Unterschiede zwischen den NO-Photonenwirkungsgraden für jedes der photokatalytischen Materialien. Die Vorteile der Unterstützung des Photokatalysators zur Erhöhung der Zugänglichkeit auf die reaktive Oberfläche sind mittlerweile gut etabliert und es ist bemerkenswert, dass der Unterschied zwischen den photonischen Wirkungsgraden für die NO-Oxidation, gemessen für PC105 und für PC105, die auf behandeltem Quarz (QT2) getragen werden. Ξ NO (QT2) wurde bei 73% davon für PC105 gemessen, aber QT2 hatte nur 6,5% der TiO 2 -Ladung. Es ist klar, dass Aktivitätsverbesserungen bei unterstützten Systemen von Bedeutung sind, aber bei der Interpretation von Messungen mit signifikanten morphologischen Unterschieden sollte Vorsicht geboten werden.
Eine wesentliche Eigenschaft des photokatalytischen Testsystems, von der erwartet werden kann, dass es die Messung beeinflusst, ist die Oberflächenstruktur der in dem Photokatalysatorreaktor getragenen Probe. Dies beeinflusst die effektive Fläche. Die BerechnungVon ξ enthält einen Flächenbegriff, aber dies ist ein zweidimensionaler Beleuchtungsbereich, der durch den Reaktorprobenhalter definiert ist. Die Teilchengrößenverteilung von TiO 2 -Pulvern, dh PC105, T1 und T2, unterscheidet sich deutlich von den Verbundwerkstoffen, wobei TiO 2 'Pulver' auf SiO 2 mit einem Durchmesser im Bereich von 0,4 bis 50 μm getragen wird. Dies bedeutet, dass die Photokatalysatoroberflächentexturen ziemlich variabel sind und die erwarteten photonischen Wirkungsgrade beeinflussen werden. Es beeinflusst auch die Reaktorströmungseigenschaften. Je rauer die Textur ist, aufgrund der Packungseigenschaften, desto wahrscheinlicher ist, dass das erforderliche Laminarströmungsregime gestört wird. Es wird erwartet, dass die Rate der Gasmolekül-Diffusion auf die Oberfläche und folglich die photonische Effizienzmessung beeinflusst wird.
Als Folge dieser Effekte muss der nützlichste Vergleich der Photokatalysator-Typen auf Eigenschaften beruhen, die sich aus Messungen an einzelnen Katalysatoren ergeben. In dieser Studie,Nitrat-Selektivität, die auf ξ NO und ξ NO 2 (Gleichung 10) basiert, werden beide, die an der gleichen Probe gemessen wurden, in der nachfolgenden Diskussion verwendet.
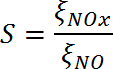 (10)
(10)
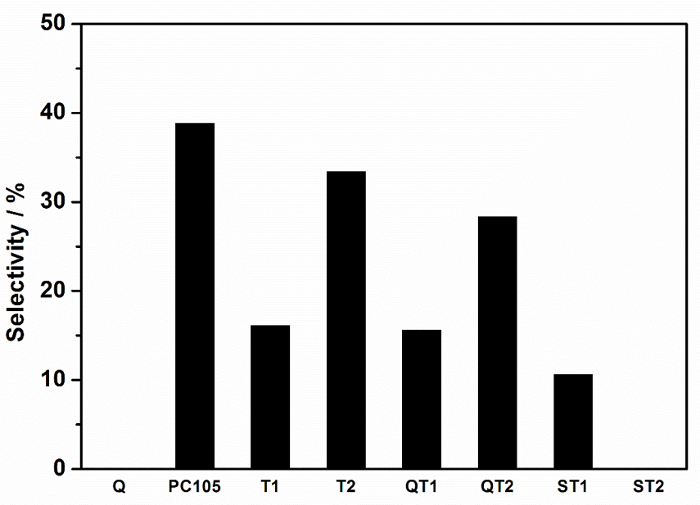
Abbildung 9: Selektivität gegenüber der Gesamtentfernung von NOx, dh Nitratselektivität, aufgezeichnet für verschiedene TiO 2 – und TiO 2 -SiO 2 Composite Powder. Direkt vergleichbare Systeme werden mit denselben Symbolen identifiziert, unterstützt gegen nicht unterstützte Paare. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Die Faktoren, die die Nitratselektivität kontrollieren, scheinen komplexe und relevante Variablen zu seinDe TiO 2 -Polymorphismus, Defektzustand, Wasserverfügbarkeit usw. 7 , aber die Rolle der Substratbindung, die oft als vorteilhaft für die photokatalytische Leistung angesehen wird, kann nun auch in Betracht gezogen werden. Es empfiehlt sich daher, die Nitratselektivitätsunterschiede zwischen nicht gebundenen und gebundenen Systemen, dh eigenständigen Photokatalysatoren gegenüber Photokatalysator-Träger-Verbundwerkstoffen, z. B. PC105 vs QT2, zu diskutieren; Wobei QT2 PC105 in einer Silikatbeschichtung auf Quarz unterstützt. Diese Nitratselektivitätsunterschiede sind in Tabelle 1 zusammengefasst .
| Photokatalysator | Photokatalysator-Unterstützung | DSelectivity (%); (Relative Selektivitätsreduktion (%)) | FTIR-Peakflächenverhältnis; (Ti-O-Si) / SiO & sub2 ;. | Ti-O-Si peAk Mitte (cm -1 ) |
| PC105 | QT2 | (38,8-28,3) = 10,5; (-27) | 0,0088 | 960 |
| T1 | ST1 | (16,0-10,6) = 5,4; (-34) | 0,0184 | 960 |
| T2 | ST2 | (33,4-0) = 33,4; (-100) | 0.6566 | 920 |
| T1 | QT1 | (16,0-15,6) = 0,4; (-3) | 0,0014 | 930 |
Tabelle 1: Einfluss der zusammengesetzten Bildung und Ti-O-Si-Bindung auf die Photokatalysatorleistung. Hintergrundkorrigierte FTIR-Peakflächen für Peaks, die Ti-O-Si (920 – 960 cm -1 ) und für SiO 2 (990 – 1230 cm -1 ) zugewiesen wurden, wurden aus 5 mit Hilfe von Origin Peak Analyses-Software erhalten. Der dimensionslose Bereich rAtio, angegeben in Tabelle 1, wird als Maß für den Grad der Ti-O-Si-Bindung in Verbundsystemen genommen. Ebenfalls gezeigt sind die mit der Ti-O-Si-Verknüpfung verbundenen Spitzenmittelpositionen. Diese Daten sind in Abbildung 10 zusammengefasst .
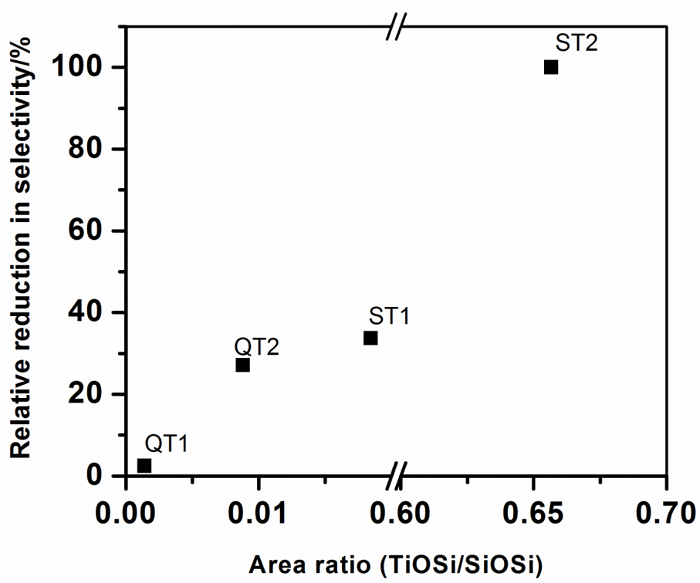
Abbildung 10: Relative Reduktion der Nitratselektivität für verschiedene TiO 2 -Materialien, kombiniert mit SiO 2 als Funktion der Ti-O-Si-Bindung in Photokatalysator-Träger-Verbundwerkstoffen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Die größte Selektivitätsreduzierung bei der Verbundbildung, dh diejenige, die den größten negativen Einfluss auf die Umgebungsluftqualität zeigen würde, ist für den Photokatalysator T2 angegeben, wenn er kombiniert wirdMit einem Silikatvorläufer. Es wird ein hochdisperses Gel hergestellt, in dem Ti-O-Si-Bindungen maximiert sind. Die Peakflächenanalysen zeigen an, dass etwa 65 Mol-% des TiO 2 mit SiO 2 durch Ti-O-Si-Verbindungen assoziiert sind, die sich dem stöchiometrischen TiO 2 : SiO 2 -Verhältnis der Zubereitung (80%) nähert und Vertrauen in die Peak Area Ratio Analyse. Es ist auch bemerkenswert, dass sich das Ti-O-Si-Peak-Zentrum bei der niedrigsten Wellenzahl befindet, die für die Verbundwerkstoffe beobachtet wird, und schlägt vor, dass Zusammensetzungsinformationen in die Ti-O-Si-Peakcharakteristiken eingebettet werden können. Alle anderen Verbundwerkstoffe zeigen deutlich niedrigere (Ti-O-Si) / SiO 2 -Peakflächenverhältnisse, was auf niedrigere Mengen an Ti-O-Si-Bindung hindeutet. Fig. 10 zeigt, daß diese Bindungsebene mit der Selektivität korreliert ist, ausgedrückt als prozentuale Reduktion aus der freistehenden Katalysatorselektivität, was anzeigt, daß die Ti-O-Si-Bindung einen negativen Einfluss auf die photokatalytische NOx-Verminderung hat.
Die Konsequenzen dieser Erkenntnisse sind, dass ein Kompromiss eingehalten werden muss, um die physikalische Haltbarkeit eines gebundenen Systems ohne einen signifikanten Verlust an photokatalytischer Leistung zu gewährleisten. Mögliche Ansätze könnten sein: (i) Erhöhung der geträgerten TiO 2 -Partikelgröße, so dass die vorteilhafte Ti-O-Ti-Bindung, die die intrinsischen photokatalytischen Eigenschaften von "eigenständigen" Photokatalysatoren definiert, nicht durch das Ti-O-Si verdünnt wird Verknüpfungen und / oder (ii) die Entwicklung einer dünnen, porösen und haltbaren Oberflächenbeschichtung für das Substrat, so dass der Photokatalysator in Poren, die für Reaktionsgasmoleküle und Beleuchtung zugänglich sind, eingefangen ist.
Siliciumdioxid in Form von Quarzsand oder reaktiven Siliciumdioxidkugeln wurde erfolgreich mit TiO 2 entweder über den bindenden handelsüblichen TiO 2 -Photokatalysator (PC105) unter Verwendung eines Bindemittels auf Silikatbasis oder über die Hydrolyse-Kondensationsreaktionen verschiedener Ti-Vorläufer modifiziert. Die PhotokatalysatorenC-Leistung der resultierenden Verbundwerkstoffe wurde mit der eines Sol-Gel-abgeleiteten Mischoxidsystems verglichen, das hohe Mengen an Ti-O-Si-Bindungsbindungen fördert. Die wichtigsten Ergebnisse zeigen, dass: (i) der Grad der TiO 2 -SiO 2 -Bindung in der Mischoxidpräparation hoch ist (65%), wie erwartet und nähert sich dem stöchiometrischen TiO 2 : SiO 2 -Verhältnis bei der Herstellung an. Dieses zusammengesetzte Gel-System zeigte keine Nitratselektivität im Vergleich zu dem vergleichbaren Sol-Gel-abgeleiteten TiO 2 (T2), das eine Selektivität von 33% zeigte, (ii), wenn die Reaktivität der Silikatoberfläche den Grad der Ti-O-Si-Bindung verringert Reduziert; Die Ordnung ist reaktive Siliciumdioxidkugeln (ST1)> Silikatgelschicht auf Quarz (QT2)> blanker Quarz und (iii) die Nitratselektivität von TiO 2 wird durch das Niveau der Ti-O-Si-Bindung nachteilig beeinflusst.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren würdigen die Finanzierung des britischen Ingenieur- und Physikalischen Wissenschaftsforschungsrates (Grant Ref: EP / M003299 / 1) und der Naturwissenschaftlichen Stiftung von China (Nr. 51461135005) Internationales Gemeinsames Forschungsprojekt (EPSRC-NSFC).
Materials
| quartz | Aldrich | 31623 | |
| tetrabutylorthotitania (TBOT) | Aldrich | 244112 | |
| ethanol | Aldrich | absolute alcohol | |
| hydrochloric acid | Aldrich | ||
| deionised water | 18.2 MWΩ.cm | ||
| seives | Endecott | ||
| tetraethylorthosilicate (TEOS) | Aldrich | 86578 | |
| PC105 (TiO2) | Cristal Global | ||
| ammonia solution | Aldrich | ||
| titanium tetraisopropoxide (TTIP) | Aldrich | 87560 | |
| barium sulphate | Aldrich | ||
| NO in N2 | BOC | 100 ppm | |
| FTIR spectrophotometer | Perkin Elmer | Spectrum Two | equipped with UATR |
| X-ray diffractometer | PAN analytical | X'Pert3 Powder | equipped with a CuKa1 1.54 Å X-ray source |
| Scanning electron microscope | ISI | ABT55 | ED X-ray analyser and Link Analytical BSE detector |
| Transmission electron microscope | Jeol | JEM-2000EX | utilising a Gatan Erlangshen ES500W camera |
| UV-vis diffuse reflectance spectrophotometer | Agilent Technology | Cary 60 | |
| Mass flow controllers | Bronkhorst | ||
| Humidity monitor | Rotronic | Hygropalm | |
| Solar simulator | Sciencetech | SS0.5kW | 1.5 AM filter used |
| Broadband thermopile detector | Gentec EO | XLP12-3S-H2-D0 | |
| NOx analyser | Air Monitors Ltd | Thermo Scientific Model 42i-HL |
References
- Folli, A., et al. Understanding TiO2 Surface Chemistry to Control and Modulate Photocatalytic Performances. J Am Ceram Soc. 93 (10), 3360-3369 (2010).
- Wang, F. Z., Yang, L., Sun, G. X., Guan, L. Y., Hu, S. G. The Hierarchical Porous Structure of Substrate Enhanced Photocatalytic Activity of TiO2/Cementitious Materials. Constr Build Mater. 64, 488-495 (2014).
- Fateh, R., Dillert, R., Bahnemann, D. Preparation and Characterization of Transparent Hydrophilic Photocatalytic TiO2/SiO2 Thin Films on Polycarbonate. Langmuir. 29 (11), 3730-3739 (2013).
- Dillert, R., Engel, A., Grosse, J., Lindner, P., Bahnemann, D. W. Light Intensity Dependence of the Kinetics of the Photocatalytic Oxidation of Nitrogen(II) Oxide at the Surface of TiO2. Phys Chem Chem Phys. 15, 20876-20886 (2013).
- Shi, H. B., Magaye, R., Castranova, V., Zhao, J. S. Titanium Dioxide Nanoparticles: A Review of Current Toxicological Data. Part Fibre Toxicol. 10, (2013).
- Freitag, J., et al. Nitrogen(II) Oxide Charge Transfer Complexes on TiO2: A New Source for Visible-Light Activity. J Phys Chem C. 119 (9), 4488-4501 (2015).
- Ma, J. Z., Wu, H. M., Liu, Y. C., He, H. Photocatalytic Removal of NOx over Visible Light Responsive Oxygen-Deficient TiO2. J Phys Chem C. 118 (14), 7434-7441 (2014).
- Mendoza, C., Valle, A., Castellote, M., Bahamonde, A., Faraldos, M. TiO2 and TiO2-SiO2 Coated Cement: Comparison of Mechanic and Photocatalytic Properties. Appl Catal B-Environ. 178, 155-164 (2015).
- Kamaruddin, S., Stephan, D. Sol-gel Mediated Coating and Characterization of Photocatalytic Sand and Fumed Silica for Environmental Remediation. Water Air Soil Poll. 225, 1948 (2014).
- Bloh, J. Z., Folli, A., Macphee, D. E. Photocatalytic NOx Abatement: Why the Selectivity Matters. Rsc Adv. 4, (2014).
- Macphee, D. E., Folli, A. Photocatalytic Concretes – the Interface Between Photocatalysis and Cement Chemistry. Cement Concrete Res. 85, 48-54 (2016).
- Yang, L., et al. The Influence of Zeolites Fly Ash Bead/TiO2 Composite Material Surface Morphologies on Their Adsorption and Photocatalytic Performance. Appl Surf Sci. 392, 687-696 (2017).
- Pinho, L., Elhaddad, F., Facio, D. S., Mosquera, M. J. A Novel TiO2-SiO2 Nanocomposite Converts a Very Friable Stone into a Self-Cleaning Building Material. Appl Surf Sci. 275, 389-396 (2013).
- Stöber, W., Fink, A., Bohn, E. Controlled Growth of Monodisperse Silica Spheres in Micron Size Range. J Colloid Interf Sci. 26 (1), 62-69 (1968).
- Yamashita, H., et al. Characterization of Titanium-Silicon Binary Oxide Catalysts Prepared by the Sol-Gel Method and Their Photocatalytic Reactivity for The Liquid-Phase Oxidation of 1-Octanol. J Phys Chem B. 102 (30), 5870-5875 (1998).
- Tokarský, J., et al. A Low-Cost Photoactive Composite Quartz Sand/TiO2. Chem Eng J. 222, 488-497 (2013).
- Beranek, R., Kisch, H. Tuning the optical and photoelectrochemical properties of surface-modified TiO2. Photochem Photobiol Sci. 7 (1), 40-48 (2008).
- Kisch, H., Bahnemann, D. Best Practice in Photocatalysis: Comparing Rates or Apparent Quantum Yields?. J Phys Chem Lett. 6 (10), 1907-1910 (2015).

