Влияние межфазного химического связывания в TiO<sub> 2</sub> -SiO<sub> 2</sub> Композиты на их фотокаталитической эффективности по снижению выбросов NOx
Summary
Основное внимание в настоящей работе уделяется созданию способов генерации и количественного определения уровней связей Ti-O-Si и их корреляции с фотокаталитическими свойствами поддерживаемого TiO 2 .
Abstract
Химическое связывание частиц фотокатализаторов с опорными поверхностями материалов имеет большое значение для разработки более эффективных и практичных фотокаталитических структур. Однако влияние такого химического связывания на оптические и поверхностные свойства фотокатализатора и, следовательно, его поведение фотокаталитической активности / реакционной селективности систематически не изучалось. В этом исследовании TiO 2 поддерживается на поверхности SiO 2 с помощью двух разных методов: (i) путем образования in situ TiO 2 в присутствии песчаного кварца с помощью золь-гель-метода с использованием тетрабутилортотитана (TBOT ); И (ii) путем связывания коммерческого порошка TiO 2 с кварцем на поверхностном слое силикагеля, образованном в результате реакции кварца с тетраэтилортосиликатом (TEOS). Для сравнения наночастицы TiO 2 также осаждались на поверхности более реакционноспособного SiO 2, полученногоГидролиз-золь-гель, а также через золь-гель-путь от предшественников TiO 2 и SiO 2 . Сочетание TiO 2 и SiO 2 через межфазные связи Ti-O-Si подтверждалось с помощью FTIR-спектроскопии, и фотокаталитическая активность полученных композитов была проверена на фотокаталитическое разложение NO согласно стандарту ISO (ISO 22197-1) , Изображения электронного микроскопа полученных материалов показали, что возможное покрытие фотокатализатора на опорной поверхности может быть успешно достигнуто, но на фотокаталитическую активность в направлении удаления NO было обнаружено, что метод получения оказывает влияние, и на селективность нитратов оказывает отрицательное влияние Ti-O-Si склеивание.
Introduction
Бетонные структуры являются повсеместными в нашем обществе. Как правило, связанные с нашими городскими центрами, их значительная площадь поверхности представляет собой важный интерфейс с городской атмосферой 1 , 2 . С учетом растущей обеспокоенности в связи с экономическими и медицинскими последствиями ухудшения качества воздуха в городах этот интерфейс представляет собой важную возможность для восстановления атмосферы. Фотокатализаторы на основе TiO 2 использовались в течение некоторого времени в восстановлении загрязненного NOx воздуха, а их поддержка на этих бетонных конструкциях с высокой площадью поверхности обеспечивает конкретную дополнительную функциональность, ранее связанную с фотокаталитическими материалами: (i) легкая очистка, в результате чего материалы Которые связывают грязь с поверхностями, дезактивируются фотокаталитически, что позволяет легко смывать дождевую воду 3 ; (Ii) фотоиндуцированная гидрофильность, которая также улучшает самоочищающийся эффект 3; И (iii) очистка городской атмосферы, которая сегодня, как правило, загрязняется выбросами транспортных средств на уровнях, которые значительно превышают предельно допустимые уровни, особенно в отношении NOx 4 . TiO 2 является наиболее часто используемым фотокатализатором в природоохранных приложениях из-за его химической стабильности, относительно низкой цены, высокой фотокаталитической активности и, что более важно, его экологической безопасности, как указано в имеющихся в настоящее время данных токсикологии TiO 2 5 .
Фотокаталитические бетоны уже продемонстрировали свой потенциал для восстановления атмосферы на пробных площадках по всей Европе и в других местах. Многочисленные исследования фотокаталитических цементных материалов за последние два десятилетия в основном касались активности катализатора, часто выражались в отношении снижения концентрации NOx 1 , 6 , 7 <sup>, 8 , 9 . Однако только активность является недостаточным показателем эффективности фотокаталитической активности. Снижение концентрации NOx, определяемое как сумма концентраций оксидов азота в атмосфере, само по себе не представляет собой полезного влияния на качество воздуха, поскольку относительная токсичность составляющих газов не эквивалентна 10 .
Фотокаталитическое окисление газов NOx следует последовательности
NO → HONO → NO 2 → HONO 2 (NO 3 – )
Более высокая токсичность NO 2 относительно NO (в консервативном случае в 3 раза) означает, что окислительная конверсия NO до нитрата ( т.е. селективность нитратов ) должна быть максимальной. Следовательно, средства для обеспечения как высокой активности, так и высокого уровня нитрата Избирательность должна быть нацелена.
Что касается катализа, то в целом для адсорбции реагирующих молекул требуются высокие площади поверхности. Наночастицы TiO 2 обеспечивают высокую удельную площадь поверхности, необходимую для высокой фотокаталитической активности, при условии, что частицы адекватно диспергированы. 9 . Однако при нанесении на бетоны путем смешивания в цементном связующем может произойти агломерация, уменьшение эффективной площади поверхности и реакции гидратации цемента могут привести к окклюзии фотокатализатора, уменьшению доступной площади поверхности и блокированию катализатора от активирования солнечного света 1 , 11 .
Поэтому можно ожидать значительного повышения производительности, когда доступная площадь поверхности катализатора лучше сохраняется в более эффективных фотокаталитических структурах. К ним относятся катализаторы, нанесенные на бетонные поверхности, открытые агрегаты и цеолитные структурыAss = "xref"> 2 , 12 . Долговечность этих структур во многом зависит от того, насколько хорошо связан катализатор с различными опорами. Преимущества химического связывания TiO 2 с подложками часто упоминались в литературе 8 , 13, но средства, характеризующие степень связывания, были неоднозначными. Тем не менее, целостность химической связи относительно физического притяжения дает возможность разработать прочные структуры на поверхности бетона. Однако влияние химической связи между TiO 2 и субстратом, например кварцем, для обеспечения связи Ti-O-Si по оптическим и фотокаталитическим свойствам нанесенного TiO 2 , ранее не изучалось. Поэтому основное внимание в настоящей работе уделялось установлению способов генерации и количественного определения уровней связей Ti-O-Si и их корреляции с фотокаталитическимСвойства поддерживаемого TiO 2 . Для этой цели коммерческий, а также синтезированный TiO 2 были связаны различными способами на кварцевом SiO 2 песке (Q, как простой пример агрегата).
Protocol
Representative Results
Discussion
На рисунке 8 показаны довольно значительные различия между эффективностью фотонов NO для каждого из фотокаталитических материалов. Преимущества поддержки фотокатализатора для повышения доступности к реактивной поверхности теперь хорошо установлены, и стоит отметить разницу между фотонной эффективностью для окисления NO, измеренной для PC105, и для PC105, поддерживаемой на обработанном кварце (QT2). Ξ NO (QT2) измеряли при 73% от того, что для PC105, но QT2 имеет только 6,5% нагрузки TiO 2 . Очевидно, что улучшения активности существенны для поддерживаемых систем, но при интерпретации измерений со значительными морфологическими различиями следует применять осторожность.
Ключевой характеристикой фотокаталитической тестовой системы, которая, как можно ожидать, будет влиять на измерение, является текстура поверхности образца, поддерживаемая в реакторе фотокатализатора. Это влияет на эффективную площадь поверхности. РасчетΞ включает в себя зонный член, но это двумерная область освещения, определяемая держателем образца реактора. Распределение частиц по размерам порошков TiO 2 , то есть PC105, T1 и T2, сильно отличается от композитов, где TiO 2 'порошок' нанесен на диаметр SiO 2 в диапазоне 0,4-50 мкм. Это означает, что текстуры поверхности фотокатализатора довольно разнообразны и, как ожидается, будут влиять на фотонную эффективность фотонов. Это также влияет на характеристики потока реактора. Чем грубее текстура из-за характеристик упаковки, тем более вероятно, что требуемый режим ламинарного потока нарушен. Ожидается, что это повлияет на скорость диффузии молекул газа на поверхность и, следовательно, измерение фотонной эффективности.
Вследствие этих эффектов наиболее полезное сравнение типов фотокатализаторов должно основываться на свойствах, полученных в результате измерений на отдельных катализаторах. В этом исследовании,Селективность нитратов, которая основана на ξ NO и ξ NO 2 (уравнение 10), оба измеренные на одном образце, используются в последующем обсуждении.
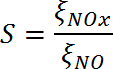 (10)
(10)
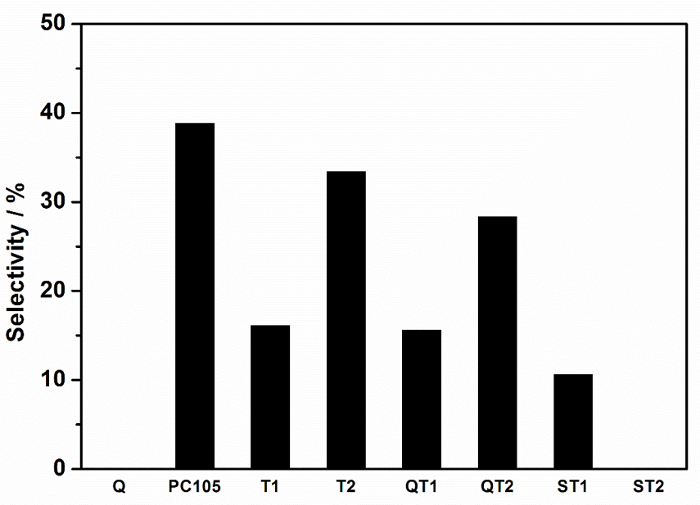
Рисунок 9: Селективность к полному удалению NOx, т.е. селективность нитратов, записанная для различных композиционных порошков TiO 2 и TiO 2 -SiO 2 . Непосредственно сопоставимые системы идентифицируются с теми же символами, поддерживаемыми с не поддерживаемыми парами. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Факторы, которые контролируют селективность нитратов, кажутся сложными, и соответствующие переменные включаютПолиморфизм TiO 2 , состояние дефектов, доступность воды и т. Д. 7 , однако роль связывания субстрата, часто считающаяся выгодной для фотокаталитической эффективности, также может быть рассмотрена. Поэтому полезно обсудить различия селективности нитратов между несвязанными и связанными системами, то есть автономные фотокатализаторы и композиты с подложкой для фотокатализатора, например PC105 vs QT2; Где QT2 представляет собой PC105, нанесенный на силикатное покрытие на кварце. Эти различия селективности нитратов приведены в таблице 1 .
| Фотокаталитический | Фотокаталитический-поддержка | DSelectivity (%); (Относительное снижение селективности (%)) | Коэффициент площади пик FTIR; (Ti-O-Si) / SiO2 | Ti-O-Si peAk center (см -1 ) |
| PC105 | QT2 | (38,8-28,3) = 10,5; (-27) | 0,0088 | 960 |
| T1 | ST1 | (16,0-10,6) = 5,4; (-34) | 0,0184 | 960 |
| T2 | ST2 | (33,4-0) = 33,4; (-100) | 0,6566 | 920 |
| T1 | QT1 | (16,0-15,6) = 0,4; (-3) | 0,0014 | 930 |
Таблица 1: Влияние композиционной формации и связывания Ti-O-Si на эффективность фотокатализатора. Исправленные фоновые области пиков FTIR для пиков, отнесенных к Ti-O-Si (920 – 960 см -1 ), и для SiO 2 (990-1230 см -1 ) были получены на рисунке 5 с использованием программного обеспечения Origin Peak Analyzes. Безразмерная область rAtio, указанное в таблице 1 , принимается как мера степени связывания Ti-O-Si в композитных системах. Также показаны пиковые центральные положения, связанные с соединением Ti-O-Si. Эти данные приведены на рисунке 10 .
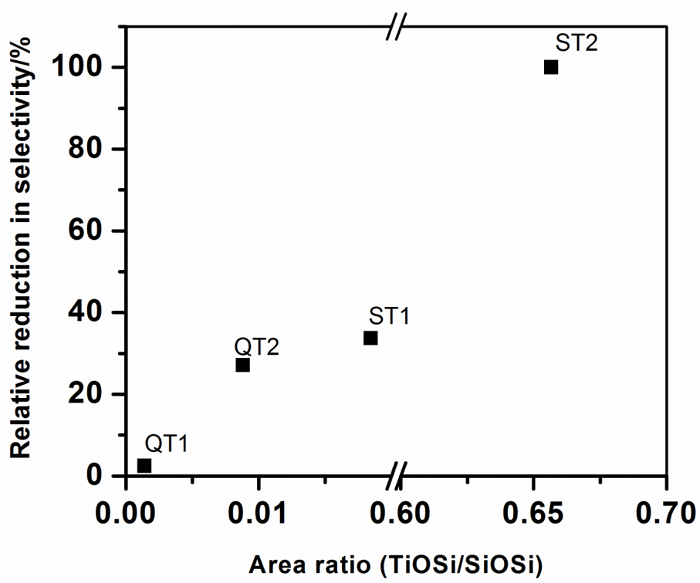
Рисунок 10: Относительное снижение селективности нитратов для различных материалов TiO 2 в сочетании с SiO 2 как функция связывания Ti-O-Si в композитах с композицией для фотокатализатора. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Наибольшее снижение селективности по композиционному образованию, т. Е. Та, которое будет оказывать наибольшее отрицательное влияние на качество окружающего воздуха, указывается для фотокатализатора T2, когда оно комбинируетсяС силикатным предшественником. Производится высокодисперсный гель, в котором максимальные связи Ti-O-Si. Анализ площади пиков показывает, что около 65 мол.% TiO 2 связано с соединениями SiO 2 и Ti-O-Si, которое приближается к стехиометрическому соотношению TiO 2 : SiO 2 препарата (80%) и обеспечивает уверенность в Анализ площади площади. Также следует отметить, что центр пиков Ti-O-Si расположен на самом низком волновом числе, наблюдаемом для композитов, и предполагает, что композиционная информация может быть встроена в пиковые характеристики Ti-O-Si. Все остальные композиты демонстрируют значительно более низкие (Ti-O-Si) / SiO 2 пиковые площади, что указывает на более низкие уровни связи Ti-O-Si. На рисунке 10 показано, что этот уровень связывания коррелирует с селективностью, выраженной как процентное снижение от селективности селективного катализатора, что указывает на то, что связывание Ti-O-Si отрицательно влияет на фотокаталитическое снижение NO x.
Последствия этих результатов заключаются в том, что необходимо обеспечить компромисс, чтобы обеспечить физическую прочность сцепленной системы без значительной потери фотокаталитических характеристик. Возможные подходы могут включать: (i) увеличение поддерживаемого размера частиц TiO 2 таким образом, что выгодное связывание Ti-O-Ti, которое определяет внутренние фотокаталитические свойства «автономных» фотокатализаторов, не разбавляется Ti-O-Si Связей и / или (ii) разработки тонких, пористых и прочных поверхностных покрытий для подложки, так что фотокатализатор захватывается порами, доступными для молекул газа-реагента и освещения.
Силикагель в виде кварцевого песка или реакционно-способных кварцевых шариков успешно модифицирован TiO 2 либо посредством связывания коммерческого фотокатализатора TiO 2 (PC105) с использованием связующего на основе силиката, либо посредством реакций гидролиза-конденсации различных предшественников Ti. ФотокаталитыC характеристик полученных композитов сравнивали с характеристикой смешанной оксидной системы с золь-гелем, способствующей высоким уровням связывания связей Ti-O-Si. Основные результаты показывают, что: (i) степень связывания TiO 2 -SiO 2 в смешанном оксидном препарате высока (65%), как и ожидалось, и приближается к стехиометрическому соотношению TiO 2 : SiO 2 в препарате. Эта композитная гелевая система не проявляла селективности нитратов по сравнению с сопоставимым золь-гелем, полученным из TiO 2 (T2), который показал селективность 33%, (ii) по мере уменьшения реакционной способности поверхности силиката, степени связывания Ti-O-Si уменьшает; Порядок представляет собой слой реактивного кремнезема (ST1)> слой силикатного геля на кварце (QT2)> голый кварц, и (iii) на селективность TiO-Si на нитратную селективность оказывает отрицательное влияние.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы с благодарностью отмечают финансирование со стороны Совета по исследованиям в области инженерных и физических наук Великобритании (Grant Ref: EP / M003299 / 1) и Международного научно-исследовательского проекта по естественным наукам (№ 51461135005) (EPSRC-NSFC).
Materials
| quartz | Aldrich | 31623 | |
| tetrabutylorthotitania (TBOT) | Aldrich | 244112 | |
| ethanol | Aldrich | absolute alcohol | |
| hydrochloric acid | Aldrich | ||
| deionised water | 18.2 MWΩ.cm | ||
| seives | Endecott | ||
| tetraethylorthosilicate (TEOS) | Aldrich | 86578 | |
| PC105 (TiO2) | Cristal Global | ||
| ammonia solution | Aldrich | ||
| titanium tetraisopropoxide (TTIP) | Aldrich | 87560 | |
| barium sulphate | Aldrich | ||
| NO in N2 | BOC | 100 ppm | |
| FTIR spectrophotometer | Perkin Elmer | Spectrum Two | equipped with UATR |
| X-ray diffractometer | PAN analytical | X'Pert3 Powder | equipped with a CuKa1 1.54 Å X-ray source |
| Scanning electron microscope | ISI | ABT55 | ED X-ray analyser and Link Analytical BSE detector |
| Transmission electron microscope | Jeol | JEM-2000EX | utilising a Gatan Erlangshen ES500W camera |
| UV-vis diffuse reflectance spectrophotometer | Agilent Technology | Cary 60 | |
| Mass flow controllers | Bronkhorst | ||
| Humidity monitor | Rotronic | Hygropalm | |
| Solar simulator | Sciencetech | SS0.5kW | 1.5 AM filter used |
| Broadband thermopile detector | Gentec EO | XLP12-3S-H2-D0 | |
| NOx analyser | Air Monitors Ltd | Thermo Scientific Model 42i-HL |
References
- Folli, A., et al. Understanding TiO2 Surface Chemistry to Control and Modulate Photocatalytic Performances. J Am Ceram Soc. 93 (10), 3360-3369 (2010).
- Wang, F. Z., Yang, L., Sun, G. X., Guan, L. Y., Hu, S. G. The Hierarchical Porous Structure of Substrate Enhanced Photocatalytic Activity of TiO2/Cementitious Materials. Constr Build Mater. 64, 488-495 (2014).
- Fateh, R., Dillert, R., Bahnemann, D. Preparation and Characterization of Transparent Hydrophilic Photocatalytic TiO2/SiO2 Thin Films on Polycarbonate. Langmuir. 29 (11), 3730-3739 (2013).
- Dillert, R., Engel, A., Grosse, J., Lindner, P., Bahnemann, D. W. Light Intensity Dependence of the Kinetics of the Photocatalytic Oxidation of Nitrogen(II) Oxide at the Surface of TiO2. Phys Chem Chem Phys. 15, 20876-20886 (2013).
- Shi, H. B., Magaye, R., Castranova, V., Zhao, J. S. Titanium Dioxide Nanoparticles: A Review of Current Toxicological Data. Part Fibre Toxicol. 10, (2013).
- Freitag, J., et al. Nitrogen(II) Oxide Charge Transfer Complexes on TiO2: A New Source for Visible-Light Activity. J Phys Chem C. 119 (9), 4488-4501 (2015).
- Ma, J. Z., Wu, H. M., Liu, Y. C., He, H. Photocatalytic Removal of NOx over Visible Light Responsive Oxygen-Deficient TiO2. J Phys Chem C. 118 (14), 7434-7441 (2014).
- Mendoza, C., Valle, A., Castellote, M., Bahamonde, A., Faraldos, M. TiO2 and TiO2-SiO2 Coated Cement: Comparison of Mechanic and Photocatalytic Properties. Appl Catal B-Environ. 178, 155-164 (2015).
- Kamaruddin, S., Stephan, D. Sol-gel Mediated Coating and Characterization of Photocatalytic Sand and Fumed Silica for Environmental Remediation. Water Air Soil Poll. 225, 1948 (2014).
- Bloh, J. Z., Folli, A., Macphee, D. E. Photocatalytic NOx Abatement: Why the Selectivity Matters. Rsc Adv. 4, (2014).
- Macphee, D. E., Folli, A. Photocatalytic Concretes – the Interface Between Photocatalysis and Cement Chemistry. Cement Concrete Res. 85, 48-54 (2016).
- Yang, L., et al. The Influence of Zeolites Fly Ash Bead/TiO2 Composite Material Surface Morphologies on Their Adsorption and Photocatalytic Performance. Appl Surf Sci. 392, 687-696 (2017).
- Pinho, L., Elhaddad, F., Facio, D. S., Mosquera, M. J. A Novel TiO2-SiO2 Nanocomposite Converts a Very Friable Stone into a Self-Cleaning Building Material. Appl Surf Sci. 275, 389-396 (2013).
- Stöber, W., Fink, A., Bohn, E. Controlled Growth of Monodisperse Silica Spheres in Micron Size Range. J Colloid Interf Sci. 26 (1), 62-69 (1968).
- Yamashita, H., et al. Characterization of Titanium-Silicon Binary Oxide Catalysts Prepared by the Sol-Gel Method and Their Photocatalytic Reactivity for The Liquid-Phase Oxidation of 1-Octanol. J Phys Chem B. 102 (30), 5870-5875 (1998).
- Tokarský, J., et al. A Low-Cost Photoactive Composite Quartz Sand/TiO2. Chem Eng J. 222, 488-497 (2013).
- Beranek, R., Kisch, H. Tuning the optical and photoelectrochemical properties of surface-modified TiO2. Photochem Photobiol Sci. 7 (1), 40-48 (2008).
- Kisch, H., Bahnemann, D. Best Practice in Photocatalysis: Comparing Rates or Apparent Quantum Yields?. J Phys Chem Lett. 6 (10), 1907-1910 (2015).

