製作手順と磁気応答性ランタノイド イオンのキレート リン脂質アセンブリを設計するための複屈折測定
Summary
高磁気応答性希土類金属イオンのキレート polymolecular アセンブリの製作手順が掲載されています。磁場に対する応答は、ナノ細孔膜間押出しによる合わせたアセンブリのサイズによって決まります。アセンブリの磁気無順序と温度誘起構造変化は、複屈折測定, 核磁気共鳴と中性子小角散乱に無料技術によって監視されます。
Abstract
膜は、多種多様な脂質の混合物から形成される可変のディスクのような polymolecular のアセンブリです。アプリケーションの範囲は、核磁気共鳴 (NMR) による膜タンパク質の構造研究から光学活性と磁気切替可能なゲルの形成を含むナノテクノロジー開発です。このようなアセンブリのサイズ、磁気応答と熱抵抗の高いコントロールが必要です。1, 2 の混合物-dimyristoyl –sn– グリセロホスファチジン-3-phosphocholine (DMPC) とそのランタニド イオン (Ln3 +) キレート リン脂質共役、1, 2-dimyristoyl –sn– グリセロホスファチジン 3 リン酸エタノールアミン ジエチレング triaminepentaacetate (DMPE-DTPA)、DMPC/-ln/DTPA による3 +など高い磁気応答性アセンブリにまとめる (モル比 4:1:1) 膜。コレステロール (哲-オハイオ州) と 2 層でステロイド誘導体の導入は、固有の物理化学的性質を提供するアセンブリの別のセットの結果します。特定の脂質組成の磁気無順序は bicelle サイズに比例します。Ln3 +の錯形成反応の大きさと配置の両方の方向の点で前例のない磁気応答の結果します。暖房時に小胞にディスクのような構造の熱可逆性崩壊によりメンブラン フィルター定義された細孔径間押出しによるアセンブリの寸法の仕立てができます。磁気整列膜、小胞前駆体によって定義されたアセンブリ寸法で 5 ° C に冷却することにより再生されます。ここで、この作製手順を説明し、アセンブリの磁気無順序は 5.5 T の磁場下における複屈折測定によって定量化されます。複屈折の信号リン脂質二重膜からは、さらに 2 層 polymolecular の変化を監視できます。この単純な手法は膜の特性によく採用されている NMR 実験に補足であります。
Introduction
膜は、多数の脂質の混合物から得られたディスクのような polymolecular のアセンブリです。1,2,3,4,5広く使用されます膜の生体分子の構造解析の NMR 分光法による。6,7ただし、最近の取り組みが可能なアプリケーションのフィールドの拡大を目指してください。5,8,9最も研究の bicelle システムは、1, 2 の混合物から成る-dimyristoyl –sn– グリセロホスファチジン-3-phosphocholine (DMPC)、アセンブリ、および 1, 2 の平面な部分-dihexanoyl –sn– グリセロホスファチジン-3-phosphocholine (DHPC)リン脂質は、エッジをカバーします。1,2,3膜を構成するリン脂質の分子幾何学は、polymolecular の自己組織化構造の建築を指示します。4,5による DTPA と交換 DHPC 高磁気応答性と調整可能な bicelle システムを生成します。10,11 DMPC/-ln/DTPA による3 + (モル比 4:1:1) 膜強化磁気応答の結果、膜の表面に多くより常磁性希土類金属イオン (Ln3 +) を関連付けます。10また、希釈耐性膜の形成による DTPA/Ln3 +と DHPC の水溶性分子を交換します。11
平面 polymolecular アセンブリの磁気無順序は彼らの全体的な磁気エネルギーによって決定されます。
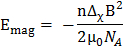 (1)
(1)
B が、磁場の強さ、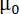 磁気定数、n 集計数と
磁気定数、n 集計数と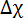 、膜を構成する脂質分子の反磁性帯磁率異方性。したがって、磁場に対する DMPC/-ln/DTPA による3 +膜の応答はサイズ (集計番号 n) および分子磁性磁化率異方性 Δχ で合わせています。後者は容易にキレート Ln3 +の性質を変えることによって行われます。12,13,14,15紹介コレステロール (哲-オハイオ州) や 2 層他のステロイドの誘導体は、集計番号 n とアセンブリの帯磁 Δχ チューニングの可能性を提供しています。11,16,17,18,19特定の脂質組成の大きいアセンブリを含めるより脂質 Eマグ(集計数 n が大きいほど) に貢献できるより整列種の結果します。DMPC/DHPC 膜のサイズはたとえば、従来構成脂質の比率または合計濃度の最適化を通じて制御されます。20,21,22これは DMPC/-ln/DTPA による3 +膜可能ですが、提供を加熱すると小胞へ bicelle からの熱可逆性転換は仕立てオプションを追加しました。機械は、メンブラン フィルター押出により、小胞の形成などを意味します。5 ° C に冷却される磁気整列の膜が再生され、小胞前駆体からの寸法を決定します。11 ・・・、我々 に焦点を当てると DMPC/による DTPA/Tm3 +機械加工手順の可能性 (モル比 4:1:1) または DMPC/哲-ああ/による-DTPA/Tm3 + (モル比 16:4:5:5) 参照システムとして。その他 Ln3 + Tm3 +よりもを使用するとき、プロセスはおおむね正確に働きます。これらの技術によって提供される可能性の広い範囲が図 1に強調され、広く他の所で議論。23
、膜を構成する脂質分子の反磁性帯磁率異方性。したがって、磁場に対する DMPC/-ln/DTPA による3 +膜の応答はサイズ (集計番号 n) および分子磁性磁化率異方性 Δχ で合わせています。後者は容易にキレート Ln3 +の性質を変えることによって行われます。12,13,14,15紹介コレステロール (哲-オハイオ州) や 2 層他のステロイドの誘導体は、集計番号 n とアセンブリの帯磁 Δχ チューニングの可能性を提供しています。11,16,17,18,19特定の脂質組成の大きいアセンブリを含めるより脂質 Eマグ(集計数 n が大きいほど) に貢献できるより整列種の結果します。DMPC/DHPC 膜のサイズはたとえば、従来構成脂質の比率または合計濃度の最適化を通じて制御されます。20,21,22これは DMPC/-ln/DTPA による3 +膜可能ですが、提供を加熱すると小胞へ bicelle からの熱可逆性転換は仕立てオプションを追加しました。機械は、メンブラン フィルター押出により、小胞の形成などを意味します。5 ° C に冷却される磁気整列の膜が再生され、小胞前駆体からの寸法を決定します。11 ・・・、我々 に焦点を当てると DMPC/による DTPA/Tm3 +機械加工手順の可能性 (モル比 4:1:1) または DMPC/哲-ああ/による-DTPA/Tm3 + (モル比 16:4:5:5) 参照システムとして。その他 Ln3 + Tm3 +よりもを使用するとき、プロセスはおおむね正確に働きます。これらの技術によって提供される可能性の広い範囲が図 1に強調され、広く他の所で議論。23
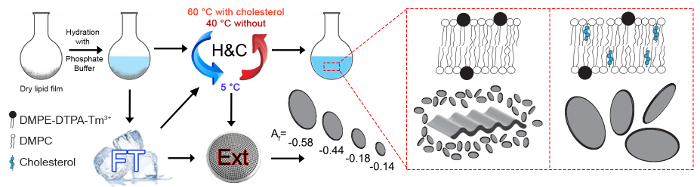
図 1: 可能な製作手順の図式的な概観します。調査磁気整列 Ln3 +キレート polymolecular アセンブリのいずれか DMPC/による DTPA/Tm3 +で構成されています (モル比 4:1:1) または DMPC/哲-ああ/による-DTPA/Tm3 + (モル比 16:4:5:5)。PH 値 7.4 の 50 mM リン酸緩衝と乾燥脂質膜が水分補給し、総脂質濃度は 15 mM。脂質膜の効果的な水分補給が必要か凍結融解のサイクル (フィート) または加熱・冷却サイクル (H & C)。H & C サイクルが最後フリーズの分解の手順の後のサンプルを再生成するか、またはさらに押出成形せずに使用する場合、時間の長時間にわたって凍結保存試料を再生成する必要。これらの手順は、Isabettiniらに広く議論されています。23最大限に整列 polymolecular アセンブリを実現、脂質組成に基づく別のアセンブリのアーキテクチャを提供します。Bicelle サイズと磁気無順序ナノ細孔膜フィルター (Ext) 間押出しによる可変です。提示された線形要因 Afは 800、400、200、100 のいずれかを通して押し出さ DMPC/哲-ああ/による-DTPA/Tm3 + (モル比 16:4:5:5) サンプルの 2次元小角中性子散乱 (SAN) パターンから計算された nm 毛穴。SANS の測定、詳細はここでは扱いません bicelle 配置の定量化の補完的な手段です。11,16 Af -1 (並列中性子散乱または磁場方向に対する膜の垂直配置) から等方散乱の 0 の範囲します。この図の拡大版を表示するのには、ここをクリックしてください。
膜の構造は、解析技術の広い範囲で幅広く研究されています。13磁場にさらされる膜の配置は、NMR 分光法又は小角中性子散乱 (SAN) 実験のいずれかを使用して定量化されています。5,10,11,12,13,16,17,18,19,24,25ただし、shift キーを押し Ln3 +の存在下で発生する NMR ピークの広がりは深刻な制限メソッドに。15,26,27,28が SAN 実験に苦しむしないこの制限、代替、ソリューション内のアセンブリの磁場誘起配向のルーチンの定量化のために望ましいより使いやすいテクニックです。複屈折測定可能な比較的簡単な代わりであります。NMR 実験に同様する複屈折測定では、脂質の語順換えおよび 2 層で発生する脂質段階に関する貴重な情報を明らかにします。また、温度などの環境条件を変更すると polymolecular アセンブリの幾何学的な変化が監視されます。11,12,13,16磁気誘導複屈折 Δn′ は、リン系の様々 な種類を勉強する使用されています。13,29,30磁場下における位相変調法を用いた複屈折測定は、膜の向きを検出するための現実的な方法です。12,16,18,29,31,32 35 T までの高磁場下における複屈折膜の調査の可能性 m. Liebiらによって示したも13
偏光異方性材料が入ったら、普通と異常な波で屈折します。11 2 つの波は別の速度がある、位相差 δ によって段階にシフトされます。位相差 δ の程度を測定し、複屈折信号に変換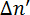 材料を用いた異方性の度合いを定量化するには
材料を用いた異方性の度合いを定量化するには
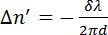 (2)
(2)
λ ある波長レーザーと d は、試料の厚みです。リン脂質は、光学異方性とその光軸の長い分子軸は、炭化水素の尾に平行と一致しています。11,12位相差計測されますないリン脂質はソリューションでランダムに配向されています。リン脂質は、互いに平行に並んでいる場合、遅滞は測定されます。磁気誘導複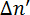 磁気フィールドに、分子の方向に応じて正または負の符号を持つことができます図 2を参照してください。負の x 軸に平行にリン脂質になります
磁気フィールドに、分子の方向に応じて正または負の符号を持つことができます図 2を参照してください。負の x 軸に平行にリン脂質になります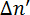 、肯定的な z 軸に沿って整列それら結果
、肯定的な z 軸に沿って整列それら結果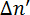 。光軸が y 軸に平行に配置されます、リン脂質、光の伝搬方向と一致する場合は複屈折認められなかったです。
。光軸が y 軸に平行に配置されます、リン脂質、光の伝搬方向と一致する場合は複屈折認められなかったです。
図 2: リン脂質と磁場誘起複屈折の対応する記号の配置 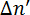 .測定の記号
.測定の記号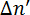 磁場下におけるリン脂質の向きによって異なります。破線は、分子の光軸を示しています。光は 45 ° で偏光し、y 方向に伝達します。磁場 B は z 方向です。この図は、M. Liebi から変更されています。11 この図の拡大版を表示するのにはここをクリックしてください。
磁場下におけるリン脂質の向きによって異なります。破線は、分子の光軸を示しています。光は 45 ° で偏光し、y 方向に伝達します。磁場 B は z 方向です。この図は、M. Liebi から変更されています。11 この図の拡大版を表示するのにはここをクリックしてください。
膜の異方性のコロイド分散液、場合、膜リン脂質の配置による配向は失われ、位相差 δ をゼロになります。膜は、偏光の位相差 δ を引き起こして、その膜の光学活性なリン脂質をオリエンテーションするためにも揃える必要があります。その結果、複屈折は、polymolecular アセンブリの磁気無順序を定量化する敏感なツールです。配向膜磁場に対して垂直に行えば、肯定的な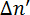 、平行にこれらの否定的な利回りが
、平行にこれらの否定的な利回りが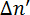 。サインはセットアップの配置に依存し、参照サンプルでチェックすることがあります。
。サインはセットアップの配置に依存し、参照サンプルでチェックすることがあります。
Protocol
Representative Results
Discussion
複屈折測定された SAN との組み合わせで使用する方法の詳細な説明は、高磁気応答 Ln3 +アセンブリは Isabettiniらリンをキレートを生成するための方法を評価する実験します。23提案作製プロトコルは、や、膜ステロイド誘導体化学エンジニア リングを含む、長い DPPC とヒドリド錯体を用いたリン脂質から成るアセンブリに適用されるも。11…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者は、SMhardBi (プロジェクト番号 200021_150088/1) を資金調達のためのスイスの全米科学財団をご了承ください。SAN の実験は、スイスの核破砕中性子源 SINQ、ポール ・ シェラー工業、Villigen、スイス連邦共和国で行われました。著者は温かみのある SAN 実験で彼の指導の博士ヨアヒム Kohlbrecher をありがとうございます。強磁場下での複屈折測定セットアップは、既存の強磁場磁性研究室で HFML、ナイメーヘン、オランダのセットアップから触発されました。博士ベルンハルト コラー継続的な技術サポートとレーザーの罰金と安易な配置を許可するフレームワークを構築するためのダニエル Kiechl 1 月コルサーノ ブルーノ フィスター複屈折セットアップのエレクトロニクスの開発に彼の助けを感謝いたします。
Materials
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345P | >99% |
| 1,2-dimyristoyl-sn-glycero-3-phospho-ethanolamine-diethylene triaminepentaacetate acid hexammonium salt (DMPE-DTPA) | Avanti Polar Lipids | 790535P | >99% |
| Thulium(III) chloride | Sigma-Aldrich | 439649 | anhydrous, powder, 99.9% trace metals basis |
| Dysprosium(III) chloride | Sigma-Aldrich | 325546 | anhydrous, powder, 99.9% trace metals basis |
| Ytterbium(III) chloride | Sigma-Aldrich | 439614 | anhydrous, powder, 99.9% trace metals basis |
| Chloroform | Sigma-Aldrich | 319988 | contains ethanol as stabilizer, ACS reagent, ≥99.8% |
| Methanol | Sigma-Aldrich | 34860 | ≥99.9% |
| Cholesterol | Amresco | 433 | Ultra pure grade |
| D2O | ARMAR chemicals | 1410 | 99.8 atom % D |
| Ultrapure water | Millipore | Synergy pak2 (SYPK0SIX2), Millipack GP (MPGP02001) | |
| electronic pH meter | Metrohm | 17440010 | |
| Whatmann Nuclepore 25 mm 100nm membrane filter | VWR | 515-2028 | |
| Whatmann Nuclepore 25 mm 200nm membrane filter | VWR | 515-2029 | |
| Whatmann Nuclepore 25 mm 400nm membrane filter | VWR | 515-2030 | |
| Whatmann Nuclepore 25 mm 800nm membrane filter | VWR | 515-2032 | |
| Whatmann Filter paper | VWR | 230600 | |
| 25 ml round bottom flask | VWR | 201-1352 | 14/23 NS |
| 3 ml glass snap-cup | VWR | 548-0554 | ND18, 18x30mm |
| 2.5 ml glass syringe | Hamilton | ||
| Sodium dihydrogen phosphate dihydrate | Merk | 1.06342 | Salt used to make phosphate buffer |
| di-Sodium hydrogen phosphate | Merk | 1.06586 | Salt used to make phosphate buffer |
| Liquid Nitrogen | Carbagas | – | |
| Pressurized Nitrogen gas | Carbagas | – | 200 bar bottle |
| Lipid Extruder 10 ml | Lipex | – | Fully equipped with thermobarrel |
| High-pressure PVC tube | GR NETUM | – | must resist more than 4 MPa |
| Serto adaptors | Sertot | – | |
| Nitrile gloves | VWR | – | |
| 2 ml glass pipettes | VWR | 612-1702 | 230 mm long |
| Diode Laser | Newport | LPM635-25C | |
| DSP Dual Phase Lock-in Amplifier | SRS | SR830 | |
| Photodiode Detector | Silonex Inc. | SLSD-71N5 | 5mm2, Silicon, photo-conductive |
| 5.5 T Cryogenic Magnetic | Cryogenic/Oerlikon AG | – | 12 bar He-cooled. RW4000/6000 compressor, RGD 5/100 TA cryo-head |
| Second order low pass filter | home-built | – | Linear power supply 24V DC, second order, Sallen Key, cut-off frequency 360 Hz, +/- 12V, max 10 mA |
| Photoelastic modulator | Hinds instruments | PEM-90 | |
| Glan-Thompson Calcite Polarizer | Newport | 10GT04 | 25.4mm diameter |
| Quartz sample cuvette | Hellma | 165-10-40 | temperature controlled cell, 0.8 ml, 10mm path length |
| Temperature probe | Thermocontrol | – | Type K, 0.5mm diameter, Thermocoax |
| Non-polarizing mirrors | Newport | 50326-1002 | 25.4mm |
| RS 232 cables | National Instruments | 189284-02 | For Connecting to the RS-232 Port on the front of Compact FieldPoint Controllers |
| BNC 50 Ω cable and connectors | National Instruments | 763389-01 | |
| cFP-AI-110 | National Instruments | 777318-110 | 8-Channel Analog Voltage and Current Input Module for Compact FieldPoint |
| cFP-CB-1 | National Instruments | 778618-01 | Integrated Connector Block for Wiring to Compact FieldPoint I/O |
| cFP-CB-3 | National Instruments | 778618-03 | Integrated Isothermal Connector Block for Wiring Thermocouples to the cFP-TC-120 Module |
| cFP-TC-120 | National Instruments | 777318-120 | 8-Channel Thermocouple Input Module for Compact FieldPoint |
| cFP-1804 | National Instruments | 779490-01 | Ethernet/Serial Interface for NI Compact FieldPoint |
| LabView 2010 | National Instruments | – | |
| Industrial power supply | Traco Power | TCL 060-124 | 100-240V AC |
| Waterbath | Julabo | FP40-HE | refrigerated/Heating Circulator |
References
- Sanders, C. R., Hare, B. J., Howard, K. P., Prestegard, J. H. Magnetically-oriented phospholipid micelles as a tool for the study of membrane-associated molecules. Prog. Nucl. Magn. Reson. Spectrosc. 26, 421-444 (1994).
- Glover, K. J., et al. Structural evaluation of phospholipid bicelles for solution-state studies of membrane-associated biomolecules. Biophys. J. 81 (4), 2163-2171 (2001).
- Katsaras, J. H. T. A., Pencer, J., Nieh, M. -. P. “Bicellar” lipid mixtures as used in biochemical and biophysical studies. Naturwissenschaften. 92 (8), 355-366 (2005).
- Sanders, C. R., Prosser, R. S. Bicelles: a model membrane system for all seasons?. Structure. 6 (10), 1227-1234 (1998).
- Dürr, U. H. N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: birth and coming of age of lipid bicelles. Prog. Nucl. Magn. Reson. Spectrosc. 69, 1-22 (2013).
- Dürr, U. H. N., Gildenberg, M., Ramamoorthy, A. The magic of bicelles lights up membrane protein structure. Chem. Rev. 112, 6054-6074 (2012).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lepidic bicelle method. J. Vis. Exp. (59), (2012).
- Barbosa-Barros, L., et al. Bicelles: lipid nanostructured platforms with potential dermal applications. Small. 6, 807-818 (2012).
- Lin, L., et al. Hybrid bicelles as a pH-sensitive nanocarrier for hydrophobic drug delivery. RSC Adv. 6, 79811-79821 (2016).
- Beck, P., et al. Novel type of bicellar disks from a mixture of DMPC and DMPE-DTPA with complexed lanthanides. Langmuir. 26 (8), 5382-5387 (2010).
- Liebi, M. . Tailored phospholipid bicelles to generate magnetically switchable material. , (2013).
- Liebi, M., et al. Magnetically enhanced bicelles delivering switchable anisotropy in optical gels. ACS. Appl. Mater. Interfaces. 6 (2), 1100-1105 (2014).
- Liebi, M., et al. Alignment of bicelles studied with high-field magnetic birefringence and small-angle neutron scattering measurements. Langmuir. 29, 3467-3473 (2013).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys J. 74, 2405-2418 (1998).
- Prosser, R. S., Bryant, H., Bryant, R. G., Vold, R. R. Lanthanide chelates as bilayer alignment tools in NMR studies of membrane-associated peptides. J. Magn. Reson. 141, 256-260 (1999).
- Liebi, M., Kohlbrecher, J., Ishikawa, T., Fischer, P., Walde, P., Windhab, E. J. Cholesterol increases the magnetic aligning of bicellar disks from an aqueous mixture of DMPC and DMPE-DTPA with complexed thulium ions. Langmuir. 28 (29), 10905-10915 (2012).
- Liebi, M., et al. Cholesterol-diethylenetriaminepentaacetate complexed with thulium ions integrated into bicelles to increase their magnetic alignability. J. Phys. Chem. B. 117 (47), 14743-14748 (2013).
- Isabettini, S., et al. Tailoring bicelle morphology and thermal stability with lanthanide-chelating cholesterol conjugates. Langmuir. 32, 9005-9014 (2016).
- Isabettini, S., et al. Mastering the magnetic susceptibility of magnetically responsive bicelles with 3β-Amino-5-Cholestene and complexed lanthanide ions. Phys. Chem. Chem. Phys. 19, 10820-10824 (2017).
- De Angelis, A. A., Opella, S. J. Bicelle samples for solid-state NMR of membrane proteins. Nat. Protoc. 2 (10), 2332-2338 (2007).
- Son, W. S., et al. “Q-Titration” of long-chain and short-chain lipids differentiates between structured and mobile residues of membrane proteins studied in bicelles by solution NMR spectroscopy. J. Magn. Reson. 214, 111-118 (2012).
- . Bicelle Preparation Available from: https://avantilipids.com/tech-support/liposome-preparation/bicelle-preparation (2017)
- Isabettini, S., et al. Methods for Generating Highly Magnetically Responsive Lanthanide-Chelating Phospholipid Polymolecular Assemblies. Langmuir. 33, 6363-6371 (2017).
- Nieh, M. -. P., Glinka, C. J., Krueger, S., Prosser, R. S., Katsaras, J. SANS study on the effect of lanthanide ions and charged lipids on the morphology of phospholipid mixtures. Biophysical Journal. 82 (5), 2487-2498 (2002).
- Watts, A., Spooner, P. J. R. Phospholipid phase transitions as revealed by NMR. Chem. Phys. Lip. 57, 195-211 (1991).
- Bleaney, B. Nuclear magnetic-resonance shifts in solution due to lanthanide ions. J. Magn. Reson. 8, 91-100 (1972).
- Prosser, R. S., Volkov, V. B., Shiyanovskaya, I. V. Solid-state NMR studies of magnetically aligned phospholipid membranes: taming lanthanides for membrane protein studies. Biochem. Cell Biol. 76, 443-451 (1998).
- Prosser, R. S., Volkov, V. B., Shiyanovskaya, I. V. Novel chelate-induced magnetic alignment of biological membranes. Biophys. J. 75, 2163-2169 (1998).
- Shklyarevskiy, I. O., et al. Magnetic alignment of self-assembled anthracene organogel fibers. Langmuir. 21, 2108-2112 (2005).
- Christianen, P. C. M., Shklyarevskiy, I. O., Boamfa, M. I., Maan, J. C. Alignment of molecular materials in high magnetic fields. Physica B: Condens. Matter. 346, 255-261 (2004).
- Maret, G., Dransfeld, K. Biomolecules and polymers in high steady magnetic fields. Top. App. Phys. 57, 143-204 (1985).
- Gielen, J. C., Shklyarevskiy, I. O., Schenning, A. P. H. J., Christianen, P. C. M., Maan, J. C. Using magnetic birefringence to determine the molecular arrangement of supramolecular nanostructures. Sci. Tech. Adv. Mater. 10 (1), 014601 (2009).
- Shklyarevskiy, I. O. . Deformation and ordering of molecular assemblies in high magnetic fields. , (2005).
- Fuller, G. G. . Optical rheometry of complex fluids. , (1995).
- Walde, P., Cosentino, K., Engel, H., Stano, P. Giant vesicles: preparations and applications. ChemBioChem. 11, 848-865 (2010).
- . Liposome Preparation Available from: https://avantilipids.com/tech-support/liposome-preparation (2017)
- . Preparing Large, Unilamellar Vesicles by Extrusion (LUVET) Available from: https://avantilipids.com/tech-support/liposome-preparation/luvet (2017)
- Isabettini, S., et al. Molecular engineering of lanthanide ion chelating phospholipids generating assemblies with a switched magnetic susceptibility. Phys. Chem. Chem. Phys. 19, 20991-21002 (2017).
- Battaglia, M. R., Ritchie, G. L. D. Molecular magnetic anisotropies from the Cotton-Mouton effect. J. Chem. Soc., Faraday Trans. 2. 73 (2), 209-221 (1977).
- Sprunt, S., Nounesis, G., Litster, J. D., Ratna, B., Shashidhar, R. High-field magnetic birefringence study of the phase behavior of concentrated solutions of phospholipid tubules. Phys. Rev. E. 48 (1), 328-339 (1993).
- Zhao, J., et al. Continuous paranematic ordering of rigid and semiflexible amyloid-Fe3O4 hybrid fibrils in an external magnetic field. Biomacromolecules. 17 (8), 2555-2561 (2016).

