आरएनए विश्लेषण के लिए बड़े जानवरों से लिम्फ नोड्स के संग्रह और प्रसंस्करण: बड़े पशु प्रजातियों के लिम्फ नोड Transcriptomic अध्ययन के लिए तैयारी
Summary
इस प्रोटोकॉल की पहचान और पशुधन और वंय जीवन, नमूना दृष्टिकोण से लिम्फ नोड्स के उत्पाद में कदम सहित बड़े जानवरों से लिम्फ नोड के ऊतकों की transcriptomic रूपरेखा के लिए एक आरएनए के अलगाव के लिए प्रक्रियाओं का एक सिंहावलोकन प्रदान करता है एकाधिक पशुओं में एकरूपता प्रदान करने के लिए, और आरएनए विश्लेषण के लिए पोस्ट-संग्रह संरक्षण और संसाधन के लिए विचार प्लस प्रतिनिधि परिणाम ।
Abstract
बड़े जानवरों (दोनों पशुधन और वंय जीवन) पशुजन्य रोगजनकों के महत्वपूर्ण जलाशयों के रूप में सेवा करते हैं, जिनमें ब्रूसेला, माइकोबैक्टीरियम bovis, साल्मोनेलाऔर ई. कोलाई, और रोगजनन के अध्ययन के लिए उपयोगी हैं और/ प्राकृतिक मेजबान में बैक्टीरिया का प्रसार । मेजबान प्रतिरक्षा प्रतिक्रिया में लिम्फ नोड्स के प्रमुख समारोह के साथ, लिम्फ नोड ऊतकों बहाव transcriptomic विश्लेषण के लिए आरएनए के एक संभावित स्रोत के रूप में सेवा, क्रम में एक संक्रमण के पाठ्यक्रम पर कोशिकाओं में जीन अभिव्यक्ति में लौकिक परिवर्तन का आकलन करने के लिए. इस लेख में लिम्फ नोड संग्रह, ऊतक नमूना, और बहाव आरएनए प्रसंस्करण पशुधन की प्रक्रिया का एक सिंहावलोकन प्रस्तुत करता है, एक मॉडल के रूप में पशु (Bos taurus) का उपयोग कर, अतिरिक्त उदाहरण के साथ अमेरिकी बायसन (जंगली भैंसों की जंगली भैंसों से प्रदान की ). प्रोटोकॉल स्थान, पहचान, और शरीर में कई प्रमुख साइटों से लिम्फ नोड्स को हटाने के बारे में जानकारी शामिल है । इसके अतिरिक्त, एक बायोप्सी नमूना पद्धति प्रस्तुत की है कि कई जानवरों के पार नमूने की एक निरंतरता के लिए अनुमति देता है । नमूना संरक्षण के लिए कई विचार आरएनए-sequencing और आरटी-पीसीआर की तरह बहाव के तरीके के लिए उपयुक्त आरएनए की पीढ़ी सहित, चर्चा कर रहे हैं. लंबे समय से बड़े जानवर बनाम माउस समय पाठ्यक्रम अध्ययन में निहित देरी के कारण, जंगली भैंसों और गोजातीय लिम्फ नोड के ऊतकों से प्रतिनिधि परिणाम इस ऊतक प्रकार में गिरावट के समय पाठ्यक्रम का वर्णन करने के लिए प्रस्तुत कर रहे हैं, की एक समीक्षा के संदर्भ में पिछला methodological अन्य ऊतकों में आरएनए क्षरण पर काम करते हैं । कुल मिलाकर, इस प्रोटोकॉल दोनों पशु चिकित्सा बड़े जानवर के नमूनों पर transcriptome परियोजनाओं की शुरुआत और आणविक जीव में vivo ऊतक नमूने और इन विट्रो में प्रसंस्करण के लिए तकनीक सीखने में रुचि के शोधकर्ताओं के लिए उपयोगी हो जाएगा ।
Introduction
आरएनए-sequencing विश्लेषण लिम्फ नोड्स के transcriptome के रोगजनकों की एक किस्म के लिए जानवरों की प्रतिरक्षा प्रतिक्रिया को चिह्नित करने का अवसर प्रदान करता है । हालांकि इस पद्धति चूहों में बड़े पैमाने पर उपयोग किया गया है, विश्लेषण हाल ही में बड़ा स्तनधारी1,2में विस्तार किया गया है । पशुधन/बड़े पशु लिम्फ नोड्स के लिए एक संक्रमण के लिए मेजबान प्रतिक्रियाओं की विशेषता इस्तेमाल किया जा सकता है, न केवल वैक्सीन या आनुवंशिक संवेदनशीलता के अध्ययन में उनके उपयोग के लिए और दवा के विकास के लिए लक्ष्य की पहचान के लिए, लेकिन यह भी मानव अध्ययन के लिए मॉडल सिस्टम के रूप में पशुजन्य रोगों पर । उदाहरण के लिए, brucellosis के मामले में (एक पशुजन्य जीवाणु रोग है कि प्रभावों दुनिया भर में हर साल आधा लाख लोगों), काफी बढ़ लागत के बावजूद, भेड़ या बकरी में अध्ययन मानव संक्रमण और मानव वैक्सीन के लिए अधिक प्रासंगिक हैं प्रयोगशाला पशु मॉडल से विकास । माउस संक्रमण मॉडल दोहराऊंगा reticuloendothelial प्रणाली संक्रमण नहीं बल्कि विशेषता नैदानिक लक्षण3।
प्रयोगशाला पशु अध्ययन की तुलना में बड़े पशु प्रयोगों में, आवश्यक रूप से ऊतक कटाई की प्रक्रिया इच्छामृत्यु और ऊतक संग्रह है, जो के संरक्षण के लिए एक संभावित चुनौती प्रस्तुत करता है के बीच अब देरी शामिल है उच्च गुणवत्ता आरएनए । अक्षुण्ण आरएनए जैविक रूप से प्रासंगिक transcriptomic डेटा की पीढ़ी के लिए आवश्यक है । ऊतक नमूनों से उच्च गुणवत्ता आरएनए की पीढ़ी विशेष रूप से बड़े पशु रोगजनक अध्ययन में शामिल सुविधाओं के लिए महत्वपूर्ण है । इस तरह के अध्ययनों के स्वाभाविक रूप से और अधिक प्रदर्शन के रूप में वे न केवल अनुमोदित सुविधाओं और उच्च प्रशिक्षित कर्मियों की आवश्यकता है, लेकिन यह भी महत्वपूर्ण वित्तीय लागत, जो, काम पर निर्भर करता है, दसियों डॉलर के हजारों की सैकड़ों को लेकर कर सकते है मुश्किल है । अध्ययन के इन प्रकार भी एक क्रॉस-अनुशासनात्मक सहयोग और पार उनके पूरा होने के लिए अनुशासनात्मक ज्ञान, उनकी जटिलता को जोड़ने शामिल है । इसलिए, के विकास पर प्रशिक्षण, और नमूना संग्रह और संरक्षण के लिए एक सुव्यवस्थित प्रणाली का पालन संक्रमित पशुओं से ऊतकों के बहाव आणविक अध्ययन के लिए महत्वपूर्ण लाभ प्रदान करता है ।
बड़ा लिम्फ नोड्स के संग्रह murine लिम्फ नोड्स के समान नमूना की तुलना में ऊतक संग्रह के लिए अतिरिक्त चुनौतियों प्रस्तुत करता है । नमूना उत्पाद के लिए तैयारी प्रासंगिक आंतरिक संरचनाओं सहित लिम्फ नोड के शरीर रचना विज्ञान की एक बुनियादी समझ आवश्यक । एक लिम्फ नोड की संरचना लसीकावत् खण्डों लिम्फ से भरा साइनस से घिरा हुआ शामिल है । इन संरचनाओं एक कठिन, रेशेदार कैप्सूल के भीतर संलग्न हैं । 4 एक लसीकावत् छोटि “लिम्फ नोड के बुनियादी संरचनात्मक और कार्यात्मक इकाई है” और कूप, एक गहरी cortical इकाई से बना है, और दिमाग़ी डोरियों और साइनस4 (आंकड़ा 1a) । बी और टी लिम्फोसाइटों क्रमशः रोम और गहरी cortical इकाइयों के लिए घर हैं । इन संरचनाओं एक 3 डी पाड़ प्रदान और लिम्फोसाइटों और प्रतिजन या प्रतिजन पेश कोशिकाओं के बीच बातचीत की सुविधा ।
मोटे तौर पर, रोम और गहरी cortical इकाइयों में कटौती की सतह पर पहचाना जा सकता है क्योंकि वे एक सघन जालीदार meshwork होते है और साइनस की तुलना में गहरा दिखाई देते हैं, जो एक अधिक नाजुक जालीदार meshwork के शामिल होते है और हल्का दिखाई देते है (चित्र 1b) । कंवेंशन के द्वारा, पैथोलॉजिस्ट लिम्फ नोड्स के क्षेत्रों को सतही प्रांतस्था (रोम), paracortex (डीप cortical यूनिट्स) और मज्जा (दिमाग़ी डोरियों और साइनस) के रूप में संदर्भित करते हैं । सभी तीन क्षेत्रों की एक उचित परीक्षा लिम्फ नोड्स के लिए नियमित रोग परीक्षा दिशा निर्देशों में सबसे अच्छा अभ्यास के रूप में माना गया है5. ध्यान दें कि वहां स्थिरता, आकार, और लिम्फ नोड्स के रंग में काफी भिंनता है, यहां तक कि एक जानवर के भीतर । जानवरों की उम्र के रूप में, उनके लिम्फ नोड्स आकार में कमी और छोटे जानवरों की तुलना में मजबूत हो जाते हैं, आम तौर पर उनके संयोजी ऊतक में वृद्धि और सामान्य लसीकावत् संरचना6,7की कमी की वजह से हो जाएगा ।
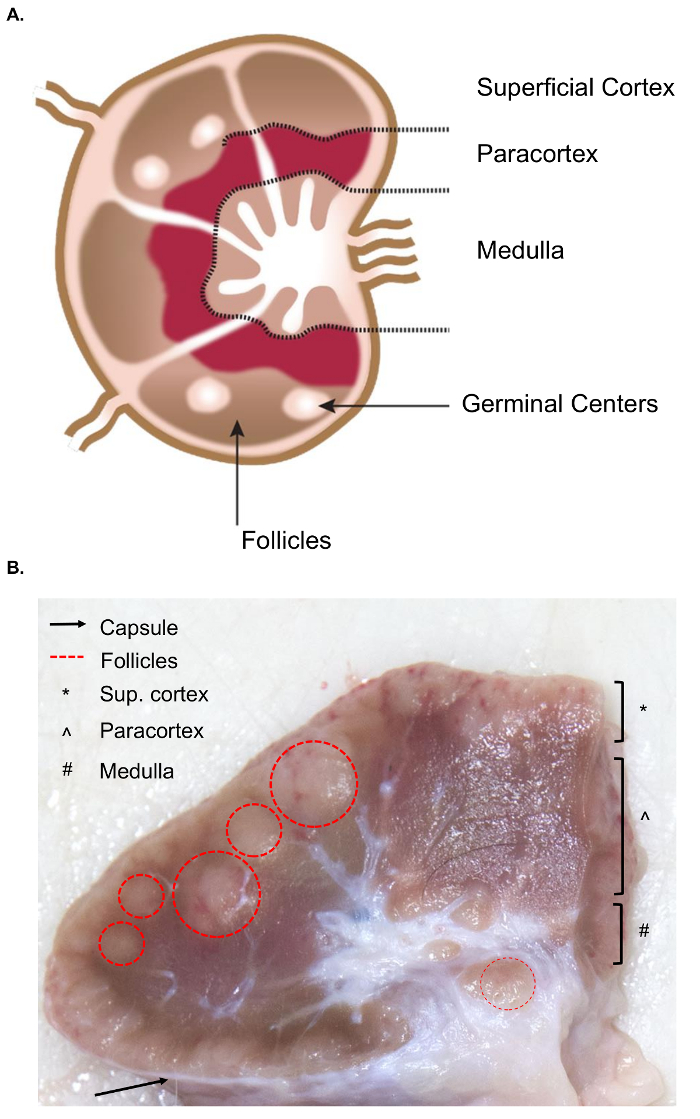
चित्र 1. लिम्फ नोड के एनाटॉमी। (क) इस कार्टून छवि लिम्फ नोड के एनाटॉमी से पता चलता है, कुंजी संरचनाओं का चित्रण. (ख) यह अभी भी छवि पार अनुभाग में एक गोजातीय लिम्फ नोड में कटौती से पता चलता है । नग्न आंखों को दिखाई दे रहे है कि प्रासंगिक संरचनाओं/ कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
प्रयोगात्मक प्रश्न के आधार पर, विभिन्न लिम्फ नोड्स संग्रह और विश्लेषण के लिए ब्याज की होगी । परिधीय लिम्फ नोड्स चमड़े के नीचे के ऊतकों में गहरे स्थित हैं । पशु, परिधीय या सतही लिम्फ नोड्स में अक्सर नैदानिक और प्रयोगात्मक अभ्यास में इस्तेमाल कर्णमूल, अवअधोहनुज, retropharyngeal, prescapular, prefemoral (precrural) और सतही वंक्षण (महिलाओं में supramammary, पुरुषों में अंडकोषीय) शामिल हैं ( चित्र 2) । तालिका 1में, कुंजी सतही लिम्फ नोड्स के गुण, पशु प्रणाली8में वर्णित के रूप में, उल्लिखित हैं । नीचे, मवेशियों के संक्रामक जीवाणु रोगों के लिए कुछ संभावित लिम्फ नोड संग्रह की योजना जांच के लिए एक प्रारंभिक बिंदु के रूप में प्रस्तुत कर रहे हैं ।
ब्रूसेला abortus/ब्रूसेला melitensis: b. necropsiesके लिए मानक abortus-संक्रमित मवेशी और बी. melitensis-संक्रमित बकरी को राष्ट्रीय पशु रोग केंद्र में पुनर्प्राप्त supramammary, prescapular, और कर्णमूल लिम्फ नोड ऊतक , दोनों जीवाणु गणन के लिए पीसने के लिए और आरएनए तैयारी के लिए मेजबान आरएनए अभिव्यक्ति की रूपरेखा के लिए । B. abortus नियमित रूप से इन लिम्फ नोड्स में से प्रत्येक में प्रयोग किया जाता संक्रमित मवेशी9बरामद कर सकते हैं। इन लिम्फ नोड प्रकार में से प्रत्येक में बैक्टीरिया की उपस्थिति का पता लगाया जा सकता है B. melitensis-संक्रमित बकरियों में से कम नौ महीने के बाद, हमारी पढ़ाई (Boggiatto एट अल., अप्रकाशित) से आरएनए-आधारित तरीकों का उपयोग कर संक्रमण । साल्मोनेला एसपी.: prescapular, subiliac (prefemoral), और mesenteric लिम्फ नोड्स एक साल्मोनेला प्रसार के लिए10,11,12 और के लिए मवेशी लावे की रूपरेखा के दौरान उपयोगी हो गया है transcriptomic अध्ययन के लिए संभावित ब्याज की होगी । ई. कोलाई O157: H7: Mesenteric लिम्फ नोड्स (मध्य छोटी आंत और बाहर की छोटी आंत स्थानों पर) संक्रमित बछड़ों में जीवाणुओं की एक सामयिक वसूली की साइटों हो सकता है (लेकिन संक्रमित वयस्क मवेशियों में नहीं)13. लेप्टोस्पायरोसिस (Leptospira sp.): बैक्टीरिया की एक पुरानी दृढ़ता स्तन ग्रंथि14draining लिम्फ नोड्स में मनाया गया है । माइकोबैक्टीरियम bovis : मवेशियों में बैक्टीरिया mediastinal और बछड़ों के tracheobronchial लिम्फ नोड्स15से प्रायोगिक संक्रमण के बाद बरामद किया गया है । इसके अतिरिक्त, लिम्फ नोड आरएनए वायरस के लिए बड़े पशु मेजबान प्रतिक्रियाओं की जांच करने के लिए उपयोग किया गया है, जैसे सुअर का प्रजनन और श्वसन सिंड्रोम वायरस 2. चित्रा 2 पशु शरीर में इन प्रमुख लिम्फ नोड्स के एक सबसेट के स्थान को दर्शाया गया है ।
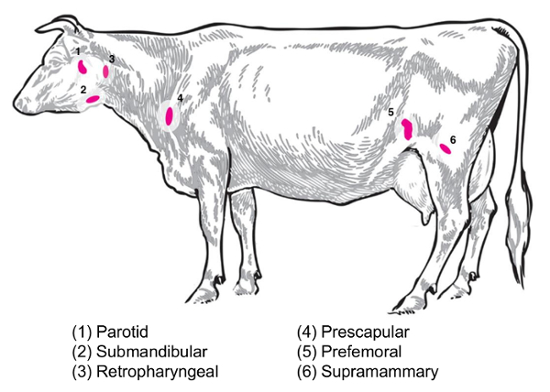
चित्र 2: में चयनित लिम्फ नोड स्थानों चित्रण कार्टून Bos वृषभ . गिने लिम्फ नोड्स व्याख्या कर रहे हैं । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
इस पत्र में और संबंधित वीडियो, हम आरएनए अध्ययन के लिए बड़े जानवर लिम्फ नोड्स के अलगाव के लिए एक प्रोटोकॉल मौजूद है, बड़े पशुओं के संक्रमण के transcriptomic अध्ययन में शामिल आणविक जीव के लिए जानकारीपूर्ण डिजाइन । सबसे पहले, हम लिम्फ नोड्स के लिए अलगाव प्रक्रिया का एक सिंहावलोकन प्रदान करते हैं, उदाहरण के रूप में गोजातीय और जंगली भैंसों के ऊतकों से नमूने का उपयोग । इस प्रदर्शन के साथ युग्मित, के रूप में वीडियो में प्रदर्शित, आरएनए अलगाव के लिए एक reproducible ऊतक नमूने के लिए एक कार्यप्रवाह है. अगला, हम एक संक्रमित लिम्फ नोड के प्रसंस्करण के लिए महत्वपूर्ण बातों का वर्णन, सुरक्षा पर ध्यान देने के साथ, निरंतरता, और आरएनए गुणवत्ता.
एक acidified phenol-guanidine isothiocyanate रिएजेंट के साथ ऊतक से आरएनए की तैयारी Chomczynski और Sacchi की मूल विधि पर आधारित है16,17, की उपस्थिति में सिलिका आधारित स्पिन स्तंभों पर एक शुद्धि के साथ chaotropic एजेंटों के मूल काम पर आधारित Vogelstein और गिलेस्पी18. हम भी transcriptomics के लिए पशु लिम्फ नोड्स वैकल्पिक तरीकों द्वारा संरक्षित से आरएनए की वसूली के लिए क्षमता की जांच । अंत में, हम बड़े पशु necropsies में आरएनए गुणवत्ता पर समय चर के प्रभाव का पता लगाने, एक प्रतिनिधि प्रयोग इच्छामृत्यु और जंगली भैंसों से बरामद आरएनए प्रोफ़ाइल पर नमूने के बीच समय में वृद्धि के प्रभाव को चित्रित करने सहित गोजातीय लिम्फ नोड्स । यह लेख न केवल आणविक जीव के लिए उपयोगी होगा, लेकिन यह भी पशु चिकित्सा शोधकर्ताओं को transcriptomic अध्ययन केसाथ ।
Protocol
Representative Results
Discussion
transcriptomic अध्ययन के बहुमत और संबद्ध प्रोटोकॉल माउस, चूहा, या पोस्टमार्टम मानव नमूने पर ध्यान केंद्रित । हालांकि, पशुधन और वंय जीवन में जांच रोग के लिए प्रतिरक्षा प्रतिक्रिया के लक्षण वर्णन के लिए अवसरों की…
Disclosures
The authors have nothing to disclose.
Acknowledgements
लेखक सभी वीडियोग्राफी और वीडियो प्रसंस्करण पर अपने उत्कृष्ट काम के लिए जेंस फॉस शुक्रिया अदा करना चाहते हैं; माइकल डिजीटल पशु छवियों की पीढ़ी में अपने उत्कृष्ट काम के लिए मारति; आरएनए निष्कर्षण और विश्लेषक रन के साथ उसकी मदद के लिए लिलिया वाल्थर; मिच पामर और Carly Kanipe उनके उपयोगी समीक्षा और लिम्फ नोड छवियों पर प्रतिक्रिया के लिए; और पशु देखभाल और उनकी कड़ी मेहनत और पशुपालन और necropsies के लिए तैयार करने के साथ सहायता के सभी के लिए राष्ट्रीय पशु रोग केंद्र में पशु चिकित्सा स्टाफ ।
Materials
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
References
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).

