Titrering ELISA som en metod för att bestämma konstanten Dissociation av Receptor Ligand interaktion
Summary
Ett detaljerat protokoll för att utföra en titrering ELISA beskrivs. Dessutom presenteras en ny algoritm att utvärdera titrering ELISA-test och få en dissociationskonstant bindning av ett lösligt ligand till en mikrotiter plattan-orörlig receptor.
Abstract
Dissociationskonstant beskriver samspelet mellan två partner i den bindande jämvikten och är ett mått på deras affinitet. Det är en avgörande parameter att jämföra olika ligander, t.ex., konkurrenskraftiga hämmare, protein isoformer och mutanter, för sin bindande styrka till en bindande partner. Dissociation konstanter bestäms av plottning koncentrationer av bundna kontra fria liganden som bindande kurvor. Titrering kurvor, där en signal som är proportionell mot koncentrationen av bundna ligand plottas mot den totala koncentrationen av extra ligand, är däremot mycket lättare att spela in. Signalen kan upptäckas spectroscopically och av enzyme-linked immunosorbent assay (ELISA). Detta exemplifieras i ett protokoll för en titrering ELISA som mäter bindningen av den snake venom-derived rhodocetin till dess immobiliserade måldomän för α2β1 integrin. Titrering ELISAs är mångsidiga och utbredda. Något par av samverkande proteiner kan användas som immobiliserade receptor och lösliga ligand, förutsatt att båda proteiner är ren, och deras koncentrationer är kända. Svårigheten har hittills varit att avgöra dissociationskonstant från en Titrerkurvan. I den här studien introduceras en matematisk funktion som underliggande titrering kurvor. Utan någon felbenägen grafiska uppskattning av en mättnad avkastning tillåter denna algoritm bearbetning av raw-data (signal stödnivåer vid olika koncentrationer av extra ligand) direkt av matematiska utvärdering via icke-linjär regression. Således flera titrering kurvor kan registreras samtidigt och omvandlas till en uppsättning av karakteristiska parametrar, bland dem dissociationskonstant och koncentrationen av bindande-aktiv-receptorn, och de kan utvärderas statistiskt. Kombination med denna algoritm, titrering ELISAs få fördelen att direkt presentera dissociationskonstant. Därför kan de användas mer effektivt i framtiden.
Introduction
Dissociationskonstant K är en viktig parameter att beskriva en receptor (R) affinitet för dess ligand (L). Baserat på lagen i massa åtgärder, definieras K för equilibriumen, där receptor-ligand komplexa RL dissocierar i receptorn R och liganden L:
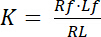 Ekvation 1
Ekvation 1
med index f som visar gratis/unbound delstaten receptor och ligand. Koncentrationen av receptor-ligand komplexet, RL, är identisk med koncentrationen av receptor-bundna ligand Lb. Som den totala koncentrationen av receptorn Rt är summan av den gratis receptorn Rf och ligand-bundna receptorn Rb = Lb, dissociationskonstant kan också skrivas som:
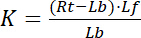 Ekvation 2
Ekvation 2
Därför mättnad avkastning Y, definierad som andelen bundna ligand Lb i förhållandet av den totala koncentrationen av receptorn Rt,
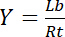 Ekvation 3
Ekvation 3
beror på koncentrationen av fria liganden Lf:
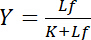 Ekvation 4
Ekvation 4
Denna hyperbolisk beskriver bindande kurvan för en receptor-ligand interaktion och sin tomt visar koncentrationen av bundna ligand Lb som funktion av koncentrationen av fria liganden Lf. Från kurvan är bindande, kan dissociationskonstant K härledas som koncentrationen av fria liganden på halv maximal mättnad yield. Dessutom har olika algoritmer till linjär bindande kurvor fastställts, såsom dubbel-ömsesidiga tomten av Klotz1,2, eller transformationer enligt mikrosatellitsmarkörer eller Hanes (granskas av Bisswanger3). Dock lider alla algoritmer av problem som det högsta värdet av mättnad avkastningen, som att närma sig asymptotiskt vid höga koncentrationer av gratis ligand i bindande kurvan, har uppskattas i en grafisk före utvärdering och därför är fel-benägen.
Dessutom, kräver fastställande av en bindande kurva kvantifiering av fria och bundna ligand under bindande equilibriumen. För detta ändamål har den fria liganden avskiljas från den receptor-bundna liganden och kvantifieras. Därför har den ligand och receptor skiljer sig i deras egenskaper, till exempel en icke-protein ligand i motsats till en protein receptor. Om parterna bindande proteiner, måste de vara distinguishable i deras storlek, avgifter eller andra molekylär funktioner. Kvantifiering av liganden koncentrationer i småskaliga bindande metoder är dock en svår uppgift. Radioaktiv märkning av liganden har ofta varit nödvändig för att upptäcka den låga koncentrationen av bundna ligand, särskilt om stora mängder receptorer inte var tillgängliga eller prisvärda. Dessutom kan den receptor-bundna liganden separera under och efter isolering i en icke försumbar sätt. Komplexa metoder, såsom jämvikt gel filtrering4, kapillärelektrofores5och puls proteolys6, krävs därför att kvantifiera receptor-bundna ligand och skilja det från gratis ligand.
I motsats till dessa bindande analyser kräver titrering experiment inte kvantitativa separation av bundna och fria liganden. I detta syfte titreras en receptor på en konstant koncentration med olika koncentrationer av extra ligand. Genom bindning till receptorn har den bundna liganden biofysiska egenskapen som skiljer den från den fria liganden och är mätbara genom, t.ex., fotometri, fluorometry eller påvisande av antikroppar. Således en signal S, som är proportionell till mättnad avkastning Y och följaktligen också i koncentrationen av receptor-bundna ligand (Lb), identifieras som en funktion av den totala koncentrationen av extra ligand (Lt). Både parametrar, signalen S och den totala koncentrationen av extra ligand är kvantifierade på ett direkt och enklare sätt än koncentrationerna av bundna och fria liganden. Särskilt, tillåtna detektion av receptor-bundna ligand av enzyme-linked immunosorbent assay (ELISA) minskning av provvolymer till under 100 µL samt parallella mätningar av flera ligand koncentrationer i flera mikrotiter plattor. I en titrering ELISA, är en receptor fysiskt adsorberas till en mikrotiterplattan i samma koncentration och titreras med lösliga ligand. Receptorn är orörlig till plastytan i huvudsak genom hydrofob adsorption. Yta koncentrationen av immobiliserade receptor korrelerar med beläggning koncentrationen av receptorn i en ickelinjär relation, sannolikt enligt Langmuir´s adsorption isotherm7. Förutom det totala antalet adsorberade mottagarmolekyler är deras aktivitetsläge en annan viktig parameter för titrering analyser. Endast orörlig receptorer som har behållit ligand bindande aktivitet, är relevanta för titrering analysen och så småningom bidra till den totala koncentrationen av aktiva receptorer Rt titrering analysens, som inte kan fastställas direkt.
Platser på plastytan, som inte omfattas av immobiliserade receptorn är benägna att adsorbera andra proteiner, såsom liganden. Fysiska adsorption av liganden till sådan plast yta webbplatser skulle resultera i en liknande signal som den receptor-bundna liganden, men på ett sätt som ospecifik. Att minska denna ospecifik signal, plast yta platserna av de mikrotiter plattor som inte har varit belagd med protein men blockeras med bovint serumalbumin (BSA). Dock för vissa receptor-ligand titrering analyser, kan ospecifik bakgrund signaler observeras. Då, andra blockerande medel, såsom en lösning på 0,2% gelatin eller 0,04% Tween 20, rekommenderas.
Efter bindning till receptorn avlägsnas den fria liganden av två tvätt steg. Bundna ligand förblir med receptorn, som är orörlig på plast ytan av mikrotiter brunnen, och eventuellt förstärkt av kemiska fixering. För efterföljande kovalent cross-sammanlänkningen av bundna ligand och immobiliserade receptor med glutaraldehyd, buffert ämnet TRIS ersätts för HEPES, utan någon förändring i liganden bindande. HEPES, i motsats till TRIS, inte inaktivera glutaraldehyd. Kovalent cross-länkaget med glutaraldehyd fixar den bundna liganden med dess receptor och förhindrar dess dissociation under efterföljande tvättning och inkubation steg. Således, receptor-ligand interaktionen är kemiskt fryst och garanterar en Titrerkurvan som är opåverkad av efterföljande steg tvätt och inkubation. Glutaraldehyd fixering kan dock kemiskt ändra ligand och receptor på ett sådant sätt att deras interaktion är sänktes eller avskaffades. Ändring av epitoper inom liganden kan dessutom ändra bindande affinitet upptäcka antikroppen, särskilt om en monoklonal antikropp används för att kvantifiera bundna ligand. Även om ingen av dessa negativa effekter av glutaraldehyd fixering sker i denna titrering ELISA, måste känsligheten hos testet mot glutaraldehyd testas för varje receptor-ligand interaktion före titrering experimentet. Efter fixering avlägsnas överflödigt glutaraldehyd i tre tvätt steg med innehållande TRIS buffert. TRIS inactivates återstående aldehyd-grupper, som nonspecifically kan reagera med påvisande av antikroppar i efterföljande steg.
Mängden bundna ligand kvantifieras med enzymkopplad antikroppar, som ger en fotometriska ELISA signal S. Detta är plottade kontra den totala ligand koncentration Lt lagt till varje brunn. Trots dess lättare förvärv är Titrerkurvan inte en hyperbolisk funktion i motsats till bindande kurvan. Dessutom att det har varit oklart hur man beräknar dissociationskonstant K från en Titrerkurvan. Även om algoritmer till linjär spectroscopically förvärvade titrering kurvor har rapporterats självständigt av Stockell8 och Heyn och Weischet9, de föll kort på grund av deras osäkerhet för att beräkna den maximala signalen värde som den mättnad avkastning metoder vid höga koncentrationer av extra ligand.
Här, som en titrering ELISA och en icke-linjär regression algoritm beskrivs att härleda dissociationskonstant K för en receptor ligand interaktion från en Titrerkurvan. Detta protokoll exemplifieras för samspelet mellan kollagen bindande A-domänen för den integrin α2β1 med en snake venom-derived hämmare. Integriner är Celladhesionmolekylar, som medlar ankringen av celler till omgivande extracellulärmatrix eller underliggande basalmembranet10,11. Dessutom förmedla integriner viktiga signaler mellan celler och den extracellular matrisen genom att rekrytera ytterligare signalmolekyler och bildar nya cell organeller, adhesomes, på cell-matrix interaktion12,13, 14. kollagen, liganden av α2β1-integrin, är det mest förekommande proteinet i den mänskliga kroppen och är en avgörande byggnadsställningar komponent av bindväv15. Samspelet mellan α2β1-integrin och kollagen medieras av A-domänen för den integrin α2 subuniten. Integrin α2A-domänen innehåller en tvåvärda cation, som krävs för kollagen bindande och stabiliserar dess struktur. Såväl vildtyp form som mutanter av α2A domänen, till exempel där ytan-utsatt återstoden Y216 hade ersatts för en glycin, kan enkelt recombinantly som produceras i en bakteriell uttryck systemet och isolerade via deras oligo-hans-Taggar med en NiNTA Superflow kolumn med en efterföljande dialys mot TRIS-buffrad koksaltlösning (TBS; 50 mM TRIS/HCl, pH 7,4, 150 mM NaCl) innehållande 2 mM MgCl216. Deras koncentrationer bestämdes med bicinchoninic syra analys (BCA) och deras föroreningar är testade av konventionella SDS-PAGE och fläckade Coomassie-lysande blå R250.
Samspelet mellan α2β1-integrin och kollagen blockeras genom bindning av komponenten venom snake, rhodocetin, från Malayan pit viper (Calloselasma rhodostoma)16,17. Används som en löslig ligand i denna titrering ELISA, rhodocetin renades från rå venom som tidigare beskrivits16. Det löses i HEPES-buffrad koksaltlösning (HBS; 10 mM HEPES/NaOH, pH 7,4, 150 mM NaCl) och förvaras fryst vid-20 ° C. Dess koncentration bestämdes av BCA och dess renhet bevisades av SDS-PAGE. Som en antagonist, rhodocetin inte bara blockerar kollagen bindande till integrin α2β1 A-domän, men också stabiliserar inaktiva konformation av integrin vilket hindrar någon signalering från kollagen i blodkroppar eller blodplättar18. Det är av stor biomedicinsk betydelse Bestäm konstanten dissociation av rhodocetin med dess receptor mål och därmed avslöja dess molekylära mekanism och farmaceutiska potentiella t.ex., som ett antitrombosmedel. För detta ändamål, en titrering ELISA beskrivs inklusive dess utvärdering, som är tillämpligt till nästan alla receptor-ligand interaktion med en 1:1 interaktion stökiometri.
Protocol
Representative Results
Discussion
Titreringen ELISA är ett mångsidigt testsystem att bestämma dissociationen av en receptor-ligand interaktion. Som titreringen ELISA kringgår behovet att skilja fri och bunden ligander effektivt och att analysera deras koncentrationer kvantitativt sett betydligt fler studier och publikationer har sysselsatt titrering ELISAs istället för inspelning bindande kurvor . Dessutom titrering ELISAs är lätta att utföra och kräver relativt låga mängder receptor och ligand. För exakt analys av dissociation konstanter, m…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Protokoll och algoritmen utvecklades inom ett projekt som finansieras av den Deutsche Forschungsgemeinschafts (DFG grant SFB1009 A09 och EB177/13-1). Författaren tack Barbara Schedding och Felix Schmalbein för teknisk support och Dr Niland för att kritiskt läsa manuskriptet.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

