Titrasyon ELISA reseptör Ligand etkileşim ayrışma sabiti belirlemek için bir yöntem olarak
Summary
Titrasyon ELISA gerçekleştirmek için detaylı bir protokol açıklanmıştır. Ayrıca, yeni bir algoritma titrasyon ELISAs değerlendirmek için ve plaka immobilize microtiter reseptör için çözünür bir ligand bağlayıcı bir ayrışma sabiti edinmek için sunulmaktadır.
Abstract
Ayrışma sabiti bağlama denge iki ortağı arasındaki etkileşim açıklar ve onların ilgi bir ölçüsüdür. Farklı ligandlar, örneğin, rekabetçi inhibitörleri, protein izoformlarının ve mutantlar için bağlama güçlerini bağlama ortağa karşılaştırmak için çok önemli bir parametredir. Ayrılma sabitler ilişkili karşı ücretsiz ligand konsantrasyonu olarak bağlama eğrileri komplo tarafından belirlenir. Buna ek olarak, ilişkili ligand konsantrasyonu orantılı bir sinyal eklenen ligand, toplam konsantrasyonu karşı çizilen titrasyon eğrileri kaydetmek çok daha kolaydır. Sinyal spectroscopically ve enzim bağlı immunosorbent assay (ELISA) tarafından tespit edilebilir. Bu bir titrasyon yılan zehri elde edilen rhodocetin α2β1 Integra, onun immobilize hedef etki alanına bağlama ölçer ELISA için bir protokol içinde örneklenir. Titrasyon ELISAs çok yönlü ve geniş kullanılmış. Herhangi bir çiftini etkileşen proteinlerin immobilize reseptörü ve çözünür ligand her iki protein saf ve onların konsantrasyonları bilinen koşuluyla kullanılabilir. Zorluk defa ayrışma sabiti titrasyon eğrisi üzerinden belirlemek olmuştur. Bu çalışmada, titrasyon eğrileri altta yatan bir matematiksel işlev giriliyor. Bir doygunluk verim herhangi bir hataya grafik tahmini, bu algoritma doğrusal olmayan regresyon ile matematiksel değerlendirme tarafından doğrudan ham veri (sinyal kırmızının koyulukları eklenen ligand farklı konsantrasyonlarda) işleme izin verir. Böylece, birkaç titrasyon eğrileri aynı anda kaydedildi ve aralarında ayrışma sabiti ve bağlama-aktif reseptör, konsantrasyon karakteristik parametreleri kümesini haline dönüştürdü ve istatistiksel olarak değerlendirilebilir. Bu algoritma ile birleştirildiğinde, titrasyon ELISAs doğrudan ayrışma sabiti sunma avantajı kazanmak. Bu nedenle, onlar daha verimli bir şekilde gelecekte kullanılabilir.
Introduction
Ayrışma sabiti K bir reseptör (R) benzeşim onun ligand (L) açıklamak için önemli bir parametredir. Kitlesel eylem hukuk üzerinde bağlı olarak, K içinde Reseptör-ligand karmaşık RL R reseptörü ve ligand L: ayrışıp denge için tanımlanan
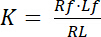 Denklem 1
Denklem 1
reseptör ve ligand ücretsiz/ilişkisiz durumunu gösteren endeksi f ile. Reseptör-ligand kompleks RL, konsantrasyon reseptör bağlı ligand Lbkonsantrasyon için aynıdır. Reseptör Rt toplam konsantrasyonu ücretsiz reseptör Rf ve ligand bağlı reseptör Rb toplamı olarak = Lb, ayrışma sabiti olarak da yazılabilir:
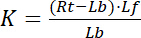 Denklem 2
Denklem 2
Bu nedenle, doygunluk ilişkili ligand Lb reseptör Rttoplam konsantrasyonu ilişkisi kesir olarak tanımlanmış Y, verim,
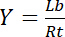 Denklem 3
Denklem 3
Ücretsiz ligand Lfkonsantrasyon üzerinde bağlıdır:
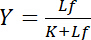 Denklem 4
Denklem 4
Hiperbolik bu ilişki bir Reseptör-ligand etkileşim bağlama eğriyi tanımlayan ve onun arsa ilişkili ligand Lb toplama ücretsiz ligand Lfkonsantrasyonu bir fonksiyonu olarak gösterir. Bağlama eğrisi ayrışma sabiti K, yarı-azami doygunluk verim ücretsiz ligand konsantrasyonu olarak elde edilebilir. Ayrıca, bağlama eğrileri linearize farklı algoritmaları, gibi çift karşılıklı arsa Klotz1,2veya Scatchard veya Hanes (Bisswanger3tarafından gözden) göre dönüşümleri tarafından kurulmuştur. Ancak, tüm algoritmaları asimptotik ücretsiz ligand bağlayıcı eğri yüksek konsantrasyonlarda yaklaştı doygunluk verim maksimum değeri bir grafik öncesi değerlendirilmesinde tahmin edilecek sahip ve bu nedenle sorunu muzdarip hataya.
Buna ek olarak, bir bağlama eğrisi belirlenmesi ücretsiz ve ilişkili ligand miktar sırasında bağlama denge gerektirir. Bu amaçla, ücretsiz ligand reseptör bağlı ligand ayrılmış ve sayısal gerekiyor. Bu nedenle, ligand ve reseptör protein ligand olarak karşı bir protein reseptörü gibi özellikleri, farklı gerekir. Her iki bağlama ortak proteinler ise, kendi boyutları, ücret veya diğer moleküler özellikleri ayırt olmak zorundalar. Yine de, küçük ölçekli bağlama yaklaşımlar konsantrasyonlarda ligand miktar zor bir iştir. Özellikle reseptörleri önemli miktarda kullanılabilir veya uygun olmasa radyoaktif ligand etiketleme genellikle ilişkili ligand, düşük yoğunlukta algılamak gerekli oldu. Ayrıca, reseptör bağlı ligand-ihmal edilebilir bir şekilde sırasında ve sonrasında yalıtım ayırmak. Bu nedenle, denge jel filtrasyon4, Kapiler Elektroforez5ve nabız proteolizis6, gibi karmaşık yöntemler reseptör bağlı ligand ölçmek ve ücretsiz ligand ayırmak için gereklidir.
Bu bağlama deneyleri aksine titrasyon deneyler ilişkili ve ücretsiz ligand nicel ayrılması gerek yoktur. Bu amaçla, bir reseptör sabit bir konsantrasyon, eklenen ligand farklı konsantrasyonları ile titre. Reseptör için bağlama tarafından ilişkili ligand ücretsiz ligand ayıran ve örneğin, fotometri, fluorometry veya antikor algılama, ölçülebilir biyofiziksel bir özelliğe sahiptir. Böylece, bir sinyal ile doygunluğu ile doğru orantılıdır S Y verim ve sonuç olarak da reseptör bağlı ligand (Lb) konsantrasyon için eklenen ligand (Lt) toplam konsantrasyonu bir fonksiyonu olarak algılanır. Parametreleri, sinyal S ve eklenen ligand toplam konsantrasyonu ilişkili ve ücretsiz ligand konsantrasyonu daha doğrudan ve kolay bir şekilde sayılabilir. Özellikle, reseptör bağlı ligand enzim bağlı immunosorbent assay (ELISA) tarafından algılanmasını 100 µL aşağıda örnek birimlere azaltılması yanı sıra birkaç ligand konsantrasyonu paralel ölçümleri çok iyi microtiter levha izin. Bir titrasyon ELISA, bir reseptör fiziksel olarak aynı toplama bir microtiter plaka adsorbe ve çözünür ligand ile titre. Reseptör plastik yüzeye aslında hidrofobik adsorpsiyon tarafından immobilize. İmmobilize reseptör ilişkilendirir yüzey konsantrasyon reseptör Langmuir´s adsorpsiyon izoterm7göre muhtemel bir doğrusal olmayan ilişkide kaplama konsantrasyonu ile. Genel adsorbe reseptör molekülleri ek olarak, etkinlik durumlarına titrasyon deneyleri için başka bir önemli parametre sayısıdır. Sadece hangi ligand bağlayıcı faaliyet korunur, titrasyon tahlil için uygundur ve sonunda etkin reseptörleri Rt doğrudan belirlenemez titrasyon testin toplam konsantrasyonu katkıda reseptörleri immobilize.
İmmobilize reseptör tarafından kapsanmayan siteleri plastik yüzeyi ligand gibi diğer proteinler absorbe yatkındır. Tür plastik yüzey sitelerde ligand fiziksel adsorpsiyon reseptör bağlı ligand olarak benzer bir sinyal, henüz belirsiz bir şekilde sonuçlanır. Bu nonspesifik sinyal plastik yüzey siteleri hangi protein ile kaplı değil henüz sığır serum albumin (BSA)-ecek var olmak kütük parçası microtiter plakaların azaltmak için. Ancak, bazı Reseptör-ligand titrasyon deneyleri için spesifik olmayan arka plan sinyalleri gözlenen. O zaman, engelleme diğer ajanlar gibi bir çözüm % 0,2 jelatin veya %0,04 ara 20, önerilir.
Reseptör için bağlama sonra ücretsiz ligand tarafından iki çamaşır adımı kaldırılır. Microtiter iyi plastik yüzeye immobilize ve isteğe bağlı olarak kimyasal fiksasyonu tarafından güçlendirilmiş reseptör ile ilişkili ligand kalır. Sonraki kovalent çapraz-bağlantı için ilişkili ligand ve oxazolidin ile immobilize reseptör arabellek madde TRIS ligand bağlayıcı herhangi bir değişiklik olmadan HEPES için değiştirilir. TRIS, aksine HEPES oxazolidin devre dışı değil. Oxazolidin ile kovalent çapraz bağlantı ile onun reseptör ilişkili ligand giderir ve onun ayrılma sonraki çamaşır ve kuluçka adımları sırasında engeller. Böylece, Reseptör-ligand etkileşimi kimyasal dondurulur ve çamaşır ve kuluçka sonraki adımlarla etkilenmez bir titrasyon eğrisi garanti eder. Ancak, oxazolidin fiksasyon kimyasal olarak ligand ve reseptör etkileşimlerini azaltılmış veya kaldırılmış şekilde değiştirebilir. Ayrıca, özellikle Monoklonal antikor ilişkili ligand ölçmek için kullanılıyorsa epitopları ligand içinde değişiklik algılama antikor bağlama benzeşme değişebilir. Oxazolidin fiksasyon bu olumsuz etkilerin ikisi de bu titrasyon ELISA oluşmakla birlikte, test oxazolidin karşı duyarlılığını titrasyon deney öncesinde her Reseptör-ligand etkileşim için test edilmelidir. Fiksasyon sonra aşırı oxazolidin TRIS içeren bir arabellek ile üç yıkama adımda kaldırılır. TRIS nonspecifically antikorlar sonraki adımda algılama ile tepki kalan aldehit gruplarını inaktive.
Fotometrik ELISA sinyal S. sağlayan enzim bağlı antikorlar ile ilişkili ligand miktarını sayısal Bu eklenen toplam ligand konsantrasyonu Lt karşı çizilir her şey için. Onun daha kolay satın alma rağmen titrasyon eğrisi hiperbolik işlevi bağlama eğrisi aksine değil. Ayrıca, nasıl bir titrasyon eğrisi üzerinden ayrışma sabiti K hesaplamak için belli olmuştur. Algoritmalar spectroscopically Edinsel titrasyon eğrileri linearize bağımsız olarak Stockell8 ve Hey ve Weischet9tarafından bildirilmiştir rağmen yüksek sinyal tahmin onların belirsizlik nedeniyle yetersiz kalmışlar değeri doygunluk verim eklenen ligand yüksek konsantrasyonları yaklaşıyor.
Burada, bir titrasyon ELISA ve doğrusal regresyon algoritması titrasyon eğrisi Reseptör ligand müdahalesini ayrışma sabiti K türetmek açıklanmıştır. Bu protokol ile bir yılan zehri elde edilen inhibitörü kollajen bağlayıcı A-etki integrin α2β1, etkileşim için örneklenir. İntegrinler hücrelerin etrafındaki hücre dışı matriks veya temel membran10,11anchorage aracılık hücre adezyon molekülleri vardır. Ayrıca, ek moleküller sinyal ve yeni hücre organelleri, adhesomes, hücre-matris etkileşim12,13, üzerine şekillendirme işe integrinler hücreleri ve hücre dışı matriks arasında önemli sinyalleri iletmek 14. kollajen, α2β1 Integra, ligand insan vücudunun en bol protein ve bağ dokusu15önemli iskele bileşenidir. Α2β1 integrin ve kollajen arasındaki etkileşimi bir integrin α2 alt birimi A etki tarafından aracılık ettiği. İntegrin α2A-etki alanı, kollajen bağlama için gereklidir ve yapısını stabilize bir divalent ba * içerir. Mutantlar hangi biri gibi yüzey maruz kalan Y216 glycine için yerine α2A etki alanının yanı sıra yaban türü formlar kolayca recombinantly bir bakteriyel ifade sisteminde üretilen ve onların oligo-His-etiketleri ile bir NiNTA ile izole bir sonraki diyaliz TRIS arabelleğe alınmış serum (TBS; 50 mM TRIS/HCl, pH 7.4, 150 mM NaCl) içeren 2 mM MgCl216karşı montaj sütun. Bicinchoninic asit tahlil (BCA) ile onların konsantrasyonları belirlenmiştir ve onların eroine geleneksel SDS-PAGE tarafından test edilmiş ve Coomassie-parlak mavi R250 ile lekeli.
Α2β1 integrin ve kollajen arasındaki etkileşimi bağlama yılan zehri bileşeninin Malaya çukur engerek (Calloselasma rhodostoma)16,17rhodocetin tarafından engellendi. Bu titrasyon ELISA içinde çözünür bir ligand olarak kullanılan, rhodocetin ham saflaştırıldı16daha önce açıklandığı gibi zehir. HEPES arabelleğe alınmış serum (HBS; 10 mM HEPES/NaOH, pH 7.4, 150 mM NaCl) içinde çözünmüş ve -20 ° C’de dondurulmuş depolanır Onun konsantrasyonu BCA tarafından tespit edildi ve saflığı SDS-PAGE tarafından kanıtlanmış oldu. Bir antagonisti rhodocetin sadece kollajen için integrin bağlama engeller α2β1 A etki alanı, ama aynı zamanda böylece herhangi bir kollajen hücreleri ya da trombosit18sinyal önleme integrin etkin olmayan biçimi stabilize. Rhodocetin reseptör hedefine ile ayrışma sabiti belirlemek ve böylece onun moleküler mekanizması ve ilaç potansiyel örneğin, antitrombotik bir ajan olarak çözmek Biyomedikal büyük önem taşımaktadır. Bu amaçla, ELISA onun değerlendirme de dahil olmak üzere anlatılan bir titrasyon hangi bir 1:1 etkileşim stoichiometry ile hemen hemen her Reseptör-ligand etkileşim için geçerlidir.
Protocol
Representative Results
Discussion
Titrasyon ELISA Reseptör-ligand etkileşim ayrılma belirlemek için bir çok yönlü test sistemidir. Titrasyon ELISA ücretsiz ve ilişkili ligandlar etkili bir şekilde ayırmak için ve onların konsantrasyonları nicelik, çözümlemek için önemli ölçüde daha fazla çalışmalar zorunluluk kaçınmanızı sağlar ve yayınlar titrasyon ELISAs bağlama eğrileri kayıt yerine istihdam . Ayrıca, titrasyon ELISAs gerçekleştirmek ve reseptör ve ligand oldukça düşük miktarda gerektirir kolaydır. Ayrılma s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
İletişim kuralı ve algoritma Deutsche Forschungsgemeinschaft (DFG grant SFB1009 A09 ve EB177/13-1) tarafından finanse edilen bir proje içinde geliştirilmiştir. Yazar Barbara Schedding ve teknik destek için Felix Schmalbein ve Dr. eleştirel makale okumak için Niland teşekkürler.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

