قياس الضغط مراقب (SGM) "قياسات تثاءب صمام المستمر" في "الرخويات الصدفتين" في استجابة لنقص ركوب الدراجات "البحرية الناجمة عن المختبر" والأس الهيدروجيني
Summary
فهم الاستجابات السلوكية من مغذيات تعليق ذات الصدفتين للمتغيرات البيئية، مثل الأكسجين المذاب، ويمكن شرح بعض عمليات النظام الإيكولوجي. قمنا بتطوير جهاز قياس الضغط غير مكلفة، والمستندة إلى المختبر، (SGM) لقياس استجابات تثاءب صمام المحار، Crassostrea فيرجينيكا، إلى نقص ركوب الدراجات البحرية ودرجة الحموضة الدورية.
Abstract
ووضع مراقب تثاءب صمام مقياس الضغط غير مكلفة، والمستندة إلى المختبر، (SGM) لرصد سلوك تثاءب صمام الرخويات ذات الصدفتين في استجابة لنقص ركوب الدراجات البحرية. كان متصلاً جسر ويتستون الانفعال التي تم إرفاقها لاصداف المحار (Crassostrea فيرجينيكا). الإشارات المسجلة المسموح به لفتح وإغلاق ذات الصدفتين بتسجيلها بشكل مستمر على مدى فترات يومين المستحثة تجريبيا نقص ركوب الدراجات البحرية وركوب الدراجات البحرية التغيرات في درجة الحموضة. هنا، يمكننا وصف بروتوكول لتطوير جهاز قياس الضغط غير مكلفة ووصف، في تجربة مختبرية مثال، كيف يمكننا استخدامه لقياس سلوك تثاءب صمام الشرقية المحار (C. فيرجينيكا)، في استجابة لنقص ركوب الدراجات البحرية و التغيرات الدورية في الأس الهيدروجيني. وتم قياس صمام تثاءب على المحار التعرض للتقلبات الدورية الحادة التاكسج (0.6 مغ/لتر) حلت ظروف الأوكسجين مع أو بدون تغييرات دورية في الأس الهيدروجيني ودورية خفيفة التاكسج (1.7 مغ/لتر) ظروف وشروط نورموكسيك (7.3 مغ/لتر). نظهر أن عندما تواجه المحار دورات البحرية المتكررة، أنهم سريعاً على قذائف في استجابة لنقص شديد أغلق ومع فارق زمني لنقص معتدل. عندما يتم استعادة نورموكسيا، سرعة فتح مرة أخرى. لم يستجب المحار لظروف الأس الهيدروجيني الدورية فرضه على البحرية ركوب الدراجات نقص شديد. في ظروف انخفاض الأكسجين، وأكثر من ثلث المحار مغلقة في وقت واحد. علينا أن نظهر أن المحار الاستجابة لنقص ركوب الدراجات البحرية، التي يجب مراعاتها عند تقييم سلوك ذات الصدفتين للأكسجين الذائب. صمام SGM يمكن استخدامها لتقييم استجابات الرخويات ذات الصدفتين للتغييرات في الأوكسجين الذائب أو الملوثات. ختم تقنيات لختم أفضل صمام تثاءب الانفعال من مياه البحر بحاجة إلى مزيد من التحسين لزيادة طول العمر من أجهزة الاستشعار.
Introduction
نقص، أي حل تركيزات الأكسجين [] بما فيه الكفاية منخفضة تؤثر تأثيراً سلبيا على البيولوجية والعمليات الإيكولوجية ولكن في كثير من الأحيان وظيفيا ويعرف [القيام] < 2 مغ/لتر1، واكسجين (معرف وظيفيا ك [دو] من 0.0 0.2 مغ/L) تحدث أكثر تواترا وشدة في المياه الساحلية في العالم، ومصبات الأنهار و أعماق المحيطات2،3 ، وكثيراً ما تتفاقم بزيادة المغذيات4،5. مع حد مساحية متزايد من نقص واكسجين، تتأثر سلبا على الفونة العيانية وفقدان الموئل مدى ونوعية الموئل. ومن المتوقع تغير المناخ إلى تفاقم نقص واكسجين6.
في مصبات الأنهار الطبقية، وإثراء المغذيات كثيرة مثل خليج تشيسابيك، الولايات المتحدة الأمريكية، يمكن أن يسود نقص موسميا المستمرة ويمكن أن يحدث سنة بعد2. وباﻹضافة إلى ذلك، ركوب الدراجات البحرية من نقص تواترا في مصبات الأنهار مثل خليج تشيسابيك ومواقع أخرى ويحدث متأخراً أثناء الليل أو في ساعات الصباح الباكر في الصيف7،8.
وركزت معظم الدراسات على أثر التعرض المستمر للكائنات الحية إلى منخفضة [دو] وتسامحهم لنقص واكسجين9،،من1011،،من1213،14 . وعلاوة على ذلك، بحثت دراسات في التحول على نطاق واسع في تكوين الأنواع التوزيعات ووفرة الأنواع استجابة لتمديد منخفضة [دو]4،15. وكثيراً ما الأنواع التي حساسة جداً منخفضة [،] يموت في الجماهير،16 تحويل الأنواع المتبقية حيوانات الأصغر، أصغر حجماً، ولم تدم طويلاً كما، على سبيل المثال، وجدت في النظام الإيكولوجي “الجرف” تكساس لويزيانا4.
عادة ما تسبق التغيرات السلوكية انهيار المجتمع17 وأفادت الدراسات على الاستجابات السلوكية للكائنات الحية الموسعة منخفضة [دو]4،16،،من1718،19 ،،من2021،،من2223،24،25. ومع ذلك، هذه الدراسات، ولا تركز على الردود الواردة من الكائنات الحية لركوب الدراجات البحرية التعرض لنقص والطبيعة المتقلبة من توافر [] في مصبات الأنهار.
نقص ركوب الدراجات البحرية في مصبات الأنهار الضحلة تلقت الوعي المتزايد كما رصد الدراسات [] أكثر غالباً على مدى الأيام مع بارامترات في مصبات الأنهار16،26. يمكن أن تبقى المياه التاكسج لساعات في نهاية الليل أو ساعات الصباح الأولى في فصل الصيف عندما يكون هناك لا عملية التمثيل الضوئي توليد الأكسجين خلال الليل لكن تستهلك الأوكسجين عالية التنفس الهوائي7،16. ووجد أيضا أن أثر المد والجزر البحرية ركوب الدراجات منخفضة الظروف تفعل مع معظم المدقع الدنيا لاحظ عند المد والجزر المنخفضة وتزامنت مع نهاية ليلة27. إلا بعد عدة ساعات من نقص [القيام] يعود إلى نورموكسيا7،،من1628 في دورة يومية.
لتحديد استجابة فيرجينيكا جيم- السلوكية لنقص ركوب الدراجات البحرية والأس الهيدروجيني ونحن رصد فتح وإغلاق الصمامات المحار يتعرضون للمختبرات التي يسببها البحرية ركوب [دو] والدورية الأس الهيدروجيني. وقد استخدمت تثاءب ردود ذات الصدفتين للكشف عن الظروف البيئية المعاكسة. صمام إغلاق ذات الصدفتين في استجابة للملوثات29،،من3031، الطحالب السامة32،،من3334، والتلوث الحراري35،36 , 37، تقليل كمية الغذاء38،،من3940، تغذية نظام39،41، وانبثاق37،42، كبيرة43 , تم قياس 44والأس الهيدروجيني45،46، والجمع بين الرقم الهيدروجيني والأوكسجين الذائب47 . تقنيات تثاءب، على سبيل المثال، شملت الملاحظات المباشرة48،49،13، قياسات مستمر باستخدام مفاتيح ريد والمغناطيس (مراقبة بلح)50، أو مجسات الألياف الضوئية 51 التي تتطلب المياه واضحة. وبالإضافة إلى ذلك، استخدمت أجهزة استشعار قاعة قوة المغناطيس والحقل المغناطيسي لدراسة بلح البحر تثاءب زاوية52،53،،من5455، ونظام الحث كهرومغناطيسي عالية التردد ويمكن قياس المسافة متفاوتة بين اثنين من لفائف الكهربائية التي يتم لصقها في الصمامات استخدام56،57،،من5859. مصدر جهد العالي مطلوب للنظام بالحث الكهرومغناطيسي والسلطة يجب أن يتم تسليمها إلى كلا الجانبين من شل52. هذا النظام أيضا متوفرة تجارياً ك “موسيلمونيتور” (http://mosselmonitor.nl/).
على ميزانية ضيقة لبحث، ونحن شيدت جهاز قياس الضغط غير مكلفة (SGM) استمرار لقياس تثاءب المحار عبر البحرية الناجمة عن معمل الدراجات [دو] ودرجة الحموضة، تحت ظروف الرؤية المنخفضة. نظامنا أيضا أبسط بكثير من نظم المتنافسة، مما يسمح ليتم تجهيزها من خلال تجربة العديد من الحيوانات. أردنا تحديد استجابات فيرجينيكا جيم- السلوكية للبحرية ركوب الدراجات الهوائية الشديدة ([] = 0.6 مغ/لتر) نقص مع مراقبة درجة الحموضة (الأس الهيدروجيني = 7.8) وركوب الأس الهيدروجيني (pH = 7.8-7.0)، على التوالي، وتثاءب الردود إلى معتدل ([] = 1.7 مغ/لتر) نقص. وعلاوة على ذلك، كنا نرغب في تحديد ما إذا كانت قادرة على الاستجابة بسرعة للتغيرات في [] على البحرية دورة وكيفية الاستجابة عندما يعود نورموكسيا بعد حدث التاكسج المحار. ربما المحار يتم تكييفها على النحو الأمثل لسرعة تقلب البيئة التي وجدت في العديد من مصبات الأنهار16،27 التي يعيشون فيها. بينما تتوفر شاشات تثاءب صمام أكثر تعقيداً، يوفر SGM أسلوب غير مكلفة تتيح قياسات مستمرة لصمام تثاءب في المياه حتى في ظروف الرؤية المنخفضة.
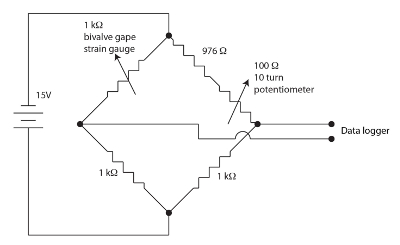
الشكل 1. جسر ويتستون لجهاز صمام تثاءب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
أجهزة الاستشعار سلالة الاستشعار المستخدمة لرصد تثاءب ذات الصدفتين هي الأفلام مقاوم في نمط تسكع على بوليميد النسخ. كميات صغيرة من سلالة تعدل المقاومة من أجهزة الاستشعار. الصدفتين تنثني سبر سلالة عندما جيبس أنها تسبب تغييرا في مقاومة أجهزة الاستشعار. استخدمنا جسر ويتستون نولينج، ومتوازنة، لكل قناة ذات الصدفتين كما هو مبين في الشكل 1 لقياس التغير في مقاومة أجهزة الاستشعار. جسر ويتستون هو بلا قيمة بمقياس الجهد الانزلاقي السماح مكسب عالية إلى حد ما أن تستخدمها في datalogger. جسر ويتستون أسلوب قياسي لقياس دقة بمقاومة مجهولة باستخدام نسبة إلى مقاومة معروفة قياسية والفولتميتر. وتناقش تاريخ هذه التقنية قديمة جداً في اكيلوف (2001)60. نحن دمج القنوات 12، مع كل جسر ويتستون ومقاومة متغيرة نولينج، وحدة مراقبة قياس الضغط (SGM).
Protocol
Representative Results
Discussion
دراسات نموذجية تركز على استمرار، تمديد الفترات الزمنية للظروف منخفضة الأكسجين، واستجابة لذلك، كثيرا ما يقاس كالبقاء، الحيوانات. ومع ذلك، في الوقت الحاضر، هو فهمنا للاستجابات السلوكية للحيوانات لركوب الدراجات البحرية نقص الحد الأدنى63. وهكذا، ينبغي أن تركز المزيد من الدراسا…
Disclosures
The authors have nothing to disclose.
Acknowledgements
ونحن نشكر فورسيث ميليندا لالتقاط صور محار وقياس على العرض تثاءب في إيماجيج. ونحن نشكر دينيس بريتبورج للوصول إلى الأحواض المائية مع ركوب الدراجات نقص وظروف الأس الهيدروجيني الدورية البحرية. ونشكر مركز الأبحاث البيئية سميثسونيان، ايدجووتر، ميريلاند، حيزاً للتجارب. ومولت هذه التجارب نقص “الوطنية لدراسة المحيطات” و “الغلاف الجوي الإدارة”-مركز “رعاية بحوث المحيطات الساحلية” منحة لا NA10NOS4780138 وصندوق Hunterdon سميثسونيان لدينيس بريتبورج. الصمام تثاءب القياسات خلال نقص تجارب مولت “منحة تعزيز هيئة التدريس” بكلية واشنطن إلى الكا ت. بورتر.
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
References
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

