تحليل المعادن التي تنتجها هفوب 1.19 وسوس-2 الخلايا باستخدام مجهر إلكتروني مع Microanalysis الأشعة السينية المشتتة الطاقة
Summary
نقدم بروتوكولا لمقارنة حالة المعادن في حويصلات صدر عن اثنين من خطوط الخلية العظام البشرية: هفوب 1.19 وسوس-2. حللت ملفاتهم التمعدن من الأليزارين الأحمر-S (ع-ق) تلطيخ، الأشعة فوق البنفسجية (الأشعة فوق البنفسجية) الخفيفة التصور والتصوير الميكروسكوب الإلكتروني (TEM) الإرسال والطاقة المشتتة الأشعة السينية سليكية (EDX).
Abstract
يعرض هذا الفيديو استخدام مجهر إلكتروني مع الطاقة المشتتة الأشعة السينية سليكية (EDX TEM) مقارنة حالة المعادن في حويصلات صدر عن اثنين من خطوط الخلية العظام البشرية: هفوب 1.19 وساوس-2. هذه خطوط الخلية، بعد العلاج مع حمض الأسكوربيك (أإ)، وبيتا-جليسيروفوسفاتي (β-GP)، الخضوع ترانسديفيرينتييشن أوستيوجينيك كاملة من انتشار التمعدن وتنتج مصفوفة حويصلات (MVs) التي تؤدي إلى نويات الاباتيت في المصفوفة خارج الخلية (ECM).
استناداً إلى تلطيخ الأليزارين الأحمر-S (ع-ق) وتحليل تكوين المعادن في الخلية ليساتيس باستخدام الأشعة فوق البنفسجية (الأشعة فوق البنفسجية) أو في حويصلات استخدام التصوير تيم تليها كوانتيتيشن EDX وتعيين أيون، يمكننا أن نستنتج أن osteosarcoma سوس-2 وأوستيوبلاستيك خلايا هفوب 1.19 تكشف عن ملامح متميزة من التمعدن. سوس-2 الخلايا طاغية أكثر كفاءة من الخلايا هفوب 1.19 وتنتج الرواسب المعدنية الكبيرة التي لا تظهر تحت الأشعة فوق البنفسجية ولكن تشبه هيدروكسيباتيت (ها) في أن لديهم بدائل أكثر من Ca وو.
النتائج التي تم الحصول عليها باستخدام هذه التقنيات تسمح بنا إلى الاستنتاج بأن عملية تمعدن يختلف تبعاً لنوع الخلية. ونحن نقترح أن أصل وخصائص من حويصلات سلفا على المستوى الخلوي، نوع المعادن.
Introduction
العظام نوع من النسيج الضام، ويتألف من جزأين: العضوية (خلايا وألياف الكولاجين) والمعدنية (مركبات الكالسيوم والفوسفات). العناصر المعدنية الرئيسية في العظام، أباتيتيس1. أنواع مختلفة من الخلايا المختصة تمعدن في العظام (خلايا الاوستيوبلاستس) والأسنان (أودونتوبلاستس) في الغضروف (تشوندروسيتيس) تنظيم الخطوات الأولية التمعدن بإنتاج بروتينات المصفوفة خارج الخلية (ECM) والإفراج عن مصفوفة حويصلات (MVs) (الشكل 1). MVs هي 100-300 نانومتر القطر الحويصلات التي تتراكم الكالسيوم والفوسفات تيسير التنو الاباتيت وربط الكولاجين2،3في وقت لاحق. ثم، تتفكك MVs للإفراج عن أباتيتيس إلى الوسط خارج الخلية. لا تزال أباتيتيس تنمو على اتصال بألياف الكولاجين وتشكل مصفوفة العظام. التمعدن تدعمه إمدادات ثابتة من فأنا و Ca2 + في الوسط خارج الخلية. بعض البيانات المنشورة مؤخرا الدعم لدينا نموذج4،5. لا طاغية الأنسجة الرخوة تحت الظروف الفسيولوجية. ومع ذلك، قد يحدث تكلس حمل خارج الرحم تحت الظروف المرضية مثل تكلس الأوعية الدموية3. يمكن أن تنتج خلايا الأوعية الدموية التي تحصل على النمط الظاهري osteoblast MVs حمل نويات أباتيتيس والشروع في تمعدن في طبقات الجدار الآنسي وإينتيمال من الأوعية الدموية. منذ تكلس حمل خارج الرحم تشبه endochondral العادي التمعدن3، فهم الآليات الجزيئية التمعدن العظمى الخلايا وتشوندروسيتيس ينبغي أن توفر بعض القرائن على حمل خارج الرحم تكلس الأنسجة الرخوة التي شكلت.
وينظم وضع أنسجة الهيكل العظمى الإنزيمات المختلفة، عوامل النمو، والمروجين أو مثبطات التمعدن. إجراءات معادية للأنسجة-غير محددة الفوسفاتيز القلوية (طنب) (الشكل 1) واكتونوكليوتيدي بيروفوسفاتاسي/فوسفوديستريس أنا (NPP1)، جنبا إلى جنب مع أنكيرين (عنك)، يتحكم تركيز بيروفوسفات غير العضوية (PPأنا) 6-PPأنا، مثبط قوية لتشكيل هكتار، وهي تحلل قبل تناب؛ NPP1 هيدروليزيس تريفوسفاتيس النوكليوتيدات لتشكيل PPأنا بينما الصادرات PPأنا عنك الخلية إلى إدارة المحتوى في المؤسسة. قد تنظم نسبة Pi/PPi الاباتيت تشكيل7،8 مع9من النتائج المرضية المحتملة.
هو إثراء الغشاء أم في أيون النقل البروتينات التي تيسر الترسيب الأولية من الكالسيوم والفوسفات داخل MVs أثناء عملية نويات (الشكل 1). نقل الفوسفات 1 (PiT) يساعد على إدماج فأنا ولدت في الفضاء بيريفيسيكولار إلى10،MVs11. يمكن إشراك أنيكسينس في الربط والنقل من Ca2 + وفي العملية الفيزيائية الحيوية التي يبدأ تمعدن في12،التجويف المتوسط13. أننا نفضل الفرضية، اقترح في وقت سابق التمعدن داخل الحويصلات إينتراسيتوبلاسميك من نويات الداخلية من اباتيت داخل MV قبل انتشاره في14،ECM15. وأكد النمذجة في المختبر تحريض Ca2 +/Pأنا مجمعات تشكيل في بروتيوليبوسوميس مصنوعة من PS و AnxA516. قد يشير هذا إلى أن التراكم من Ca2 +, فأنا، تمتلك مجمعات AnxA5 و PS في اطواف الدهن من مثل زغيبات ميمبرانيسريبريسينت لب نويات (NC) الاباتيت داخل ممقابل أنيكسينس وطنب أيضا ملزمة الكولاجين القدرات التي قد تكون مفيدة في وضع MVs على طول ألياف الكولاجين، وتنشيط الدعوة التمعدن في إدارة المحتوى في المؤسسة. أ فتوين وأوستيوبونتين (أوبن)17, معروفة كمثبطات لتشكيل الاباتيت التي قد تبطئ انتشار التمعدن على سقالة collagenous. التنو ونشر الأحداث متميزة، والسابق السابق لهذا الأخير، وكلاهما قد تكون ذات صلة بعملية تمعدن المرضية.
لاكتشاف كيف يمكن تغيير كيمياء مجمعات فوسفات الكالسيوم التمعدن الفسيولوجية وتكلس حمل خارج الرحم، من الضروري تحديد المعادن التي تنتجها الخلايا. أباتيتيس مجموعة من الكالسيوم والفوسفات التي تحتوي على معادن مع كريستال العام وحدة خلية الصيغة Ca10(ص4)6X2، حيث X = Cl، واو، أوهايو. كانت تصنف على النحو التالي18: فلوراباتيتي (FA) Ca10(ص4)6و2،10(ص4) تشلوراباتيتي (CA) Ca6Cl2 وهيدروكسيباتيت (ها) Ca10(ص. ب4 )6(OH)2.
اختيار خطوط الخلايا أوستيوبلاست للحث على تشكيل المعادن حاسم، حيث يسلك كل خط خلية مكانة متميزة التمعدن. في هذا التقرير، قارنا التنو المعادن بنموذجين الخلية البشرية المحددة التمعدن: هفوب أوستيوبلاستيك 1.19 الخلايا والخلايا osteosarcoma ساوس-2. Osteosarcoma المستمدة من الخلايا تستخدم عادة كنماذج أوستيوبلاستيك وخلايا سوس-2 حافظوا على الطابع أوستيوبلاستيك الأكثر نضجاً19 بينما خلايا غير متمايزة هفوب الأجنة البشرية تستخدم على نطاق واسع كنموذج لطبيعية أوستيوبلاستيك 20من التفريق. حللت ملفاتهم التمعدن بأساليب مختلفة: تلطيخ الأليزارين الأحمر-S (ع-ق) والأشعة فوق البنفسجية التصور الضوء (الأشعة فوق البنفسجية) وانتقال تصوير الميكروسكوب الإلكتروني (TEM)، الأشعة السينية المشتتة الطاقة سليكية (EDX) كوانتيتيشن وأيون رسم الخرائط. ميزة ال EDX عبر التقنيات البديلة المستخدمة في الدراسات السابقة أنه يعطي النتائج الكمية والنوعية لاستبدال أيون في الاباتيت بلورات4،5،21. وكان الهدف الشامل المتمثل في استخدام ال EDX للعثور على طريقة بسيطة للتصوير والتحديد الكمي لتوزيع أيونات Ca، و و Cl في المعادن المختلفة من أنواع مختلفة من الخلايا خلال مراحل متميزة من عملية تعدين. هذا الأسلوب قد استخدمت بنجاح، على سبيل المثال، لرصد تفاعل جسيمات نانوية الزنك مع المواد الكيميائية تتعايش وآثارها مجتمعة على الكائنات المائية22. وفي دراسة أخرى، اتسمت فوتوكاتاليست نحاس في مواد التيتانيوم في محلول مائي على نطاق واسع عن طريق قياس الطيف الكتلي بلازما الحث يقترن الانبعاثات الضوئية (برنامج المقارنات الدولية-OES)، فيسيسوربشن N2 (الرهان)، زرد، تجاه الأشعة فوق البنفسجية DRS، قدم الأشعة تحت الحمراء، رامان التحليل الطيفي، وال EDX والفوتوكهروكيميائيه قياسات23. وكان هدفنا المقارنة بين الأصل وخصائص من حويصلات والمعادن في اثنين من خطوط الخلية لفهم الآلية التي يتحكم التمعدن خلال التمايز العظمى.
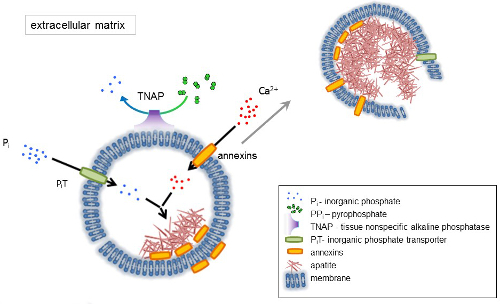
الشكل 1 . مخطط للخطوات الأولية التمعدن في الخلايا العظمى التي تنطوي على تركيب البروتينات المصفوفة خارج الخلية (ECM) والإفراج عن مصفوفة حويصلات (MVs) من الغشاء. MVs تتراكم الكالسيوم من خلال عمل الكالسيوم ملزم البروتينات وأننيكسينس والفوسفات، عن طريق العمل نقل الفوسفات غير العضوي (PiT) متبوعاً بنشاط الأنسجة غير محددة القلوية الفوسفاتيز (تناب)، الذي ديفوسفوريلاتيس PPأنا إلى فأنا، مما ييسر التنو الاباتيت. ثم MVs تتفكك والإفراج عن أباتيتيس إلى الوسط خارج الخلية. هو استمرار التمعدن بإمدادات ثابتة من فأنا و Ca2 + في المتوسط خارج الخلية4،5. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
Representative Results
Discussion
في هذه الورقة، وصفناها البروتوكولات للتلوين، تحديد فلوراباتيتي ضوء الأشعة فوق البنفسجية، ق ع وال EDX في المختبر تصوير MVs صدر عن مينيراليزينج الخلايا والمعادن التي تنتجها MVs. فمن الممكن لمعالجة كافة الأساليب المذكورة أعلاه باتباع بعض خطوات استكشاف الأخطاء وإصلاحها الشائعة. وللحص?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
عضو الكنيست وأطلب إجراء العمليات اليدوية وإعداد الرسومات، وجعلت من الفيلم. اسأل كتب المخطوطة، رطل كتب السيناريو وعضو الكنيست إعداد الجدول. SM، والممولة من الميزانية العادية و SP نقديا قراءة الجدول والبرنامج النصي والمخطوطة. الكتاب يود أن يشكر تشومونتووسكا حنا لها المساعدة الممتازة مع أولتراميكروتومي، فضلا عن سوسكى سزيمون وبيلسكي هنريك لمساعدتهم ممتازة مع تحليل TEM EDX. المؤلف يود أن يشكر الدكتور باتريك بساتين لتصحيح اللغة الإنجليزية المهنية وباربارا سوبياك لتسجيل التعليمات.
هذا العمل كان تدعمها منحة ن N401 140639 من وزارة العلوم والتعليم العالي البولندية لاسال، من المنح المقدمة من المركز الوطني للعلوم، وبولندا عام 2016/23/N/NZ4/03313 رطل و 2016/23/N/NZ1/02449 إلى عضو الكنيست، “الاتحاد الأوروبي FP7 المشروع بيويماجيني” : البولندية بيو-التصوير في بحوث الابتكار والتعليم، والجمعية العامة رقم 264173، وصناديق القانونية من “معهد نينكي للبيولوجيا التجريبية” أكاديمية العلوم.
Materials
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D |
for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
References
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -. L., Chien, C. -. C., Chiu, I. -. M., Huang, H. -. I., Chen, Y. -. C., Hu, H. -. I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O’Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O’Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).

