Análisis de minerales producidos por hFOB 1.19 y Saos-2 células usando la microscopia electrónica transmisión con microanálisis de rayos x dispersiva de energía
Summary
Presentamos un protocolo para comparar el estado de los minerales en vesículas por dos líneas de células de hueso humano: hFOB 1.19 y Saos-2. Sus perfiles de mineralización fueron analizados por alizarina rojo-S (AR-S) coloración, visualización luz de ultravioleta (UV), la proyección de imagen de microscopía electrónica (TEM) transmisión y microanálisis por energía dispersiva por rayos x (EDX).
Abstract
Este video presenta el uso de microscopía electrónica de transmisión con microanálisis de rayos x dispersiva de energía (TEM-EDX) para comparar el estado de los minerales en vesículas por dos líneas de células de hueso humano: hFOB 1.19 y Saos-2. Estas líneas celulares, después del tratamiento con ácido ascórbico (AA) y β-glicerofosfato (β-GP), experimentar transdifferentiation osteogénico completado de proliferación a la mineralización y producen vesículas de matriz (MVs) que provocan la nucleación de apatita en la matriz extracelular (ECM).
Basado en la tinción de rojo de alizarina-S (AR-S) y análisis de la composición de minerales en los lysates de la célula con luz ultravioleta (UV) o en vesículas usando proyección de imagen de TEM seguido por EDX cuantificación y mapeo de ion, podemos inferir que el osteosarcoma Saos-2 y osteoblástica las células hFOB 1.19 revelan perfiles de mineralización distinta. Las células SAOS-2 mineralizar más eficientemente que las células hFOB 1.19 y producen depósitos minerales más grandes que no son visibles bajo luz UV, pero son similares a la hidroxiapatita (HA) en que tienen sustituciones más Ca y F.
Los resultados obtenidos con estas técnicas nos permiten concluir que el proceso de mineralización es diferente dependiendo del tipo de célula. Proponemos que, a nivel celular, el origen y las propiedades de las vesículas predeterminan el tipo de minerales.
Introduction
El hueso es un tipo de tejido conectivo compuesto de dos partes: orgánica (células y fibras de colágeno) y minerales (compuestos de calcio y fosfato). Los principales componentes minerales en los huesos son apatitas1. Diferentes tipos de células competentes de mineralización en el hueso (osteoblastos), dientes (odontoblastos) y cartílago (condrocitos) regulan los pasos iniciales de mineralización produciendo proteínas de la matriz extracelular (ECM) y liberación de matriz vesículas (MVs) (figura 1). MVs son vesículas de 100 a 300 nm de diámetro que acumulan calcio y fosfato facilita la nucleación de apatita y posteriormente se unen al colágeno2,3. Entonces, MVs se desintegran para liberar apatitas al medio extracelular. Las apatitas continúan creciendo en contacto con las fibras de colágeno y forman la matriz ósea. La mineralización es sostenida por el suministro constante de P y Ca2 + en el medio extracelular. Algunos datos publicados recientemente apoyan nuestro modelo4,5. Los tejidos blandos no mineralizarse bajo condiciones fisiológicas. Sin embargo, la calcificación ectópica puede ocurrir en condiciones patológicas tales como calcificación vascular3. Las células vasculares que adquieren el fenotipo de osteoblastos pueden producir MVs que inducen la nucleación de apatitas e inician la mineralización en las capas íntimas y mediales de la pared de los vasos sanguíneos. Desde calcificación ectópica se asemejan a endocondral normal mineralización3, entender los mecanismos moleculares de la mineralización de las células óseas y condrocitos deben proporcionar algunas pistas sobre la calcificación ectópica de los tejidos blandos que son formado.
El desarrollo de tejidos esqueléticos está regulado por diversas enzimas, factores de crecimiento y promotores o inhibidores de la mineralización. La acción antagónica de la fosfatasa alcalina no específica de tejido (TNAP) (figura 1) y ectonucleotide pirofosfatasa/fosfodiesterasa I (NPP1), junto con ankyrin (ANK), controla la concentración de pirofosfato inorgánico (PP) 6. PP, un potente inhibidor de la formación de HA, es hidrolizado por TNAP; NPP1 hidroliza trifosfatos de nucleótidos para formar PP mientras ANK las exportaciones de PP de la célula al ECM. La proporción Pi/PPi puede regular la formación de apatita7,8 con posibles consecuencias patológicas9.
La membrana de MV se enriquece en proteínas de transporte de iones que facilitan la precipitación inicial de calcio y fosfato en el MVs durante el proceso de nucleación (figura 1). El transportador de fosfato 1 (hoyo) ayuda a incorporar P genera en el espacio perivesicular en la MVs10,11. Anexinas pueden estar implicado en el atascamiento y el transporte de Ca2 + y en el proceso biofísico que inicia la mineralización en el MV lumen12,13. Privilegiamos la hipótesis, sugerida anteriormente, para la mineralización dentro de vesículas intracitoplasmáticas de nucleación interna de apatita dentro de la MV antes de su propagación en el ECM14,15. Modelado in vitro confirmaron la inducción de la Ca2 +/P complejos formación en proteoliposomes de PS y AnxA516. Esto puede indicar que la acumulación de Ca2 +, P, complejos AnxA5 y PS en las balsas lipídicas de las microvellosidades-como membranesrepresent el núcleo nucleación (NC) de apatita dentro de Mvs anexinas y TNAP también poseen colágeno vinculante capacidades que pueden ayudar en la colocación de MVs a lo largo de las fibras de colágeno y en estimular la propagación de la mineralización en el ECM. Fetuin A y17de la osteopontina (OPN), son conocidos como inhibidores de la formación de apatita que puede ralentizar la propagación de la mineralización en el andamio colagenosa. Nucleación y propagación son eventos distintos, el primero anterior a éste, y ambos pueden ser relevantes para el proceso de mineralización patológica.
Para descubrir cómo puede cambiar la química de complejos de fosfato de calcio calcificación ectópica y mineralización fisiológica, es necesario identificar los minerales producidos por las células. Apatitas son un grupo de calcio y fosfato que contiene minerales con el cristal general unidad celular fórmula Ca10(PO4)6X2, donde X = Cl, F, OH. Se clasifican de la siguiente manera18: Fluorapatito (FA) Ca10(PO4)6F2y chlorapatite (CA) Ca10(PO4)6Cl2 de hidroxiapatita (HA) Ca10(PO4 )6(OH)2.
La elección de las líneas celulares de osteoblastos para inducir la formación de minerales es crucial, puesto que cada línea celular exhibe un perfil distinto de mineralización. En este informe, en comparación con la nucleación de minerales por dos modelos de células humanas las de mineralización: células osteoblásticas hFOB 1.19 y células de osteosarcoma Saos-2. Las células derivadas de osteosarcoma se utilizan comúnmente como modelos osteoblásticos y células Saos-2 conservan la más madura de carácter osteoblástico19 mientras que las células indiferenciadas hFOB fetal humano son ampliamente utilizadas como modelo para osteoblástica normal diferenciación20. Sus perfiles de mineralización se analizaron mediante diferentes métodos: tinción rojo de alizarina-S (AR-S), ULTRAVIOLETA (UV) luz la visualización, la proyección de imagen de microscopía electrónica (TEM) transmisión, cuantificación de microanálisis (EDX) de rayos x dispersivo energía y ion asignación. La ventaja de TEM-EDX sobre alternativas técnicas utilizadas en estudios previos es que da resultados cuantitativos y cualitativos de la sustitución de iones en cristales de apatita4,5,21. El objetivo de utilizar las TEM-EDX era encontrar un método simple para la proyección de imagen y cuantificación de la distribución de los iones Ca, F y Cl en varios minerales de diferentes tipos de células en distintas etapas del proceso de mineralización. Este método ha sido utilizado con éxito, por ejemplo, para monitorear la interacción de las nanopartículas de zinc con productos químicos coexistentes y sus combinados efectos en organismos acuáticos22. En otro estudio, un fotocatalizador cobre en materiales de titanio en solución acuosa se caracterizó ampliamente por medio de espectrometría de emisión óptica de plasma acoplado inductivamente (ICP-OES), N2 physisorption (BET), DRX, DRS de UV-vis, FT-IR, Raman Espectroscopia, TEM-EDX y fotoelectroquímicos medidas23. Nuestro objetivo fue comparar el origen y las propiedades de las vesículas y los minerales en dos líneas celulares para entender el mecanismo que controla la mineralización durante la diferenciación ósea.
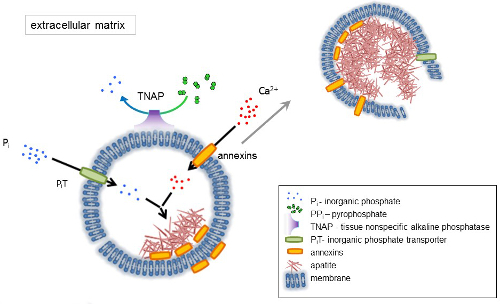
Figura 1 . Esquema de los pasos iniciales de la mineralización en las células óseas que implican la síntesis de proteínas de matriz extracelular (ECM) y liberación de vesículas de la matriz (MVs) de la membrana. MVs acumulan calcio a través de la acción de proteínas calcio, anexinas y fosfato, a través de la acción de un transportador de fosfato inorgánico (PiT) seguido por la actividad de tejido no-fosfatasa alcalina específica (TNAP), que desfosforila PP a P, facilitando así el nucleation de la apatita. Entonces, MVs se desintegren y liberen apatitas al medio extracelular. La mineralización es sostenida por el suministro constante de P y Ca2 + en el medio extracelular4,5. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
En el documento actual, describen los protocolos para AR-S coloración, identificación de luz UV de Fluorapatito y TEM-EDX en vitro la proyección de imagen de MVs por mineralización de las células y de los minerales producidos por MVs. Es posible tratar todos los métodos mencionados siguiendo algunos pasos de solución de problemas comunes. Para obtener resultados óptimos, deben realizarse varios pasos críticos cuidadosamente. En primer lugar, es mejor añadir AA (que es ácido) seguida por β-GP…
Disclosures
The authors have nothing to disclose.
Acknowledgements
MK y pedir realizar operaciones manuales y LB había preparado dibujos e hizo la película. PREGUNTA escribió el manuscrito, LB escribió el guión y MK había preparado la mesa. SM, RB y SP leen críticamente la tabla, el script y el manuscrito. Los autores desean agradecer a Hanna Chomontowska por su excelente asistencia ultramicrotomía como Szymon Suski y Henryk Bilski por su excelente ayuda con análisis de TEM-EDX. Los autores desean dar las gracias a Dr. Patrick para corrección de inglés profesional y Barbara Sobiak para las instrucciones de la grabación.
Este trabajo fue financiado por beca N N401 140639 del Ministerio polaco de ciencia y educación superior para pedir, por subvenciones del Centro Nacional de ciencia, Polonia 2016/23/N/NZ4/03313 LB y 2016/23/N/NZ1/02449 a MK, UE FP7 proyecto BIOIMAGINE : BIO-proyección de imagen en investigación, innovación y educación, GA Nº 264173 y por los fondos legales del Instituto de Biología Experimental Nencki, Polaco Academia de Ciencias.
Materials
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D |
for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
References
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -. L., Chien, C. -. C., Chiu, I. -. M., Huang, H. -. I., Chen, Y. -. C., Hu, H. -. I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O’Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O’Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).

