微流体和 Microrheology 相结合测定软物质在重复相变过程中的流变特性
Summary
我们演示了一个微流控装置的制造和使用, 使多粒子跟踪 microrheology 测量, 以研究重复相变的流变效应对软物质。
Abstract
软物质的显微结构直接影响宏观流变性能, 可通过在前相变化和应用剪切过程中的胶体重排等因素来改变。为了确定这些变化的程度, 我们开发了一种微流控装置, 它能使周围流体和微观流变学特性的交换引起的重复相变, 同时限制试样的剪切。此技术µ2流变学, 微流体和 microrheology 的组合。微流控装置是两层设计, 其对称入口流进入取样室, 在流体交换过程中捕获凝胶样品。吸力可以应用在远离样品室, 把液体拉入样品室。利用多粒子跟踪 microrheology (等离子体) 对材料的流变性能进行了表征。在微波等离子体中, 荧光探针粒子嵌入到材料中, 探针的布朗运动使用视频显微镜进行记录。对粒子的运动进行了跟踪, 计算了平均平方位移。利用广义斯托克斯-爱因斯坦关系, 该方法与宏观流变性质有关。通过与临界松弛指数的比较, 确定了材料的相位, 并用时间-固化叠加法确定。纤维胶体凝胶的测量表明了该技术的实用性。这种凝胶有一个微妙的结构, 可以不可逆转地改变时, 剪切应用。µ2流变数据表明, 材料在每次相变后反复 equilibrates 到相同的流变性质, 表明相转变在显微结构变化中不起作用。为了确定剪切的作用, 样品可以在注入到我们的微流控装置之前被剪切。µ2流变学是一种广泛适用的技术, 用于对软物质进行表征, 使在相变过程中, 单个样品中微细微结构的流变特性能够得到测定, 以响应周围环境条件。
Introduction
软物质中的相变可以改变脚手架结构, 这在材料的处理和最终稳定性方面有影响1,2,3。在动态相变过程中, 软材料的表征为结构演化与平衡结构和流变特性之间的关系提供了重要的信息。例如, 许多家庭护理产品需要在消费者使用期间发生阶段性变化。此外, 在生产过程中, 加工步骤, 包括稀释和混合, 可以传递剪切影响的流变性能和最终显微组织的产品。了解整个相变的流变特性, 确保产品按设计进行。此外, 如果力改变材料在制造过程中的开始流变, 相变会产生意想不到的和不希望的结果, 改变预期的功能和效果。在临界凝胶点, 定义为物质从相关胶体或聚合物溶液过渡到样品生成凝胶网络的点, 材料性质随联想的细微变化而急剧变化。在关键凝胶点上对结构的任何修改都会影响最终产品4。在这些动态过渡过程中, 软材料具有弱的机械性能和测量, 使用经典的实验技术可以在测量噪声限制下5,6,7。为此, 在低模量范围 (10-3 -4 Pa) 中敏感的 microrheology 技术被用来表征弱初凝胶在动态演化过程中的特征。有些材料因外力而易受显微组织的变化, 这在表征过程中提出了挑战, 因为任何材料或流体的转移都可能影响结构, 最终材料的性能也会受到冲击。为了避免改变材料的显微结构, 我们开发了一种微流控装置, 可以在试样周围交换环境流体, 同时尽量减少剪切。通过交换流体环境, 在相变过程中测量流变特性和显微组织的变化, 并以最小的剪切贡献。该装置与多粒子跟踪 microrheology (等离子体) 结合在一种称为µ2流变学的技术中。该技术用于在凝胶的连续相变过程中, 对外部驱动力进行定量测定材料性能。该技术将说明使用纤维胶体凝胶, 氢化蓖麻油 (HCO)9,10,11。
凝胶支架由于其示例环境12,13,14,15, 可能会经历联想和离解的变化。胶凝和降解的驱动力是具体的材料, 必须为每个感兴趣的材料量身定做。µ2流变学可用于表征对外部刺激反应的凝胶系统, 包括胶体和聚合网络。改变 pH, 渗透压力或盐浓度是驱动力的例子, 可以引起材料微观结构的变化。例如, HCO 通过创建渗透压力梯度来经历控制的相变。当浓缩的 HCO 凝胶样品 (4 wt% HCO) 淹没在水中时, 胶体颗粒之间的吸引力减弱, 导致降解。或者, 当 HCO (0.125 wt% HCO) 的稀释溶液与亲水性材料 (称为凝胶剂, 主要由甘油和表面活性剂组成) 接触时, 吸引力会返回, 导致凝胶化。此凝胶系统将用于显示设备的操作, 作为测量单个示例9、10上的连续相转换的工具。为了表征这些凝胶支架在动态过渡过程中的特征, 以及在临界相变时的微妙初始凝胶结构, 我们利用等离子体来表征这些材料的高时空分辨率。
Microrheology 是用来确定凝胶的性质和结构, 特别是在关键的过渡, 一系列软材料, 包括胶体和聚合物凝胶5,6,9,16。微波等离子体是一种被动微观流变学技术, 它使用视频显微镜记录在样品中嵌入的荧光探针粒子的布朗运动。整个视频中的粒子位置精确地确定为使用经典跟踪算法17,18的像素的 1/10th 。从这些粒子轨迹计算了集合平均均方根位移 (本, Δr2(t))。该方法与材料性能有关, 如蠕变符合性, 使用广义斯托克斯-爱因斯坦关系17,19,20,21,22, 23。该材料的状态是通过计算该曲线的对数斜率作为滞后时间的函数来确定的, α,
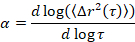
其中t为滞后时间, 并将其与临界松弛指数 ( n) 进行比较。n是使用时间固化叠加法确定的, 一种记录良好的技术, 它经过拉森和 Furst6进行了修改, 以分析等离子体数据。通过比较n到α材料的状态定量地被确定。当α > n材料为溶胶时, 当α < n材料为凝胶时。以前的工作使用 microrheology 来确定临界松弛指数9的 HCO 系统的特征。使用这些信息, 我们精确地确定在实验中材料何时从凝胶转变为溶胶。此外, 非高斯参数, αNG, 可以计算, 以确定系统的结构异质性的程度,
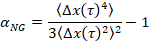
其中Δx(t) 是x方向上的一维粒子移动。使用等离子体, 我们可以表征一个单相过渡, 但通过表征材料与微波微流体装置, 我们能够操纵周围的流体环境和收集数据的几个相变的单一凝胶样品。
该微流控装置的设计目的是研究单个凝胶样品的临界过渡, 以响应周围流体环境的变化而进行相变。当该装置在凝胶或溶胶状态下, 通过锁定样品以诱导相变, 同时最小化剪切时, 该设备会交换样品周围的流体。溶剂盆地位于样品室的正上方, 由六个对称间隔的入口通道连接。这种对称性允许液体从溶剂盆地交换到样品室, 同时在样品周围产生同样的压力, 将其锁定到位。已经有几项研究将这种技术用于单粒子和 DNA 捕获, 但这项工作将从单个分子到大约10µL24、25、26的样本量扩展。这种独特的设计还能在相变过程中实现实时的微观流变学特性。
µ2流变学是一种适用于许多软物质系统的健壮技术。本文所描述的技术是为胶体凝胶设计的, 但它可以很容易地适应其他材料, 如聚合物或胶束溶液。利用这一技术, 我们不仅确定了相变对平衡材料性能的影响, 而且还决定了不同加工步骤对材料的流变演化和最终脚手架结构的持久影响, 以及性能。
Protocol
Representative Results
Discussion
通过以下经过充分记录的微流控芯片制造技术29, 可以轻松地进行双层微流控设备 (图 1)。在装置的底部添加玻璃支撑, 以减少振动对探针运动的影响。玻璃滑动是非常稀薄的 (0.10 毫米) 为了容纳显微镜目标的工作距离。这使得该设备易受建筑物中的小振动和样品环境的影响, 然后用高速相机测量。玻璃支持成功地抵消了这些外部刺激。选择短工作距离目标, ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项工作的资金由 DNI7 & 赌博公司和美国化学学会石油研究基金 (54462-) 提供。对美国化学学会石油研究基金的捐助者的承认是对这项研究的部分支持。作者想感谢马可 Caggioni 博士的有益讨论。
Materials
| 150 x 15 mm Petri Dish | Corning, Inc. | 351058 | |
| 75 x 50 x 0.15 mm glass slide | Fisher Scientific | Custom | |
| 75 x 50 x 1.0 mm glass slide | Fisher Scientific | 12-550-C | |
| 75 x 25 x 1.0 mm glass Slide | Fisher Scientific | 12-550-A3 | |
| 22 x 22 Glass cover slips | Fisher Scientific | 12-542-B | |
| Acetone, 99.5% | VWR Analytical | 67-64-1 | |
| Low intensity UV source | UVP | UVL-56 | |
| Chloroform, 99.9% | Fisher Chemical | C298-500 | |
| Cotton Swabs | Q-tips | 83289205 | |
| Ethanol, 90% | Fisher Chemical | A962-4 | |
| Fluoresbrite® YG Carboxylate Microspheres 0.50µm | Polysciences, Inc. | 15700-10 | |
| High-Intensity UV Lamp | Spectroline Corp. | SB-100P | |
| Hot plate | Corning, Inc. | PC-420 | |
| Hydrochloric Acid, 6N | Ricca Chemical Company | 3750-32 | |
| Methyltriethyoxysilane, 98% | Acros Organics | 174622500 | |
| Microcentrifuge | Eppendorf | 5424 | |
| Plasma cleaner | Harrick Plasma, Inc. | PDC-32G | |
| Polydimethylsiloxane (PDMS) | Robert McKwown Company | 2065622 | |
| Sonicator | Branson, Emerson Electric | 1800 | |
| Steel connectors, ID 0.023 inch | New England Small Tube Corp. | Custom | |
| Tetraethoxysilane, 98% | Alfa Aesar | A14965 | |
| Thiol-ene Resin (UV curable) | Norland Products, Inc. | NOA81 | |
| Transparency | Staples Inc. | 21828 | |
| Tygon tubing, ID 1/32 inch | McMaster-Carr | E-3603 | |
| Vacuum oven | Fisher Scientific | 282A | |
| Biopsy punch 8 mm | World Precision Instruments | 504535 | |
| Bioposy punch 0.5 mm | World Precision Instruments | 504528 | |
| Syringe, 30 mL | BD | 309659 | |
| Syringe, 3 mL | BD | 309651 | |
| Needle, 18 gauge | BD | 305195 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 22-36-320-4 | |
| High-speed Camera | Vision Research | Miro M120 | |
| Microscope | Carl Zeiss AG | Zeiss Observer, Z1 | |
| Syringe pump | New Era Pump Systems | NE-300 | |
| Hydrogenated castor oil | Procter & Gamble | N/A | |
| Afício MP 6002 Printer | Ricoh Company, Ltd. | 415877 |
References
- Mitchell, P. Microfluidics-downsizing large-scale biology. Nat. Biotech. 19, 717-721 (2001).
- Haber, C. Microfluidics in commercial applications; an industry perspective. Lab Chip. 6, 1118-1121 (2006).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Huang, X., Raghavan, S. R., Terech, P., Weiss, R. G. Distinct kinetic pathways generate organogel networks with contrasting fractality and thixotropic properties. J. Am. Chem. Soc. 128, 15341-15352 (2006).
- Larsen, T. H., Schultz, K. M., Furst, E. M. Hydrogel microrheology near the liquid-solid transition. Korea-Aust. Rheol. J. 20, 165-173 (2008).
- Larsen, T. H., Furst, E. M. Microrheology of the liquid-solid transition during gelation. Phys. Rev. Lett. 100, 146001 (2008).
- Schultz, K. M., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid rheological screening to identify conditions of biomaterial hydrogelation. Soft Matter. 5, 740-742 (2009).
- Switzer, L. H., Klingenberg, D. J. Flocculation in simulations of sheared fiber suspensions. Int. J. Multiph. Flow. 30, 67-87 (2004).
- Wehrman, M. D., Lindberg, S., Schultz, K. M. Quantifying the dynamic transition of hydrogenated castor oil gels measured via multiple particle tracking microrheology. Soft Matter. 12, 6463-6472 (2016).
- Wehrman, M. D., Milstrey, M. J., Lindberg, S., Schultz, K. M. Using µ2rheology to quantify rheological properties during repeated reversible phase transitions of soft matter. Lab Chip. 17, 2085-2094 (2017).
- Wehrman, M. D., Lindberg, S. E., Schultz, K. M. Impact of shear on the structure and rheological properties of a hydrogenated castor oil colloidal gel during dynamic phase transitions. J. Rheol. , (2018).
- Loh, X. J. Dual-responsive “reversible micelles”. J. Appl. Polym. Sci. 127, 992-1000 (2013).
- Kern, F., Zana, R., Candau, S. J. Rheological properties of semidilute and concentrated aqueous solutions of cetyltrimethylammonium chloride in the presence of sodium salicylate and sodium chloride. Langmuir. 7, 1344-1351 (1991).
- Trappe, V., Prasad, V., Cipelletti, L., Segre, P. N., Weitz, D. A. Jamming phase diagram for attractive particles. Nature. 411, 772-775 (2001).
- Philipse, A. P., Wierenga, A. M. On the density and structure formation in gels and clusters of colloidal rods and fibers. Langmuir. 14, 49-54 (1998).
- Schultz, K. M., Bayles, A. V., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid, high resolution screening of biomaterial hydrogelators by mu2rheology. Biomacromolecules. 12, 4178-4182 (2011).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179, 298-310 (1996).
- Mason, T. G. Estimating the viscoelastic moduli of complex fluids using the generalized Stokes–Einstein equation. Rheol. Actac. 39, 371-378 (2000).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle tracking microrheology of complex fluids. Phys. Rev. Lett. 79, 3282-3285 (1997).
- Mason, T. G., Weitz, D. A. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74, 1250-1253 (1995).
- Squires, T. M., Mason, T. G. Fluid mechanics of microrheology. Annu. Rev. Fluid Mech. 42, 413-438 (2010).
- Gittes, F., Schnurr, B., Olmsted, P. D., MacKintosh, F. C., Schmidt, C. F. Microscopic viscoelasticity: shear moduli of soft materials determined from thermal fluctuations. Phys. Rev. Lett. 79, 3286-3289 (1997).
- Mai, D. J., Brockman, C., Schroeder, C. M. Microfluidic systems for single DNA dynamics. Soft Matter. 8 (41), 10560-10572 (2012).
- Tanyeri, M., Ranka, M., Sittipolkul, N., Schroeder, C. M. A microfluidic-based hydrodynamic trap: design and implementation. Lab Chip. 11, 1786-1794 (2011).
- Lee, J. S., Dylla-Spears, R., Teclemariam, N. P., Muller, S. J. Microfluidic four-roll mill for all flow types. Appl. Phys. Lett. 90, 074103 (2007).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179 (1), 298-310 (1996).
- Mason, T. G., Weitz, D. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74 (7), 1250 (1995).
- Schultz, K. M., Furst, E. M. High-throughput rheology in a microfluidic device. Lab on a chip. 11, 3802-3809 (2011).
- Abate, A. R., Lee, D., Do, T., Holtze, C., Weitz, D. A. Glass coating for PDMS microfluidic channels by sol-gel methods. Lab Chip. 8, 516-518 (2008).
- Happel, J., Brenner, H. . Low Reynolds Number Hydrodynamics: with special applications to particulate media. , (1965).

