분리 및 통합 규조류 Cyclotella Meneghiniana Thylakoid 지질으로 리에서에서 광 수확 안테나
Summary
여기, 선물이 fucoxanthin 엽록소 a/c 바인딩 단백질 (FCP) 규조류에서 격리 하 여 이온 구성 변경 시 여기 에너지 전달 연구를 자연 지질 작곡과 리로 그들을 통합 하는 프로토콜.
Abstract
식물, 조류와 규조류의 광합성 성능을 강력 하 게에 따라 다릅니다 빛 수확과 에너지의 신속 하 고 효율적인 규제 엽록체의 thylakoid 막에서 전송 프로세스. 규조류의 안테나를 수확 하는 빛, 이른바 fucoxanthin 엽록소 a/c 바인딩 단백질 (FCP), 빛 흡수를 위한 요구 되 고 광합성 반응에 효율적인 전송 센터 뿐만 아니라 과도 한 빛에서 사진 보호에 관해서는. 이 두 함수 사이의 스위치 연구의 오랜 문제 이다. 이러한 연구의 대부분을 실시 되었습니다 FCP와 세제 micelles에. 상호 작용 연구에 대 한 세제 제거 되었습니다, FCP 단지의 불특정 집계를 주도. 이 방법에서는, 유물과 순수 관련 데이터를 구분 하기 어렵다. 따라서, 만약 그들이 그들의 네이티브 지질 환경에 포함 된 단백질-단백질 상호 작용, 에너지 전송 및 기타 광 기능을 공부 하 여 FCP 및 단지 수확 다른 바인딩된 막 빛에 대 한 더 유용한 정보를 얻을 수 있습니다. 주요 장점은 리는 정의 된 크기와는 FCP 클러스터링의 범위 제어는 정의 된 지질/단백질 비율. 또한, vivo에서 수확 하는 빛을 조절 하는 pH와 이온 구성에서 변경 쉽게 시뮬레이션할 수 있습니다. Thylakoid 막에 비해는 리 있습니다 더 균일 하 고 덜 복잡 한 분 광 데이터 이해를 쉽게 하. 프로토콜의 FCP 격리 및 정화, liposome 준비, 그리고 천연 지질 성분과 리도 FCP의 설립 절차를 설명합니다. 일반적인 응용 프로그램에서 결과 주어진 고 설명.
Introduction
규조류 등 광합성 유기 체 조명 조건 변화에 대처 하 고 정교한 새 환경 순응 메커니즘을 높은 광합성 효율을 유지 하 고 과도 한 빛에 의해 발생 하는 사진 산화 손상에서 보호로 응답 해야 합니다. 광합성 진핵생물에서 주요 빛 보호 프로세스는 높은 에너지 냉각 (E)의 q 가벼운 스트레스 조건1,2 비 광화학 냉각 (NPQ)에 주요 기여로 발생 하는 빛을 흡수 ,3. 광 수확 안테나 복합물 (LHC) 여기 에너지 이동 통로의 규칙에서 포함 된다. 높은 빛에 대 한 응답에 낮은 pH 상태 냉각 상태를 수확 하는 빛에서 안테나 시스템 전환 엽록체 루멘에서 유도. 이 에너지 되는 낭비 적인 상태 photosystems (PS) 및 thylakoid 막에서 다른 단지 사진 산화에서 보호합니다. 광합성 진핵생물에서 qE 는 일반적으로 두 가지 요인1,,23에 의해 유발 됩니다. 한 요인은 낮은 pH에 반응 하는 단백질을 수확 하는 특수 빛 이다. PsbS 단백질 높은 식물4q전자 유도합니다. LhcSRs5, PsbS 활동에 의해 변조 녹색 조류6q전자 유도. 규조류는 LHCSRs7,8,,910와 구조적으로 관련 된 Lhcx 같은 단백질을가지고 있다.
QE 의 두 번째 요소는 안테나의 카로 티 노이 드 드 epoxidation에 의해 사진 보호 형식으로 변환 하 고 epoxidation에 의해 복귀 빠진 주기입니다. 식물과 녹 조류, violaxanthin 제 아 잔 틴으로 변환 됩니다. 규조류에 diadinoxanthin 다음 NPQ11의 범위와 상관 한다 diatoxanthin로 변환 됩니다. 안테나를 수확 하는 규조류 빛 비록 그것이 진화 식물 및 조류 LHCs와 관련 된 몇 가지 특성을 소유한 다. 사진 보호에 수확 하는 빛에서 스위치 엄청나게 빠른 이며 NPQ 용량 높은 식물12비교. 하나의 이유는 규조류 매우 성공적인 그들은 해양 순 주 생산13의 45%를 담당 하는 방식에서 다른 생태 틈새에서 수 있습니다. 따라서, 규조류 수확 시스템 빛은 광합성 연구의 흥미로운 개체입니다.
규조류, 중심 종 Cyclotella meneghiniana thylakoid 본질적인 빛 수확 하는 그들은 안료 후 명명 된 시스템을가지고 같은 바인딩-fucoxanthin, 엽록소 (chl) a와 c, 그러므로 FCP. 빛 수확 하는 단백질, FCPs, 등 몇몇 막 층으로 구성 된 thylakoid 막 시스템에 포함 된. 규조류는 3 thylakoids의 악대를 형성 한다. 이 복잡 한 상황 어려운 thylakoid 막에 있는 분자 수준에 그들을 공부 하. 또한, 많은 구성 요소 (위 참조)를 수확 하는 빛의 조절에 기여 한다. 따라서, 많은 접근에는 단지 n-라우릴-β-D-maltopyranoside (β-DDM), 막 solubilize 하지만 FCP 단지 그대로 유지 같은 가벼운 세제를 사용 하 여 막에서 분리 했다. 많은 분 광 연구 조사 intramolecular 에너지 전송14,15,,1617solubilized FCP를 사용 하 여 수행 했다. 그러나, 전 이렇게는 에너지 전송 규칙 다른 안테나 단지 또는 photosystems와 excitonic의 상호 작용을 필요로 하기 때문에 제한 되었다. 따라서, 이러한 종류의 연구 수 없습니다 실시 solubilized 단지와 단지 사이 상호 작용은 손실 때문에.
안테나 규칙에 있는 중요 한 기능 안테나와 thylakoid 막18에 photosystems의 “분자 크롤 링”입니다. 이 효과 시뮬레이션 하는 간단한 접근 방식을 실시 되었다 이전, 생체 외에서. 세제, 안테나 복합물의 임의의 집합에 이르게 제거 되었습니다. 합리적인 데이터가 접근17,19에 의해 얻은, 비록 세제 제거 vivo에서 상황을 반영 하지 않는 하 고는 단지 하지 그들의 일반 차에 상호 작용 하는 때문에 몇 가지 한계가 구조입니다.
리를 사용 하 여 여러 전 한계 극복. 3 차 구조는 여전히 완벽 하 게 그대로. Liposome 막 안테나 단지에 대 한 준 네이티브 환경을 제공합니다. 막 외부 환경에서 있는 liposome의 내부를 분리합니다. 이러한 방법으로 리 이온과 pH 기온 변화도의 또한 전송 프로세스에 관해서는 연구에 대 한 두 가지 반응 구획을 제공합니다. 또한, 실험 시스템의 매개 변수는 thylakoid 막에서 연구에 대 한 더 쉽게 제어할 수 있습니다. 리 이미 광합성 단지 공부 하는 훌륭한 도구를 보였다. 과거에 주요 초점 식물 LHC 변경 된 지질 구성의 효과 LHC II20에 테스트 되었습니다 했다. 다른 접근 방식에서 다른 LHC II 단백질-단백질 상호작용 조사21를 했다. 또한, 일부 연구 녹색 조류에 실행 되었다 LHC22사이 자발적인 클러스터링을 설명 하는. 수생 생태계에 대 한 규조류의 중요성을 고려 하면 상대적으로 적은 연구 규조류의 안테나 단지 수행 했다. 두 연구 조사 어디 표시 했다 전기 화학 기온 변화도24 FCP 안테나23 FCP의 응답성의 클러스터링 중심 Cyclotella meneghiniana 의 안테나 복합물. 따라서, 리 공부 규조류 안테나 및 그들의 상호 작용 및 거의 기본 조건에서 규정 하는 훌륭한 도구입니다. 리 지질 구성, liposome 크기, 단백질 밀도 많은 조건 이후 다목적 이며 주변 수성 단계를 제어할 수 있습니다. 또한, 메서드는 낮은 양의 샘플 필요합니다. 실험 시스템은 강력 하 고 매우 재현. 리의 서 산도 공부 가능 하며 안테나 복합물의 규칙에 있는 이온 기온 변화도 중요 한 요인.
여기, 우리 C. meneghiniana 에서 FCP 안테나 복합물의 격리와 자연 thylakoid 지질 성분과 리에 그들의 설립을 설명합니다. 또한, 우리 solubilized FCP의 분 광 특성에 대 한 모범 데이터를 제공 하 고 리에서 FCP와 그들을 비교. 메서드 요약 지식 및 Gundermann 및 Büchel 201223, 나탈리 외. 201622, 그리고 아마 드와 Dietzel 201724의 개선에서 얻은 표준된 프로토콜.
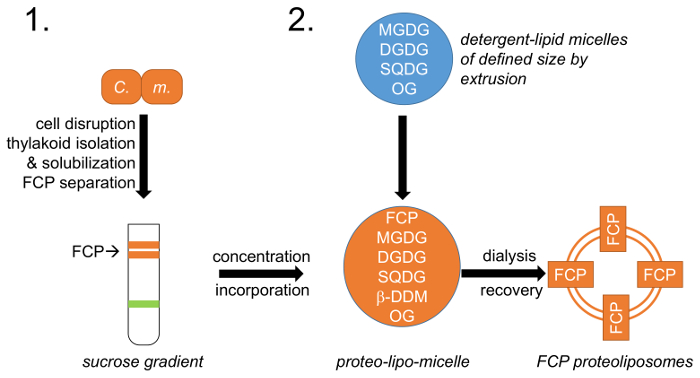
그림 1: 워크플로 도식 표현. (1) 세포 성장, 중단 및 자당 밀도 기울기;에 FCP 분리를 따르는 thylakoid 절연 설명 단락 1 참조 C. m. –Cyclotella meneghiniana 세포. 2와 octylglycoside (OG)와 지질 세제 micelles의 창조 (2) 자연 thylakoid 지질 혼합물 (MGDG, DGDG 및 SQDG)의 준비 절에서 설명합니다. 정의 된 지질-micelle 크기 정의 기 공 직경의 막을 사용 하 여 압출 함으로써 이루어집니다. FCP 및 지질 micelles 미리 정의 된 지질에서 통합: 단백질 비율과 OG 및 β-DDM 세제는 제거를 통해 제어 투 FCP proteoliposomes를 형성. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Protocol
Representative Results
Discussion
천연 지질 성분과 FCP 리 광 속성을 조사 하 편리한, 간단 하 고 재현 가능한 도구를 제공 생체 외에서. FCP 리에서 지질 환경 자연 조건에 가까이 있는 실험 결과를 야 기한 thylakoid 막 내 상황을 유사 합니다.
C. meneghiniana 를 사용 하 여 FCP 안테나를 모델 시스템으로 서의 몇 가지 이점이 있다. 그것은 비교적 빨리 성장 하 고 다른 규조류 모델 종, 예를 들어, Thalassi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
우리는 FCP 정화에 모이 라 Adeel 아마 드 감사합니다. 교수 클 Büchel 유용한 토론에 대 한 인정은 원고를 읽고. 이 작품은 LD (DI1956-1/1)에 독일 연구 재단 및 LD. Feodor Lynen 친교의 훔볼트 재단에 의해 지원 되었다
Materials
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel – por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer – Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | |||
| For specific safety instructions please refer to material safety sheets and repective manuals. | |||
| Standard lab material and substances are not listed. |
References
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).

