지역화를 Autometallography 및 Cetacean 조직에 실버 반 계량의 사용
Summary
프로토콜 cetacean 간 및 신장 조직에 Ag를 지역화 하려면 autometallography에 의해 제공 됩니다. 또한, cetacean 조직학 Ag 분석 결과 (욕설) 라는 새로운 분석 결과 그 조직에 Ag 농도 견적 하기 위하여 개발 된다.
Abstract
나노 (AgNPs) 섬유, 화장품, 그리고 그들의 강력한 항균 효과 인해 의료 항목을 포함 하 여 상용 제품에 광범위 하 게 사용 되었습니다. 그들은 또한 환경에 공개 될 수 있습니다 하 고 바다에 축적. 따라서, AgNPs는 Ag 오염의 주요 원천 및 Ag의 환경 독성에 대 한 대중의 인식을 증가. Ag의 (에서 소비자/육 식 동물) 확대 및 bioaccumulation (생산자)에 이전 학문은 설명 했다. 고래, 바다의 정점 육 식으로 수 있습니다 부정적인 영향 되었습니다 Ag/Ag 화합물에 의해. Cetacean 조직에 Ag/Ag 화합물의 농도 유도 결합된 플라즈마 질량 분광학 (ICP-MS)에 의해 측정 될 수 있다, 비록 ICP MS를 사용 하 여 높은 자본 비용 및 조직 스토리지/준비에 대 한 요구 사항에 의해 제한 됩니다. 따라서, autometallography (AMG) 메서드를 사용 하 여 이미지 정량 분석 포 르 말린 고정, 파라핀 끼워 넣어진 (FFPE) 조직 suborgan 수준에서 Ag 배포를 지역화 하 고 cetacean에 Ag 농도 추정 하는 보조 방법 있을 수 있습니다 조직입니다. AMG 긍정적인 신호 근 신장 관 상피, hepatocytes, Kupffer 세포의 세포질에 다양 한 크기의 검은 알갱이를 주로 갈색입니다. 때때로, 일부 비정 질 황금 노란색 갈색 AMG 긍정적인 신호는 루멘과 일부 근 신장 tubules의 지하실 막에 설명 되어 있습니다. Ag 농도 추정에 대 한 분석 결과 Cetacean 조직학 Ag 분석 결과 (욕설), AMG 방법 및 ICP-MS의 이미지 정량 분석에서 데이터에 의해 설립 하는 회귀 모델은 이름은입니다. AMG 지역화 CHAA와 반 계량 중 금속 사용 spatio 시간적 및 크로스-종 연구에 대 한 편리한 방법론을 제공 합니다.
Introduction
나노 (AgNPs) 섬유, 화장품, 그리고 그들의 위대한 항균 효과1,2인 의료 항목을 포함 하 여 상용 제품에 광범위 하 게 사용 되었습니다. 따라서, AgNPs와 AgNP 포함 된 제품의 생산 시간이3,4증가 됩니다. 그러나, AgNPs 환경으로 공개 될 수 있습니다 그리고 바다5,6에 축적. 그들은 Ag 오염의 주요 소스 되 고 Ag의 환경 독성에 대 한 대중의 인식을 증가.
해양 환경에서 AgNPs Ag의 상태는 복잡 하 고 끊임없이 변화입니다. 이전 연구 AgNPs 입자, 집계, 분해, 반응 화학 종 또는+ Ag 이온7,8에서 다시 생성으로 남아 있을 수 있는 표시 했습니다. 여러 종류의 Ag, AgCl, 등 그들은 생물이 유기 체에 의해 섭취 될 수 있다 하 고 먹이 사슬9,10입력 해양 퇴적 물에서 발견 되었습니다. 대만의 남서 해안을 따라 치 구 라군 지역에서 실시 이전 연구, 해양 퇴적 물의 Ag 농도 매우 낮고 crustal 풍요에 유사한 그리고 그 생선 간 조직의 일반적으로 검출 아래 제한 (< 0.025 μ g/g 습식/습식)11. 그러나, 다른 국가에서 이전 연구는 간의 상대적으로 높은 Ag 농도 고래12,13의 설명 했다. 고래는 간은에서 Ag 농도 연령에 따라, 그들의 시체에 Ag의 소스는 대부분 그들의 먹이12제안 이다. 이 결과 더 높은 영양 수준에서 동물에 Ag의 biomagnification을 좋습니다. 고래, 바다에서 정점 육 식으로 수 있습니다 고통을 할 Ag/Ag 화합물12,,1314로 인 한 부정적인 건강에 미치는 영향. 가장 중요 한 것은, 고래, 처럼 인간은 포유동물, 및 부정적인 건강 영향 고래에 Ag/Ag 화합물으로 인 한 인간에서도 발생할 수 있습니다. 즉, 고래 해양 환경 및 인간 건강에 대 한 센 티 넬 동물 수 있습니다. 따라서, 건강 효과, 조직 분포 및 고래에 Ag의 농도 큰 관심사.
ICP-MS를 사용 하 여 높은 자본 비용 (악기 및 유지 관리) 및 조직 스토리지에 대 한 요구 사항에 의해 제한 cetacean 조직에 Ag/Ag 화합물의 농도 유도 결합된 플라즈마 질량 분광학 (ICP-MS)에 의해 측정 될 수 있다, 비록 /preparation12,15. 또한, 그것은 일반적으로의 물류 어려움, 부족 인력, 관련된 리소스12의 부족으로 좌초 cetacean 경우 모든 조사에서 포괄적인 조직 샘플을 수집 어렵습니다. 냉동된 조직 샘플 ICP MS 분석에 대 한 제한 된 냉동 공간 때문에 쉽게 저장 되지 않습니다 그리고 냉동된 조직 샘플 깨진된 냉장 장비12인해 삭제 될 수 있습니다. 이러한 상기 장애물 ICP MS 분석 냉동된 조직 샘플을 사용 하 여 오염 수준 cetacean 조직에서의 수사를 방해. 반면, 포 르 말린 고정 조직 샘플은 상대적으로 죽은 좌초 고래의 검 시 동안 수집 하기 쉽다. 따라서, 그것은 포 르 말린 고정 조직 샘플을 사용 하 여 cetacean 조직에서 중 금속 검출/측정 하는 사용 하기 편한 하 고 저렴 한 방법을 개발 하는 데 필요한.
Suborgan 분포 및 농도의 알칼리 그리고 알칼리 성 지구 금속 포 르 말린 고정 하는 동안 변경 될 수 있습니다, 비록 파라핀 포함 (FFPE) 과정, 전이 금속, Ag에 낮은 효과 지적된16있다 합니다. 따라서, FFPE 직물 금속 현지화 및 측정16,17에 대 한 이상적인 샘플 자원으로 간주 되었습니다. Autometallography (AMG), 조직화 학적인 과정 FFPE 직물 단면도에 검은 AMG 긍정적인 신호를 변함없이 크기의 황금 노란색으로 중 금속을 증폭 수 있습니다 및 이러한 증폭 된 중 금속은 가벼운 현미경 검사 법18, 에서 구상 될 수 있다 19 , 20 , 21. 그러므로, AMG 메서드 중 금속의 suborgan 배포판에 정보를 제공 합니다. 그것은 ICP MS만 기관 레벨18에 중 금속의 농도 측정할 수 있기 때문에 생물 학적 시스템에서 중 금속의 대사 경로 공부에 대 한 중요 한 추가 정보를 제공할 수 있습니다. 또한, 디지털 이미지 분석 소프트웨어 ImageJ, 같은 조직학 조직 섹션22,23의 정량 분석에 적용 되었습니다. FFPE 직물 단면도의 검은 AMG 긍정적인 신호를 변함없이 크기의 황금 노란색 정량 고 중 금속의 농도 추정 하는 데 사용 될 수 있습니다. 회귀 모델 이미지 정량 분석 및 ICP-MS, cetacean 라는에서 얻은 데이터를 기반으로 예상할 수 있는 절대 Ag 농도 이미지 정량 분석 AMG 메서드에서 직접 결정 될 수 없다, 조직학 Ag 분석 결과 (욕설)입니다. ICP MS 분석 가장 좌초 고래에 의해 Ag 농도 측정에 어려움을 고려 하면 CHAA는 Ag 농도 cetacean 조직, ICP MS 분석의 부족에 의해 결정 될 수 없다 추정 하 귀중 한 보조 방법 냉동 조직 샘플입니다. 이 종이 suborgan 수준 및 고래의 간 및 신장 조직에 Ag 농도 추정 하는 욕설 이라는 분석 결과에서 Ag 지역화에 대 한 조직화 학적인 기법 (AMG 방법)의 프로토콜을 설명 합니다.
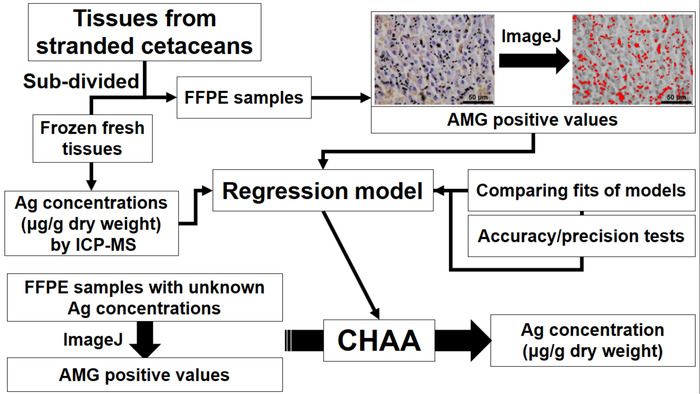
그림 1: Ag 농도 추정에 대 한 설립 및 cetacean 조직학 Ag 분석 결과 (욕설)의 응용 프로그램을 묘사 하는 순서도. CHAA cetacean 조직학 Ag 분석 결과, FFPE = = 포 르 말린 고정 파라핀 포함, ICP MS = 유도 결합된 플라즈마 질량 분광학. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Protocol
Representative Results
Discussion
문서 연구의 목적은 suborgan 수준에서 Ag 배포를 평가 하 고 cetacean 조직에 Ag 농도 추정 하는 보조 메서드를 설정 하는 것입니다. 현재 프로토콜 ICP-MS, 2) AMG 분석 알려진된 Ag 농도와 일치 하는 쌍 조직 샘플의 3) Ag 농도 추정에 대 한 회귀 모델 (욕설)의 설립에 의해 cetacean 조직에 Ag 농도의 결정 1) 포함 AMG 양수 값, 4)에 의해 평가의 정확성과 정밀도 CHAA, 및 5의) 욕설에 의해 Ag의 추정 농도.
<p class="jo…Disclosures
The authors have nothing to disclose.
Acknowledgements
우리는 대만 Cetacean 좌초 네트워크 샘플 수집 및 저장, 대만 Cetacean 사회, 타이페이;를 포함 하 여에 대 한 감사 Cetacean 연구 실험실 (교수 선취 Siang Chou), 연구소의 생태학 및 진화 생물학, 국립 대만 대학, 타이 페이; 자연 과학 (박사 Chiou-주 야 오), 타이중;의 국립 박물관 그리고 해양 생물학 & Cetacean 연구 센터, 국립 쳉 쿵 대학. 우리 또한 그들의 허용에 대 한 임업 국, 농업 위원회, 행정원을 감사합니다.
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

