Eseguire la spettroscopia su nanoparticelle plasmoniche con microscopia a contrasto di tipo Nomarski basata su trasmissione
Summary
L’obiettivo di questo protocollo è quello di dettagliare un approccio collaudato per la preparazione di campioni di nanoparticelle plasmoniche e per l’esecuzione di spettroscopia a singola particella su di essi con microscopia a contrasto di interferenza differenziale (DIC).
Abstract
La microscopia a contrasto di interferenza differenziale (DIC) è un potente strumento di imaging che è più comunemente impiegato per l’imaging di oggetti in Microscala utilizzando la luce a raggio visibile. Lo scopo di questo protocollo è quello di dettagliare un metodo collaudato per la preparazione di campioni plasmonici di nanoparticelle e l’esecuzione di spettroscopia a singola particella su di essi con la microscopia DIC. Per eseguire esperimenti di spettroscopia ripetibile è necessario seguire con attenzione diversi passaggi importanti. In primo luogo, i punti di interesse possono essere incisi nel substrato del campione, che aiuta a localizzare la superficie del campione e a tracciare la regione di interesse durante gli esperimenti. Successivamente, il substrato deve essere adeguatamente pulito di detriti e contaminanti che possono altrimenti ostacolare o oscurare l’esame del campione. Una volta preparato correttamente il campione, il percorso ottico del microscopio deve essere allineato, utilizzando l’illuminazione Kohler. Con un microscopio DIC standard Nomarski, può essere necessaria la rotazione del campione, in particolare quando le nanoparticelle plasmoniche presentano proprietà ottiche dipendenti dall’orientamento. Poiché la microscopia DIC ha due campi di polarizzazione ortogonale intrinseci, il modello di contrasto DIC dipendente dalla lunghezza d’onda rivela l’orientamento delle nanoparticelle plasmoniche a forma di asta. Infine, l’acquisizione dei dati e l’analisi dei dati devono essere accuratamente eseguite. È comune rappresentare i dati della spettroscopia basata su DIC come valore di contrasto, ma è anche possibile presentarlo come dati di intensità. In questa dimostrazione di DIC per la spettroscopia a singola particella, il focus è sulle nanoparticelle d’oro sferiche e a forma di asta.
Introduction
A partire dagli anni ottanta, la microscopia a contrasto differenziale (DIC) è stata ampiamente vista come un importante metodo di imaging riservato agli oggetti in Microscala all’interno delle scienze biologiche. Tuttavia, durante il suo sviluppo negli anni cinquanta e sessanta, era inteso come una tecnica per la scienza dei materiali1. Con i recenti progressi nelle scienze dei materiali legati alle nanoparticelle plasmoniche, si è tenuto un maggiore interesse per la caratterizzazione dei materiali con microscopia ottica.
Molte tecniche ottiche sono certamente disponibili per la caratterizzazione dei nanomateriali (ad esempio, campo scuro, campo chiaro, luce polarizzata, fluorescenza, ecc.). Campo oscuro è ampiamente popolare nella ricerca di nanoparticelle, ma si basa esclusivamente sulla raccolta di dispersione e fornisce informazioni limitate su campioni complessi2. La fluorescenza può essere utile, ma solo con campioni che si illuminalizzano o che possono essere adeguatamente macchiati. La microscopia DIC ha diversi tratti che lo rendono uno strumento prezioso per l’analisi delle nanoparticelle. I vantaggi più frequentemente dichiarati di DIC rispetto ad altri metodi e per quanto riguarda le nanoparticelle plasmoniche sono: nessuna colorazione del campione richiesta, nessun effetto alone, profondità di campo superficiale e alta risoluzione laterale3. DIC ha ulteriori punti di forza che sono preziosi per la ricerca di nanoparticelle plasmoniche. Prima di tutto, sono presenti due campi di polarizzazione intrinseci e ortogonali, che possono essere misurati simultaneamente per scopi di spettroscopia2. In secondo luogo, il segnale depolarizzato delle nanoparticelle non viene catturato nell’immagine finale2, che può essere una causa di grave preoccupazione nelle misurazioni della spettroscopia di campo scuro.
Lo scopo di questo articolo è quello di fornire una chiara metodologia per l’utilizzo della luce trasmessa Nomarski DIC microscopia per eseguire la spettroscopia sulle nanoparticelle plasmoniche. Anche se DIC è una tecnica potente che può essere applicata a materiali altamente diversificati, è anche una tecnica che richiede grande abilità e comprensione per operare correttamente durante l’imaging di nanoparticelle. La microscopia di Nomarski DIC basata sulla trasmissione ha un percorso luminoso complesso1 che verrà esaminato solo brevemente qui. Il treno ottico di DIC viene visualizzato in Figura 1. La luce viene trasmessa attraverso il microscopio prima di essere passata attraverso un polarizzatore e un prisma Nomarski che divide il fascio prima di essere concentrato dal condensatore sul piano del campione. Dopo aver attraversato l’obiettivo, la luce incontra una trave-combinando Prisma Nomarski e un analizzatore prima di uscire al rivelatore. I due polarizzatori e i prismi Nomarski sono fondamentali per la formazione dell’immagine DIC e sono responsabili della produzione dei due campi di polarizzazione ortogonale di DIC1. Per il lettore interessato a conoscere meglio i principi di lavoro e il percorso ottico dei microscopi DIC Nomarski, o le differenze tra Nomarski DIC e altri stili di DIC, si prega di fare riferimento ad altri conti ben scritti su questi argomenti1, 4 , 5 il , 6 il , 7. il
È altrettanto importante comprendere la natura di base delle nanoparticelle plasmoniche prima di tentare di eseguire la spettroscopia su di essi, che si tratti di Nomarski DIC, campo scuro o qualsiasi altra tecnica di microscopia. Nel campo della plasmonica, le nanoparticelle sono definite come particolati con dimensioni sulla scala di 10-100 Nm8,9. Le nanoparticelle possono assumere molte forme (ad esempio sfere, aste, stelle, manubri, ecc.), e la maggior parte delle loro proprietà importanti derivano da interazioni con la luce nella gamma infrarossa-visibile-vicino infrarosso dello spettro elettromagnetico. Il termine “plasmonico” non è limitato alle nanoparticelle10; Tuttavia, quando si discute di nanoparticelle, viene utilizzato in riferimento alla risonanza plasmonica superficiale localizzata (LSPR). LSPR è un fenomeno in cui gli elettroni di conduzione in una nanoparticelle oscillano a causa di un’interazione Coulombica con radiazioni elettromagnetiche di una banda di frequenza molto specifica e relativamente ristretta8. A queste stesse frequenze, le nanoparticelle plasmoniche mostrano un aumento dell’assorbimento e della dispersione della luce, rendendole osservabili con la microscopia ottica. In molti casi, è preferibile osservare le nanoparticelle mentre si posizionano filtri passa-banda prima del condensatore2, per migliorare il contrasto dell’imaging e per eliminare la luce che non riesce a indurre l’effetto LSPR. L’utilizzo dei filtri consente inoltre di eseguire esperimenti di spettroscopia a singola particella.
Il comportamento ottico correlato a LSPR dipende fortemente dalle dimensioni e dalla forma delle nanoparticelle e può essere studiato con molte tecniche di microscopia ottica. Tuttavia, al fine di decifrare le informazioni di orientamento delle nanoparticelle plasmoniche con una forma anisotropa (cioè non sferica), è necessario utilizzare la polarizzazione del campo luminoso. Ruotando con cautela il campo di polarizzazione o il substrato campione a piccoli incrementi, è possibile monitorare le proprietà spettroscopiche dipendenti dall’orientamento delle singole nanoparticelle. La rotazione e la polarizzazione possono anche aiutare a determinare se una funzione spettrale è dovuta ad un’oscillazione dipolare o superiore dell’ordine degli elettroni superficiali delle nanoparticelle. Tuttavia, nel caso delle nanoparticelle isotrope (cioè sferiche), il profilo spettrale rimane sostanzialmente invariato al momento della rotazione del campione sotto luce polarizzata.
Quando viene visualizzato attraverso un microscopio DIC (Figura 2), le nanoparticelle hanno un disco arioso con un aspetto bianco e nero in ombra su uno sfondo grigio. Le nanoparticelle sferiche manterranno questo aspetto in rotazione e con il cambio di filtri passa-banda; Tuttavia, le particelle svaniranno gradualmente dalla vista poiché la lunghezza d’onda centrale del filtro diventa ulteriormente separata dall’unica lunghezza d’onda dipolare LSPR della sfera11. La comparsa di nanorodi può cambiare abbastanza drammaticamente come sono ruotati2. I nanorodi hanno due bande LSPR con comportamento dipolare, la cui posizione si basa sulle dimensioni fisiche dei nanorodi. Quando l’asse longitudinale di un aggregato nanorod è orientato parallelamente a uno dei campi di polarizzazione DIC, il disco arioso apparirà tutto bianco o tutto nero se visualizzato con un filtro passa-banda associato a quella lunghezza d’onda LSPR. Dopo aver ruotate il campione 90 °, si avrà il colore opposto. In alternativa, poiché l’asse trasversale di un nanorodo è perpendicolare all’asse longitudinale, l’asta assumerà il colore opposto quando si passa da un filtro che corrisponde alle lunghezze d’onda LSPR per i due assi. In altri orientamenti e impostazioni del filtro, i nanorodi appariranno più come sfere, presentando una varietà di modelli di dischi ariosi in fusione di ombre. Per i nanorodi con un asse trasversale < 25 Nm, può essere difficile rilevare il segnale a quella lunghezza d'onda di LSPR utilizzando la microscopia DIC.
Per eseguire la spettroscopia a singola particella, è importante utilizzare i componenti ottici corretti e allinearli correttamente. Deve essere utilizzato un obiettivo in grado di microscopia DIC. Per esperimenti di particelle singole, gli obiettivi di 80x o 100x Oil sono ideali. I prismi di Nomarski DIC sono normalmente disponibili in tre varietà: standard, ad alto contrasto e ad alta risoluzione. Il tipo ideale dipende fortemente dallo scopo dell’esperimento e dalle dimensioni delle nanoparticelle. I prismi standard vanno bene per molti esperimenti; ma quando si lavora con nanoparticelle più piccole (< 50 Nm), i prismi ad alto contrasto possono essere utili, poiché il contrasto delle particelle diminuisce con la diminuzione delle particelle nella dimensione11. Regolando il contrasto DIC si ottiene ruotando un polarizzatore o traducendo uno dei prismi DIC, a seconda della marca del microscopio o del modello6.
Dopo aver impostato l’illuminazione Kohler e le impostazioni del polarizzatore, è fondamentale non regolare queste impostazioni durante la raccolta dei dati della spettroscopia. Inoltre, un segnale di fondo medio costante deve essere mantenuto in ogni momento durante la raccolta dei dati, anche quando si passa tra i filtri e le impostazioni angolari. L’effettivo valore di sfondo ideale dipende dalla gamma dinamica della fotocamera scientifica, ma in generale, lo sfondo dovrebbe essere nell’intervallo di 15% – 40% del livello di rilevamento massimo della fotocamera. Ciò riduce la probabilità di saturare il sensore della fotocamera, consentendo al contempo un contrasto ottimale delle particelle. Per la raccolta dei dati della spettroscopia, è necessario lavorare con una fotocamera scientifica che cattura le immagini in bianco e nero, a differenza di una fotocamera a colori.
La preparazione dei campioni è un altro aspetto critico dell’imaging delle nanoparticelle plasmoniche. È imperativo che gli operatori della microscopia DIC abbiano una comprensione delle proprietà ottiche del campione e del substrato del campione. Il vetro per microscopio “pre-pulito” non è sufficientemente preparato per l’imaging delle nanoparticelle e deve essere adeguatamente ripulito prima della deposizione del campione per garantire un’osservazione senza ostacoli del campione. Molti protocolli di pulizia per le diapositive del microscopio sono stati documentati in precedenza12, ma non è un passo che viene normalmente riportato negli studi sperimentali.
Infine, i metodi di analisi dei dati sono il componente finale della spettroscopia a singola particella. Devono essere misurate le intensità massime e minime per ogni nanoparticelle, nonché la media locale di base. Le particelle di interesse devono trovarsi in aree senza detriti di fondo, difetti del substrato o illuminazione irregolare. Un metodo per determinare il profilo spettrale di un nanoparticelle è calcolando il contrasto delle particelle ad ogni lunghezza d’onda, usando l’equazione sotto11,13,14,15:
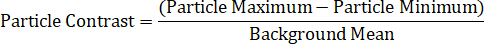
In alternativa, lo spettro di una singola particella può essere suddiviso nei suoi singoli componenti di segnale massimo e minimo, che rappresentano i due campi di polarizzazione di DIC, mostrando così i due spettri direttivamente dipendenti raccolti simultaneamente, attraverso le due equazioni:
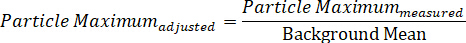
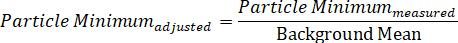
Protocol
Representative Results
Discussion
Quando si imaging con la microscopia DIC, è fondamentale ottimizzare i componenti ottici prima di raccogliere i dati. Anche piccole regolazioni al polarizzatore nel mezzo di un esperimento possono comportare impatti significativi sui dati finali6. Inoltre, diversi materiali richiedono diverse impostazioni polarizzatore. Anche se le grandi dimensioni dei gradini sono state utilizzate qui per dimostrare l’effetto dell’angolo di polarizzazione, in un esperimento reale, è imperativo ottimizzare l’im…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dr. Anthony S. Stender desidera riconoscere il supporto tecnico attraverso il nanoscale e Quantum fenomeni Institute (NQPI) presso l’Università di Ohio. Questo articolo è stato reso possibile attraverso il finanziamento di Start-up fornito al Dr. Stender dall’Ohio University.
Materials
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
References
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That’s Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. . Plasmonics: Fundamentals and Applications. , (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).

