Utføre spektroskopi på Plasmonic nanopartikler med Transmission-baserte Nomarski-type differensial interferens kontrast mikroskopi
Summary
Målet med denne protokollen er å detalj en velprøvd tilnærming for utarbeidelse av plasmonic nanopartikkel prøver og for å utføre enkelt partikkel spektroskopi på dem med differensial interferens kontrast (DIC) mikroskopi.
Abstract
Differensial interferens kontrast (DIC) mikroskopi er et kraftig tenkelig verktøy som er mest brukt for Imaging Mikroskala objekter ved hjelp av synlig rekkevidde lys. Formålet med denne protokollen er å detalj en velprøvd metode for å forberede plasmonic nanopartikkel prøver og utføre enkelt partikkel spektroskopi på dem med DIC mikroskopi. Flere viktige trinn må følges nøye for å utføre repeterbar spektroskopi eksperimenter. Først kan landemerker være etset inn i prøven underlaget, som hjelpemidler i å finne prøven overflaten og i å spore den regionen av interesse under eksperimenter. Deretter må underlaget være riktig rengjort for rusk og forurensninger som ellers kan hindre eller obskure undersøkelse av prøven. Når en prøve er skikkelig forberedt, må den optiske banen til mikroskopet justeres, ved hjelp av Kohler belysning. Med en standard Nomarski stil DIC mikroskop, rotasjon av prøven kan være nødvendig, spesielt når plasmonic nanopartikler utstillingen orientering-avhengige optiske egenskaper. Fordi DIC mikroskopi har to iboende ortogonale polarisering felt, avslører bølgelengde-avhengige DIC kontrast mønster orienteringen av Rod-formede plasmonic nanopartikler. Til slutt må datainnsamling og dataanalyser utføres nøye. Det er vanlig å representere DIC-baserte spektroskopi data som en kontrast verdi, men det er også mulig å presentere den som intensitet data. I denne demonstrasjonen av DIC for enkelt partikkel spektroskopi, er fokuset på sfærisk og stang-formet gull nanopartikler.
Introduction
Siden 1980-tallet har differensial forstyrrelser kontrast (DIC) mikroskopi i stor grad blitt sett på som en viktig tenkelig metode forbeholdt Mikroskala objekter innenfor biologisk vitenskap. Men under sin utvikling i 1950 og 1960, var det ment som en teknikk for Materials Science1. Med den nylige fremskritt i de materielle vitenskaper relatert til plasmonic nanopartikler, en økt interesse for karakterisering av materialer med optiske mikroskopi har funnet sted.
Mange optiske teknikker er sikkert tilgjengelig for nanomaterialebasert karakterisering (f. eks mørkt felt, brightfield, polarisert lys, fluorescens, etc.). Dark feltet er allment populær i nanopartikkel forskning, men det baserer seg utelukkende på innsamling av Scatter og gir begrenset informasjon om komplekse prøver2. Fluorescens kan være nyttig, men bare med prøver som luminesce eller som kan være riktig beiset. DIC mikroskopi har flere egenskaper som gjør det til et verdifullt verktøy for analyse av nanopartikler. De hyppigst uttalte fordelene med DIC i forhold til andre metoder og i forhold til plasmonic nanopartikler er: ingen prøve farging nødvendig, ingen Halo effekter, grunne dybdeskarphet, og høy lateral oppløsning3. DIC har flere styrker som er verdifulle for plasmonic nanopartikkel forskning. Først av alt, to iboende og ortogonale polarisering felt er til stede, og de kan måles samtidig for spektroskopi formål2. For det andre er det depolarisert signalet av nanopartikler ikke fanget i det endelige bildet2, som kan være en årsak til alvorlig bekymring i mørke felt spektroskopi målinger.
Hensikten med denne artikkelen er å gi en klar metodikk for å utnytte overført lys Nomarski DIC mikroskopi å utføre spektroskopi på plasmonic nanopartikler. Selv om DIC er en kraftig teknikk som kan brukes på svært varierte materialer, er det også en teknikk som krever stor dyktighet og forståelse for å drive det riktig når Imaging nanopartikler. Transmission-baserte Nomarski DIC mikroskopi har en kompleks lys bane1 som bare vil bli kort gjennomgått her. Den optiske toget til DIC vises i figur 1. Lyset overføres gjennom mikroskopet ved først å bli passert gjennom en polarisator og en bjelke-splitting Nomarski prisme før de blir fokusert av kondensatoren på prøven flyet. Etter å ha passert gjennom målet, møter lyset en bjelke-kombinere Nomarski prisme og en analysator før du avslutter til detektoren. De to polarisatorer og Nomarski prismer er avgjørende for dannelsen av DIC bildet og er ansvarlig for å produsere DIC to ortogonale polarisering felt1. For leseren interessert i å vite mer om arbeids prinsipper og optiske banen til Nomarski DIC mikroskop, eller forskjellene mellom Nomarski DIC og andre stiler av DIC, henvises det til andre velskrevet kontoer på disse emnene1, 4 andre priser , 5 andre priser , 6 andre priser , 7i.
Det er like viktig å forstå grunnleggende natur plasmonic nanopartikler før du forsøker å utføre spektroskopi på dem, enten det er med Nomarski DIC, mørkt felt, eller andre mikroskopi teknikk. Innen plasmonics er nanopartikler definert som partikler med dimensjoner på skalaen på 10-100 NM8,9. Nanopartikler kan ta på mange former (f. eks, kuler, stenger, stjerner, manualer, etc.), og de fleste av deres viktige egenskaper oppstår fra interaksjoner med lys i ultrafiolett-synlig-nær infrarød rekkevidde av det elektromagnetiske spekteret. Begrepet “plasmonic” er ikke begrenset til nanopartikler10; men når du diskuterer nanopartikler, er det brukt i referanse til lokaliserte overflaten Plasmon resonans (LSPR). LSPR er et fenomen der ledning elektroner i en nanopartikkel svinge på grunn av en Coulombic interaksjon med elektromagnetisk stråling av en svært spesifikk og relativt smal frekvensbånd8. På de samme frekvensene viser plasmonic nanopartikler økt absorpsjon og spredning av lys, noe som gjør dem synlige med optiske mikroskopi. I mange tilfeller er det foretrukket å observere nanopartikler mens du plasserer bånd pass filtre før kondensatoren2, for å forbedre Imaging kontrast og for å eliminere lys som ikke klarer å indusere LSPR effekt. Bruk av filtre gjør det også mulig å utføre enkle partikkel spektroskopi eksperimenter.
LSPR-relatert optisk atferd er svært avhengig av størrelsen og formen på nanopartikler, og det kan undersøkes med mange optiske mikroskopi teknikker. Men for å dechiffrere orientering informasjon av plasmonic nanopartikler med en Anisotrop (dvs. ikke-sfærisk) form, er det nødvendig å utnytte polarisering av lysfeltet. Ved å forsiktig rotere polarisering feltet eller prøven underlaget i små intervaller, er det mulig å overvåke orientering-avhengige spektroskopiske egenskaper av individuelle nanopartikler. Rotasjon og polarisering kan også hjelpe til med å avgjøre om en Spectral funksjon skyldes en dipolar eller høyere orden pendling av nanopartikkel overflate elektroner. Men i tilfelle av isotropic (dvs. sfærisk) nanopartikler, er Spectral profilen i hovedsak uendret ved å rotere prøven under polarisert lys.
Når de vises gjennom et DIC-mikroskop (figur 2), har nanopartikler en luftig disk med en skygge støpt hvit og svart utseende mot en grå bakgrunn. Sfæriske nanopartikler vil beholde denne utseende under rotasjon og med endring av bånd pass filtre; partiklene vil imidlertid gradvis forsvinne fra visningen ettersom filter ens sentrale bølgelengde blir ytterligere adskilt fra sfæren eneste dipolar LSPR bølgelengde11. Utseendet av nanoroder kan endre ganske dramatisk som de er rotert2. Nanoroder har to LSPR-band med dipolar adferd, hvor plasseringen er basert på de fysiske dimensjonene til nanoroder. Når den langsgående aksen i en nanorod er orientert parallelt med en av de DIC polarisering feltene, vil luftig platen vises alle hvite eller alle svarte hvis sett med en båndpassfilter knyttet til at LSPR bølgelengde. Etter roterende prøven 90 °, vil det ta på motsatt farge. Alternativt, siden tverrgående aksen av en nanorod er vinkelrett på langsgående aksen, vil stangen ta på motsatt farge når du skifter mellom filtre som samsvarer med LSPR bølgelengder for de to aksene. Ved andre retninger og filterinnstillinger, vil nanoroder vises mer som kuler, og presenterer en rekke skygge-cast luftig plate mønstre. For nanoroder med en tverrgående akse < 25 NM, kan det være vanskelig å oppdage signal på at LSPR bølgelengde bruker DIC mikroskopi.
For å utføre enkelt partikkel spektroskopi er det viktig å bruke de riktige optiske komponentene og justere dem riktig. En objektiv i stand til DIC mikroskopi må brukes. For enkelt partikkel eksperimenter er 80x-eller 100-mål olje målene ideelle. Nomarski DIC prismer vanligvis kommer i tre varianter: standard, høy kontrast, og høy oppløsning. Den ideelle typen avhenger sterkt av formålet med eksperimentet og størrelsen på nanopartikler. Standard prismer er bra for mange eksperimenter; men når du arbeider med mindre nanopartikler (< 50 NM), kan høy kontrast prismer være fordelaktig, siden partikkel kontrasten reduseres etter hvert som partiklene synker i størrelse11. Justering av DIC kontrasten oppnås enten ved å rotere en polarisator eller ved å oversette en av DIC prismer, avhengig av mikroskopet merke eller modell6.
Etter innstilling Kohler belysning og polarisator innstillinger, er det avgjørende å ikke justere disse innstillingene mens samle spektroskopi data. Videre må en konstant gjennomsnittlig bakgrunns signal opprettholdes til enhver tid under datainnsamlingen, selv når du skifter mellom filtre og vinkelinnstillinger. Den faktiske ideelle bakgrunns verdien avhenger av det dynamiske spekteret til det vitenskapelige kameraet, men generelt bør bakgrunnen være i størrelsesområdet 15% – 40% av det maksimale deteksjons nivået for kameraet. Dette reduserer sannsynligheten for å mette kamerasensoren samtidig som den muliggjør optimal partikkel kontrast. For innsamling av spektroskopi data, er det nødvendig å arbeide med et vitenskapelig kamera som fanger opp bilder i svart og hvitt, i motsetning til en farge kamera.
Prøveforberedelse er en annen kritisk aspekt av Imaging plasmonic nanopartikler. Det er viktig at operatørene av DIC mikroskopi har en forståelse av utvalget optiske egenskaper og av prøven er underlaget. “Pre-renset” mikroskop glass er ikke tilstrekkelig forberedt for bildebehandling nanopartikler, og det må være skikkelig re-rengjøres før prøven deponering for å sikre uhindret observasjon av prøven. Mange rengjøring protokoller for mikroskop lysbilder har tidligere vært dokumentert12, men det er ikke et skritt som normalt er rapportert i eksperimentelle studier.
Til slutt, dataanalyse metoder er den endelige komponenten til enkelt partikkel spektroskopi. Maksimums-og minimums intensiteten for hver nanopartikkel må måles, i tillegg til den lokale bakgrunns gjennomsnittet. Partikler av interesse bør plasseres i områder uten bakgrunn rusk, substrat defekter, eller ujevn belysning. En metode for å bestemme Spectral profil av en nanopartikkel er ved å beregne partikkel kontrasten på hver bølgelengde, ved hjelp av ligningen under11,13,14,15:
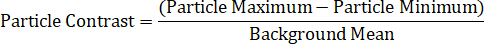
Alternativt kan en enkelt partikkel spektrum deles inn i sin individuelle maksimum og minimum signal komponenter, som representerer DIC to polarisering felt, og dermed viser de to samtidig samlet directionally-avhengige Spectra, gjennom de to likninger:
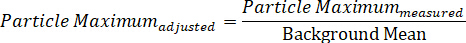
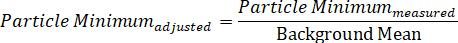
Protocol
Representative Results
Discussion
Når Imaging med DIC mikroskopi, er det avgjørende å optimalisere de optiske komponentene før du samler inn data. Selv mindre justeringer av polarisator midt i et eksperiment kan føre til betydelige innvirkninger på de endelige dataene6. Videre krever ulike materialer ulike polarisator innstillinger. Selv om store trinn størrelser ble benyttet her for å demonstrere effekten av polarisering vinkel, i et faktisk eksperiment, er det viktig å optimalisere polarisator innstillingen innen 1 °-2…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dr. Anthony S. stender ønsker å anerkjenne teknisk støtte gjennom nanoskala og Quantum fenomener Institute (NQPI) ved Ohio University. Denne artikkelen ble gjort mulig gjennom oppstart finansiering gitt til Dr. stender ved Ohio University.
Materials
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
References
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That’s Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. . Plasmonics: Fundamentals and Applications. , (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).

