Riabilitazione motoria strutturata dopo trasferimenti nervosi selettivi
Summary
Qui, presentiamo un protocollo per la riabilitazione motoria di pazienti con gravi lesioni nervose e chirurgia selettiva di trasferimento dei nervi. Ha lo scopo di ripristinare la funzione motoria proponendo diverse fasi nell’educazione del paziente, terapia in fase iniziale dopo l’intervento chirurgico e interventi per la riabilitazione dopo una riinnervazione di successo del bersaglio del nervo.
Abstract
Dopo gravi lesioni nervose, i trasferimenti nervosi selettivi offrono l’opportunità di ripristinare la funzione motoria e sensoriale. Il recupero funzionale dipende sia dal successo della riinnervazione degli obiettivi nella periferia sia dal processo di riapprendimento motorio che comporta la plasticità corticale. Mentre c’è un numero crescente di metodi per migliorare la riabilitazione, la loro attuazione di routine in un ambiente clinico rimane una sfida a causa della loro complessità e lunga durata. Pertanto, vengono presentate raccomandazioni per le strategie di riabilitazione con l’obiettivo di guidare medici e terapisti attraverso il processo di riabilitazione di lunga durata e fornire istruzioni passo-passo per sostenere il riapprendimento motorio.
Direttamente dopo l’intervento di trasferimento del nervo, non è presente alcuna funzione motoria e la terapia dovrebbe concentrarsi sulla promozione dell’attività nelle aree sensoriale-motorie della parte del corpo paralizzata. Dopo circa due o sei mesi (a seconda della gravità e della modalità di lesioni, della distanza di rigenerazione dei nervi e di molti altri fattori), la prima attività motoria può essere rilevata tramite elettromiografia (EMG). All’interno di questa fase di riabilitazione, il feedback multimodale viene utilizzato per ri-imparare la funzione motoria. Questo è particolarmente critico dopo i trasferimenti nervosi, come modelli di attivazione muscolare cambiano a causa della connessione neurale alterata. Infine, la forza muscolare dovrebbe essere sufficiente a superare la gravità/ resistenza dei muscoli antagonisti e rigidità articolare, e compiti più funzionali possono essere implementati nella riabilitazione.
Introduction
I trasferimenti nervosi selettivi forniscono un’opportunità per ripristinare la funzione motoria dopo le lesioni nervose quando il recupero da parte dell’uso di neurolisi, riparazione del nervo, o innesto nervoso non ci si può aspettare1,2. Possibili indicazioni per i trasferimenti nervosi sono gravi lesioni nervose distali, lesioni di tipo avulsione, la mancanza di radici nervose disponibili per l’innesto, le cicatrici estese sul sito delle lesioni e la ricostruzione ritardata3,4. In seguito a un infortunio del nervo motorio, la ricostruzione è critica in quanto la degenerazione del tessuto muscolare e delle piastre motorie consente solo la riinnervanizzazione muscolare di successo entro 1-2 anni dopo l’infortunio5,6. Qui, i trasferimenti nervosi forniscono il vantaggio di un tempo di riinnervazione relativamente breve dopo l’intervento chirurgico, in quanto consentono la coaptazione del nervo vicino al bersaglio. Questa procedura, nota anche come neurotizzazione, comporta il reindirizzamento chirurgico di un nervo intatto (nervo donatore) alla parte distale del nervo ricevente. Poiché questa connessione è distale al sito danneggiato del nervo destinatario, permette di bypassare il segmento nervo ferito7.
Poiché le vie neurali vengono alterate dopo l’intervento di trasferimento dei nervi, i pazienti non possono essere trattati con protocolli di terapia post-operatoria standard altrimenti utilizzati dopo la riparazione diretta del nervo8,9. Mentre gli assoni donatori diventano nel nuovo obiettivo, assumono una funzione che non avevano prima mentre sono ancora a caso ancora collegati alla loro funzione originale. Ad esempio, il trasferimento del nervo ulnare di Oberlin viene utilizzato per ripristinare la flessione del gomito dopo danni irreparabili al tronco superiore o alle radici nervose C5 e C61. Come mostrato nella Figura 1, si tratta di trasferire uno o più fascicoli nervosi ulnar al ramo motore muscolo-cutaneo del muscolobico10. Tuttavia, dopo il successo della riinnervazione, questi fascicle del nervo ulnare sono ancora cortically ancora collegati alla loro precedente funzione di flessione delle dita e/o rapimento e flessione ulnare del polso. A livello funzionale ciò implica che all’inizio della riabilitazione, il paziente deve concentrarsi sulla precedente funzione nervosa (chiusura a mano) al fine di attivare e rafforzare il muscolo del destinatario (contrazione dei bicipiti). Questo approccio è noto anche come “approccio di riabilitazione focalizzato per l’attivazione dei donatori”9.
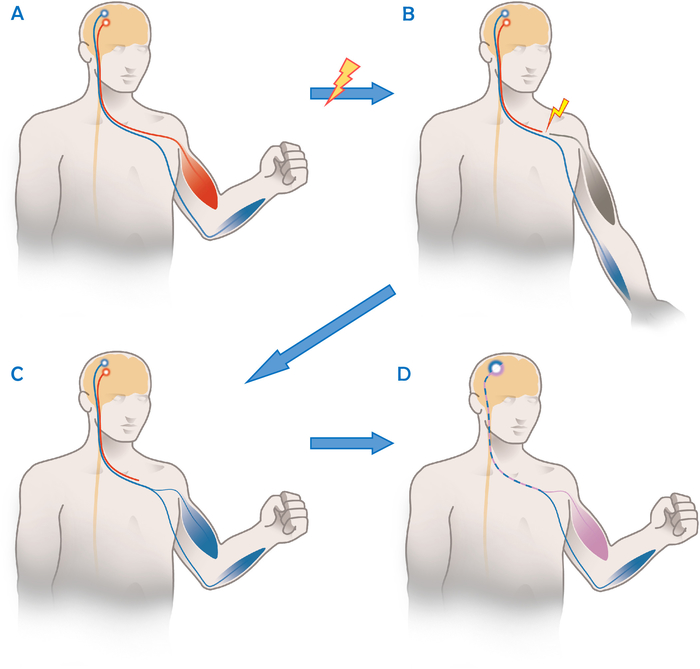
Figura 1: Illustrazione schematica del principio funzionale di un ulnare al trasferimento del nervo muscolo-cutaneo. (A) In una persona sana, c’è una netta separazione tra l’attività nella corteccia motoria per le funzioni di diversi nervi /joints come qui il nervo muscolo-cutaneo (rosso) e il nervo ulnare (blu). (B) Dopo una lesione del nervo muscolo-cutaneo, il muscolo bicipite non può essere attivato, mentre il nervo ulnare illeso (in blu) funziona ancora. (C). Dopo il trasferimento e la riinnervazione del nervo dell’Oberlin, i fascicoli del nervo ulnare controllano i muscoli del bicipite e tutti gli altri muscoli anatomicamente innervati dal nervo ulnare. Prima della riorganizzazione corticale, entrambi i muscoli vengono attivati insieme in quanto non vi è alcuna separazione corticale tra queste fibre nervose (in blu). (D) Con la riabilitazione di successo, il paziente ha imparato a utilizzare alcuni assoni corticali per le funzioni nervose ulnari “normali” (in blu), mentre altri (in viola) stanno ora controllando il muscolo del bicipite. Questo permette il movimento indipendente di entrambi i gruppi muscolari. Fare clic qui per visualizzare una versione più grande di questa figura.
Mentre la comprensione di questo concetto è alla base di una riabilitazione di successo, il riapprendimento di nuovi modelli motori può essere difficile per i pazienti e i medici. Ciò è dovuto alla lunga durata della riabilitazione, alla complessità della rigenerazione del nervo e alla riinnervazione e alla limitata quantità di attività muscolare direttamente osservabile durante la prima riinnervazione8. Oltre ai cambiamenti del sistema nervoso periferico, tra chirurghi e terapisti vi è una crescente consapevolezza per la rilevanza dei cambiamenti nel sistema nervoso centrale (SNC), vale a dire la riorganizzazione delle aree corticali motorie e sensoriali della mano che si verificano come conseguenza della denervazione11. Quando l’input neurale al SNC viene privato, l’area corticale associata diminuisce in una certa misura a scapito delle aree adiacenti12. Il ripristino della funzione, quindi, dipende dal recupero centrale della sua rappresentazione nel cervello. Negli ultimi anni, l’uso di metodi di biofeedback8 e gli approcci per supportare la riorganizzazione corticale13,14,15 ha portato a possibilità estese nella riabilitazione dopo trasferimenti nervosi. Tuttavia, a causa della complessità della terapia post-chirurgica, è importante fornire i giusti interventi al momento giusto13.
Pertanto, lo scopo di questo protocollo strutturato per la riabilitazione dopo trasferimenti nervosi selettivi è quello di fornire un approccio fattibile e olistico per sostenere il recupero motorio. Si basa sulle attuali raccomandazioni e sull’esperienza degli autori nell’incorporarla in un ambiente clinico. Il protocollo ha lo scopo di guidare medici, occupazionali e fisioterapisti e altri professionisti della salute attraverso il processo di riabilitazione di lunga durata.
Questo protocollo strutturato per la riabilitazione motoria è stato valutato in uno studio di fattibilità8 pazienti su cinque con lesioni del plesso brachiale, come mostrato nella Tabella 1. Tutti loro hanno ricevuto diversi trasferimenti nervosi (alcuni in combinazione con innesti nervosi) per ripristinare la funzione dell’estremità superiore. Pertanto, per motivi di chiarezza, quando si descrivono interventi specifici in questo protocollo, si riferiscono all’arto superiore. Nel dettaglio, prendiamo come esempio il trasferimento del nervo ulnare di Oberlin10, che è stato eseguito nei pazienti 1-3. Per questo, ci riferiamo a parti del nervo ulnare come il nervo donatore e il nervo muscolo-cutaneo è il nervo ricevente. Così, i bicipiti e muscoli brachialis sono i muscoli del ricevente essere ri-innervato da parti del nervo ulnare. Funzionalmente, questo significa che a seguito di un approccio focalizzato di attivazione del donatore9, movimenti associati all’attività nervosa ulnare (come la chiusura della mano o il rapimento ulnare del polso) vengono utilizzati per l’attivazione del muscolo bicipite direttamente dopo ri-innervazione. Tuttavia, gli esercizi basati su questo approccio possono essere eseguiti anche in altre parti del corpo. Se sono necessarie considerazioni speciali per implementarlo in altre parti del corpo (ad esempio, l’estremità inferiore), questo è sottolineato all’interno del protocollo.
Indipendentemente dalla parte del corpo colpita, le sessioni di terapia non devono superare i 30 min poiché i muscoli si affaticano poco dopo la riinnervazione8 e l’allenamento di successo richiede il pieno impegno e la messa a fuoco del paziente.
Protocol
Representative Results
Discussion
Recentemente, i trasferimenti nervosi sono stati sempre più utilizzati per ripristinare la funzione dopo gravi lesioni nervose prossimali con esiti promettenti1,4,31,32. Tuttavia, mentre vi è un consenso sul fatto che sono necessari programmi di formazione strutturata per promuovere cambiamenti neuroplastici benefici33,34,35, non esiste un protocollo strutturato disponibile per descrivere il motore dopo i trasferimenti nervosi passo dopo i trasferimenti nervosi. Pertanto, lo scopo del protocollo presentato era quello di fornire istruzioni dettagliate per la riabilitazione post-chirurgica per abbracciare i cambiamenti corticali e migliorare gli esiti chirurgici. A differenza di altri protocolli9,36, visualizzazione dell’attività muscolare tramite superficie EMG biofeedback è un elemento chiave nel protocollo presentato.
All’interno della terapia, l’educazione del paziente è un passo critico in quanto il paziente deve comprendere la procedura chirurgica piuttosto complessa ed essere istruito sulle attività migliorando lo stato di salute al fine di essere attivamente coinvolto nel lungo processo di riabilitazione8 , 13 del sistema , 37. C’è ampio consenso sul fatto che la ripetizione è fondamentale e che sono necessari esercizi quotidiani per la casa per rafforzare una rappresentazione corticale ben consolidata della mano8,34,38,39 . Oltre alle pure informazioni sul paziente, gli autori raccomandano vivamente un approccio centrato sul paziente per la riabilitazione. Questo comporta inoltre il trattamento del paziente come una persona unica, il coinvolgimento del paziente nella cura, una buona comunicazione medico-paziente e l’empowering del paziente. Nella riabilitazione medica, questo approccio influenza positivamente la soddisfazione del paziente e ne equivale40. Per quanto riguarda la riabilitazione motoria stessa, si raccomanda di avviare gli interventi prima della riinnervazione dei muscoli e di seguire un approccio focalizzato sull’attivazione del donatore9. Per garantire che l’attività muscolare venga rilevata il più presto possibile, è possibile utilizzare dispositivi di biofeedback EMG. Mentre gli autori sono consapevoli del fatto che i dispositivi di biofeedback EMG non sono ancora standard clinici, il loro uso è altamente raccomandato in quanto consentono di iniziare la riabilitazione motoria attiva precoce e forniscono un feedback prezioso sui muscoli appena ri-innervati8.
I principi descritti all’interno di questo protocollo possono essere applicati per diversi tipi di trasferimenti nervosi, anche se potrebbero essere necessarie modifiche all’interno del protocollo. Mentre il riapprendimento motorio è relativamente facile se sono stati utilizzati muscoli/nervi sinergici, l’uso di muscoli/nervi antagonisti richiede un tempo di riabilitazione più lungo e l’uso del biofeedback potrebbe essere ancora più importante3,8. Soprattutto nei casi in cui è necessaria una maggiore quantità di ripetizioni, i protocolli futuri potrebbero includere anche giochi seri per mantenere la motivazione del paziente41.
Poiché la tempistica della rigenerazione del nervo e la quantità di recupero dipende enormemente dalla lesione e dagli interventi chirurgici, non esiste una tempistica rigorosa per la riabilitazione. Invece, al terapeuta viene chiesto di procedere a seconda dei segni di recupero del motore come indicato nel protocollo. Allo stesso modo, è importante notare che il successo della chirurgia di trasferimento del nervo si basa su molti fattori tra cui il tipo e la gravità della lesione, le competenze del chirurgo, e l’esperienza, nonché l’età del paziente, lo stato di salute, la cognizione e la motivazione8 , 13 del sistema , 42 o più , 43. Mentre la riabilitazione è un pilastro principale per riacquistare la funzione dopo gravi lesioni nervose, anche il miglior programma per la rieducazione motoria non può migliorare la funzione, se ci sono una rigenerazione del nervo periferico inadeguata e la riinnervazione muscolare. Pertanto, gli autori raccomandano vivamente di vedere i pazienti regolarmente insieme all’interno di un team multidisciplinare per essere in grado di discutere se il recupero va come previsto o se sono necessari ulteriori interventi medici. Tuttavia, soprattutto dopo gravi lesioni come le avulsioni della radice nervosa C8 e Th1, i risultati realistici potrebbero non includere il recupero completo della funzione di estremità3,30. In questi casi, l’equipe clinica deve comunicarlo al paziente non appena è possibile affermare una prognosi realistica (circa un anno dopo i trasferimenti nervosi). A questo punto, ulteriori possibilità di riabilitazione, dispositivi di assistenza o interventi chirurgici (come trasferimenti tendini) devono essere discussi. Nei casi in cui, assolutamente nessuna funzione della mano ritorna, sostituire l’arto senza funzione con un dispositivo protesico può essere considerato come un’opzione e44,45. Questo è, tuttavia, raccomandato solo come ultima risorsa e dopo una valutazione fisica e psicologica approfondita46.
Mentre il focus della chirurgia del nervo periferico di solito si trova sulla ricostruzione della funzione motoria, i trasferimenti nervosi sensoriali sono talvolta utilizzati per ripristinare la sensazione di mano dopo gravi lesioni mediane o nervose ulnare4,47. Simile ai trasferimenti di nervi motori, questo crea vie neurali sensoriali alterate e si traduce in sensazioni che si sentono come se fossero originari della precedente area di innervazione del nervo donatore. Anche se non sono stati eseguiti trasferimenti di nervi sensoriali, ci può ancora essere cambiato / ridotto sensazione sia a causa della lesione stessa27 o a causa della morbilità lato donatore48. In questi casi, una rieducazione tempestiva può contribuire a migliorare la funzione sensoriale49e ridurre l’ipersensibilità indesiderata e il dolore che spesso si verifica dopo tali lesioni. Per garantire una buona funzione motoria e sensoriale, gli autori raccomandano vivamente di integrare la rieducazione motoria con approcci terapeutici su misura per promuovere la riorganizzazione nella corteccia sensoriale corrispondente e39,50, 51. Per quanto riguarda la rieducazione sensoriale, si raccomanda di avviare interventi prima di riinnervare la pelle49,52,53. Questo può includere la sostituzione della sensazione da altri sensi come visione53 o feedback uditivo54, così come fare uso della sovrapposizione di aree di innervazione sensoriale27,52. Non appena il paziente ha riacquistato una certa sensibilità, la gnosi tattile e il riconoscimento degli oggetti possono essere addestrati, pur mantenendo un’elevata quantità di input sensoriale34. Materiali tipici che possono essere utilizzati per questo, includono piatti self-made con superfici diverse da riconoscere con occhi chiusi (vedi Figura 2) o una scatola piena di fagioli / lenticchie / riso (vedi Figura 3).

Figura 2: Superfici diverse possono essere utilizzate per sostenere il recupero della sensibilità. Di solito, al paziente viene chiesto di toccarli prima con entrambe le mani, mentre lui /lei potrebbe provare in seguito a riconoscere le diverse superfici senza visione utilizzando solo la mano con sensibilità limitata. Fare clic qui per visualizzare una versione più grande di questa figura.
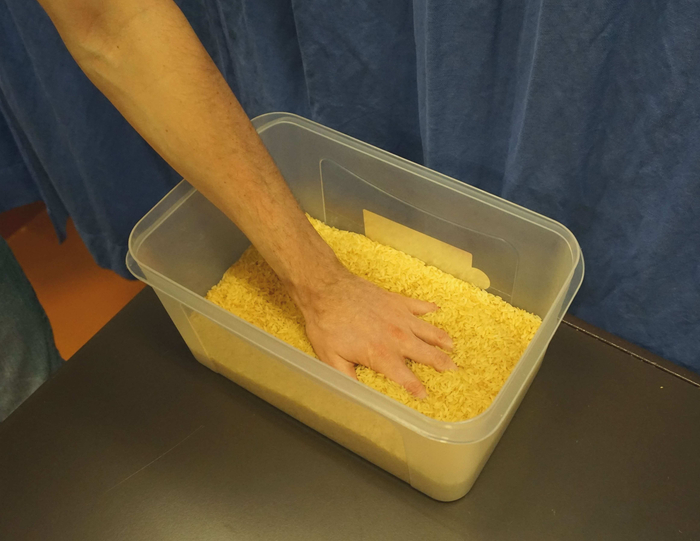
Figura 3: Una scatola piena di riso per la rieducazione sensoriale della mano. In terapia, il paziente potrebbe mettere la mano con sensibilità ridotta con attenzione in questa scatola e muovere lentamente la mano. Per focalizzare l’attenzione del paziente, il terapeuta può mettere alcuni piccoli oggetti (ad esempio, blocchi di legno o graffette) in questa scatola e chiedere di trovarli senza controllo visivo. Fare clic qui per visualizzare una versione più grande di questa figura.
Tuttavia, sia nella rieducazione sensoriale che motoria, vi sono solo prove limitate per quanto riguarda la scelta degli interventi necessari per promuovere una buona ripresa34. Ciò limita la validità del protocollo di riabilitazione proposto, come per altri protocolli. Mentre il protocollo descritto è stato valutato nell’ambito di uno studio di fattibilità e i risultati motori erano simili o leggermente migliori di quelli riportati nella letteratura8, questo studio è stato eseguito su un campione di piccole dimensioni e senza un gruppo di controllo. Ciò rende impossibile confrontare i risultati, i vantaggi e gli svantaggi di questo protocollo rispetto a quelli precedenti. Ulteriori ricerche devono includere studi controllati al fine di confrontare i possibili vantaggi dell’utilizzo del biofeedback EMG superficiale con gli approcci convenzionali.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo studio è stato finanziato dalla Fondazione di ricerca cristiana Doppler del Consiglio austriaco per la ricerca e lo sviluppo tecnologico e dal Ministero federale austriaco della scienza, della ricerca e dell’economia. Ringraziamo Petra Gettinger per la sua assistenza nella preparazione delle riprese e Aron Cserveny per la preparazione delle illustrazioni incluse nel manoscritto e nell’opuscolo di riabilitazione. Frontiere in Neuroscienze ha concesso il permesso di riprodurre i dati presentati nel documento originale.
Materials
| EMG electrodes | Otto bock Healthcare, Duderstadt, Germany | electrodes 13E202 = 50 | The EMG electrodes used in this study were bipolar and included a ground and a 50 Hz filter. They were used with the Moby. |
| Folding Mirror Therapy Box (Arm/Foot/Ankle) | Reflex Pain Management Therapy Store | This box was used for mirror therapy. | |
| Myoboy | Otto bock Healthcare, Duderstadt, Germany | Myoboy | This EMG Biofeedback device that can be used as stand alone device or with a computer. While this device was used in the presented pilot study, other (cheaper) devices for sEMG biofeedback training are available as well. |
| Recognise[TM] Flash Cards | noigroup | If no self-made cards for left-right discrimination are used, these can be purchased from noigroup.com. There, a mobile app for training is available as well. |
References
- Rohde, R. S., Wolfe, S. W. Nerve transfers for adult traumatic brachial plexus palsy (brachial plexus nerve transfer). HSS Journal. 3 (1), 77-82 (2007).
- Ray, W. Z., Mackinnon, S. E. Management of nerve gaps: Autografts, allografts, nerve transfers, and end-to-side neurorrhaphy. Experimental Neurology. 223 (1), 77-85 (2010).
- Tung, T. H., Mackinnon, S. E. Nerve Transfers: Indications, Techniques, and Outcomes. The Journal of Hand Surgery. 35 (2), 332-341 (2010).
- Isaacs, J., Cochran, A. R. Nerve transfers for peripheral nerve injury in the upper limb. Bone Joint Journal. 101 (2), 124-131 (2019).
- Terzis, J. K., Papakonstantinou, K. C. The surgical treatment of brachial plexus injuries in adults. Plastic and Reconstruction Surgery. 106 (5), (2000).
- Ray, W. Z., Mackinnon, S. E. Clinical Outcomes Following Median to Radial Nerve Transfers. The Journal of Hand Surgery. 36 (2), 201-208 (2011).
- Liu, Y., Lao, J., Gao, K., Gu, Y., Xin, Z. Outcome of nerve transfers for traumatic complete brachial plexus avulsion: results of 28 patients by DASH and NRS questionnaires. Journal of Hand Surgery European. 37 (5), 413-421 (2012).
- Sturma, A., Hruby, L. A., Prahm, C., Mayer, J. A., Aszmann, O. C. Rehabilitation of Upper Extremity Nerve Injuries Using Surface EMG Biofeedback: Protocols for Clinical Application. Frontiers in Neuroscience. 12 (906), (2018).
- Kahn, L. C., Moore, A. M. Donor Activation Focused Rehabilitation Approach: Maximizing Outcomes After Nerve Transfers. Hand Clinics. 32 (2), 263-277 (2016).
- Oberlin, C., et al. Nerve transfer to biceps muscle using a part of ulnar nerve for C5-C6 avulsion of the brachial plexus: anatomical study and report of four cases. Journal of Hand Surgery American. 19 (2), 232-237 (1994).
- Karl, A., Birbaumer, N., Lutzenberger, W., Cohen, L. G., Flor, H. Reorganization of motor and somatosensory cortex in upper extremity amputees with phantom limb pain. Journal of Neurosciences. 21 (10), 3609-3618 (2001).
- Makin, T. R., Bensmaia, S. J. Stability of Sensory Topographies in Adult Cortex. Trends in Cognitive Science. 21 (3), 195-204 (2017).
- Novak, C. B., Lvonder Heyde, R. Rehabilitation of the upper extremity following nerve and tendon reconstruction: when and how. Seminars in Plastic Surgery. 29 (1), 73-80 (2015).
- Lundborg, G. Brain plasticity and hand surgery: an overview. Journal of Hand Surgery Bristish. 25 (3), 242-252 (2000).
- Novak, C. B. Rehabilitation Following Motor Nerve Transfers. Hand Clinics. 24 (4), 417-423 (2008).
- Miller, C., Peek, A. L., Power, D., Heneghan, N. R. Psychological consequences of traumatic upper limb peripheral nerve injury: A systematic review. Hand Therapy. 22 (1), 35-45 (2016).
- Bailey, R., Kaskutas, V., Fox, I., Baum, C. M., Mackinnon, S. E. Effect of Upper Extremity Nerve Damage on Activity Participation, Pain, Depression, and Quality of Life. The Journal of Hand Surgery. 34 (9), 1682-1688 (2009).
- Moseley, G. L. . The graded motor imagery handbook. , (2012).
- Ramachandran, V. S., Rogers-Ramachandran, D. Synaesthesia in phantom limbs induced with mirrors. Proceedings of the Royal Society of Biological Sciences. 263 (1369), 377-386 (1996).
- Rothgangel, A. S., Braun, S. M., Beurskens, A. J., Seitz, R. J., Wade, D. T. The clinical aspects of mirror therapy in rehabilitation. International Journal of Rehabilitation Research. 34 (1), 1-13 (2011).
- Ramachandran, V. S., Hirstein, W. The perception of phantom limbs. The D. O. Hebb lecture. Brain. 121 (Pt 9), 1603-1630 (1998).
- Hubatka, G., Meyer, V. E. Immobilization of the injured hand. Helvetica Chirurgica Acta. 47 (1-2), 81-84 (1980).
- Merletti, R., Parker, P. A. Electromyography: Physiology, Engineering, and Non-Invasive Applications. Wiley IEEE-Press Verlag. , (2004).
- Götz-Neumann, K. . Gehen verstehen. Ganganalyse in der Physiotherapie. , (2016).
- Perry, J., Burnfield, J. M. . Gait Analysis: Normal and Pathological Function. , (2010).
- James, M. A. Use of the Medical Research Council muscle strength grading system in the upper extremity. The Journal of Hand Surgery American. 32 (2), 154-156 (2007).
- Bertelli, J. A., Ghizoni, M. F., Loure Iro Chaves, D. P. Sensory disturbances and pain complaints after brachial plexus root injury: a prospective study involving 150 adult patients. Microsurgery. 31 (2), 93-97 (2011).
- Ray, W. Z., Pet, M. A., Yee, A., Mackinnon, S. E. Double fascicular nerve transfer to the biceps and brachialis muscles after brachial plexus injury: clinical outcomes in a series of 29 cases. Journal of Neurosurgery. 114 (6), 1520-1528 (2011).
- Bertelli, J. A., Ghizoni, M. F. Reconstruction of C5 and C6 brachial plexus avulsion injury by multiple nerve transfers: spinal accessory to suprascapular, ulnar fascicles to biceps branch, and triceps long or lateral head branch to axillary nerve. The Journal of Hand Surgery American. 29 (1), 131-139 (2004).
- Wong, A. H., Pianta, T. J., Mastella, D. J. Nerve transfers. Hand Clinics. 28 (4), 571-577 (2012).
- Colbert, S. H., Mackinnon, S. E. Nerve Transfers for Brachial Plexus Reconstruction. Nerve Transfers. 24 (4), 341-361 (2008).
- Brown, J. M., Mackinnon, S. E. Nerve Transfers in the Forearm and Hand. Nerve Transfers. 24 (4), 319-340 (2008).
- Beisteiner, R., et al. New type of cortical neuroplasticity after nerve repair in brachial plexus lesions. Archives in Neurology. 68 (11), 1467-1470 (2011).
- Novak, C. B., von der Heyde, R. L. Evidence and techniques in rehabilitation following nerve injuries. Hand Clinics. 29 (3), 383-392 (2013).
- Dahlin, L. B., Andersson, G., Backman, C., Svensson, H., Bjorkman, A. Rehabilitation, Using Guided Cerebral Plasticity, of a Brachial Plexus Injury Treated with Intercostal and Phrenic Nerve Transfers. Frontiers in Neurology. 8, 72 (2017).
- Hill, J., et al. . The stages of rehabilitation following motor nerve transfer surgery. , (2019).
- Vikstrom, P., Carlsson, I., Rosen, B., Bjorkman, A. Patients’ views on early sensory relearning following nerve repair-a Q-methodology study. The Journal of Hand Therapy. 31 (4), 443-450 (2018).
- Anastakis, D. J., Malessy, M. J., Chen, R., Davis, K. D., Mikulis, D. Cortical plasticity following nerve transfer in the upper extremity. Hand Clinics. 24 (4), 425-444 (2008).
- Oud, T., Beelen, A., Eijffinger, E., Nollet, F. Sensory re-education after nerve injury of the upper limb: a systematic review. Clinical Rehabilitation. 21 (6), 483-494 (2007).
- Plewnia, A., Bengel, J., Korner, M. Patient-centeredness and its impact on patient satisfaction and treatment outcomes in medical rehabilitation. Patient Education Counselling. 99 (12), 2063-2070 (2016).
- Prahm, C., Kayali, F., Sturma, A., Aszmann, O. PlayBionic: Game-Based Interventions to Encourage Patient Engagement and Performance in Prosthetic Motor Rehabilitation. Physical Medicine & Rehabilitation. 10 (11), 1252-1260 (2018).
- Rosen, B., Lundborg, G., Dahlin, L. B., Holmberg, J., Karlson, B. Nerve repair: correlation of restitution of functional sensibility with specific cognitive capacities. Journal of Hand Surgery. 19 (4), 452-458 (1994).
- Lundborg, G., Rosen, B. Sensory relearning after nerve repair. Lancet. 358 (9284), 809-810 (2001).
- Aszmann, O. C., et al. Bionic reconstruction to restore hand function after brachial plexus injury: a case series of three patients. Lancet. 385 (9983), 2183-2189 (2015).
- Hruby, L. A., et al. Algorithm for bionic hand reconstruction in patients with global brachial plexopathies. Journal of Neurosurgery. , 1-9 (2017).
- Hruby, L. A., Pittermann, A., Sturma, A., Aszmann, O. C. The Vienna psychosocial assessment procedure for bionic reconstruction in patients with global brachial plexus injuries. PloS One. 13 (1), e0189592 (2018).
- Soldado, F., Bertelli, J. A., Ghizoni, M. F. High Median Nerve Injury: Motor and Sensory Nerve Transfers to Restore Function. Hand Clinics. 32 (2), 209-217 (2016).
- Li, X. M., et al. Donor-side morbidity after contralateral C-7 nerve transfer: results at a minimum of 6 months after surgery. Journal of Neurosurgery. 124 (5), 1434-1441 (2016).
- Rosen, B., Lundborg, G. Sensory re-education after nerve repair: aspects of timing. Handchirurgie Mikrochirurgie Plastiche Chirurgie. 36 (1), 8-12 (2004).
- Jerosch-Herold, C. Sensory relearning in peripheral nerve disorders of the hand: a web-based survey and delphi consensus method. Journal of Hand Therapy. 24 (4), 292-298 (2011).
- Rosén, B., Lundborg, G., Skirven, T. M., Osterman, A. L., Fedorczyk, J. M., Amadio, P. C. . Rehabilitation of the Hand and Upper Extremity. 6, (2011).
- Daniele, H. R., Aguado, L. Early compensatory sensory re-education. Journal of Reconstructive Microsurgery. 19 (2), 107-110 (2003).
- Rosen, B., et al. Enhanced early sensory outcome after nerve repair as a result of immediate post-operative re-learning: a randomized controlled trial. Journal of Hand Surgery European Volume. 40 (6), 598-606 (2015).
- Rosen, B., Lundborg, G. Early use of artificial sensibility to improve sensory recovery after repair of the median and ulnar nerve. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery. 37 (1), 54-57 (2003).

