Análise e Especificação das Distribuições de Tamanho do Granulo de Amido
Summary
Apresentado aqui é um procedimento para determinações reprodutíveis e estatisticamente válidas de distribuições de tamanho de grânulo de amido, e para especificar as distribuições de tamanhonormal de enrasculado determinados do granulo usando uma forma multiplicativa de dois parâmetros. É aplicável a todas as análises de dimensionamento de grânulos de amostras de amido em escala grama para pesquisa em ciência vegetal e alimentar.
Abstract
Amido de todas as fontes de plantas são compostos de grânulos em uma variedade de tamanhos e formas com diferentes frequências de ocorrência, ou seja, exibindo um tamanho e uma distribuição deforma. Os dados de tamanho do grânulo de amido determinados usando vários tipos de técnicas de dimensionamento de partículas são muitas vezes problemáticos devido à baixa reprodutibilidade ou falta de significância estatística resultante de alguns erros sistemáticos intransponíveis, incluindo sensibilidade às formas de grânulo e limites de tamanhos amostrais de grânulo. Delineamos um procedimento para determinações reprodutíveis e estatisticamente válidas das distribuições de tamanho do grânulo de amido usando a técnica da zona de sensoriamento elétrico, e para especificar as distribuições determinadas de tamanho de lognormal do grânulo usando uma forma multiplicativa de dois parâmetros adotada com melhor precisão e comparabilidade. É aplicável a todas as análises de dimensionamento de grânulos de amostras de amido em escala grama e, portanto, poderia facilitar estudos sobre como os tamanhos do grânulo de amido são moldados pelo aparelho e mecanismos de biosíntese de amido; e como eles impactam propriedades e funcionalidades de amidos para alimentos e usos industriais. Os resultados representativos são apresentados a partir de análises de réplica das distribuições de tamanho de granuloso de amostras de amido de doce de pote de milho utilizando o procedimento descrito. Discutimos ainda vários aspectos técnicos fundamentais do procedimento, especialmente, a especificação multiplicativa das distribuições de tamanhonormal do granulo lognormal e alguns meios técnicos para superar o bloqueio frequente de abertura por agregados de grânulos.
Introduction
Os grânulos de amido são a estrutura física na qual dois polímeros homoglucanos de reserva principal em fotossíntese vegetal e tecidos de armazenamento, a amilolose linear ou pouco ramificada e a amilódeina altamente ramificada, são embaladas ordenadamente junto com alguns componentes menores, incluindo lipídios e proteínas. Grânulos de amido de várias espécies vegetais exibem muitas formas tridimensionais (3D) (revisadas em ref.1,2), incluindo esferas, elipsoides, poliedros, plaquetas, cubos, cuboides e tubulos irregulares. Mesmo aqueles do mesmo tecido ou tecidos diferentes da mesma espécie vegetal poderiam ter um conjunto de formas com frequências de ocorrência variadas. Em outras palavras, grânulos de amido de uma espécie de planta podem ter uma distribuição estatística característica, em vez de uma forma específica. As formas de grânulo não uniforme e não esférica dificultam a medição adequada e a definição dos tamanhos do grânulo do amido. Além disso, os grânulos de amido dos mesmos tecidos de uma espécie vegetal são de uma gama de tamanhos com diferentes proporções, ou seja, exibindo uma distribuição de tamanho característica. Essa distribuição de tamanho complica ainda mais a análise e descrição dos tamanhos do grânulo de amido.
Os tamanhos do grânulo de amido foram analisados utilizando várias categorias de técnicas de dimensionamento de partículas (revisadas no ref.3), incluindo microscopia, sedimentação/fracionamento de fluxo de campo esterico (Sd/StFFF), difração a laser e zona de sensoriamento elétrico (ESZ). No entanto, essas técnicas não são igualmente adequadas para a determinação de tamanhos de grânulos de amido na presença de uma forma de grânulo e uma distribuição de tamanho. A microscopia, incluindo microscopia eletrônica leve, confocal e de varredura, é excelente para os estudos de morfologia4,5,6,7, estrutura8,9 e desenvolvimento10,11 de grânulos de amido, mas dificilmente adequado para definir suas distribuições de tamanho devido a algumas deficiências inerentes. Medições diretas de imagens de grânulos microscópicos ou análise de imagem assistida por software de dados de microscopia óptica (IAOM), que têm sido usados para a determinação de tamanhos de grânulos de amidos de várias espécies, incluindo milho12, trigo13,14, batata15 e cevada16, pode medir apenas tamanhos 1D (geralmente comprimento máximo) ou 2D (área de superfície) de números muito limitados (dezenas a alguns milhares) de imagens de grânulo de amido. Os pequenos tamanhos de amostragem de grânulos inerentemente constrangidos pelas técnicas raramente poderiam ser estatisticamente representativos, considerando os enormes números de granulo por unidade de peso de amido (~120 x 106 por grama, assumindo todas as esferas de 10 μm em densidade de 1,5 g/cm³), e, portanto, poderia levar à baixa reprodutibilidade dos resultados. A técnica Sd/StFFF pode ter alta velocidade e resolução, e frações de tamanho estreito de grânulos de amido17,mas raramente tem sido usada provavelmente porque sua precisão pode ser severamente afetada por danos, diferentes formas e densidade de grânulos de amido. A técnica de difração a laser é a mais utilizada, e tem sido aplicada para análises de tamanho de granulo de amido para todas as principais espécies de cultura3,14,16. Embora a técnica tenha muitas vantagens, na verdade não é adequada para determinações de tamanhos de grânulo de amido na presença de uma distribuição de forma de grânulo. A maioria dos instrumentos simultâneos de difração a laser dependem da teoria de dispersão de luzMie 18 para partículas esféricas uniformes e a teoria miemodificada 18 para algumas outras formas de uniformidade. A técnica é, portanto, inerentemente muito sensível às formas de partículas, e não é inteiramente adequada mesmo para certas formas de uniformidade19, muito menos para grânulos de amido com um conjunto de formas de proporções variadas. A técnica ESZ mede a perturbação do campo elétrico proporcional ao volume da partícula que passa por uma abertura. Fornece tamanhos de volume de granulo, bem como as informações de distribuição de números e volumes, etc., em altas resoluções. Uma vez que a técnica ESZ é independente de quaisquer propriedades ópticas de partículas, incluindo cor, forma, composição ou índice refrativo, e os resultados são muito reprodutíveis, é particularmente adequado para determinar distribuições de tamanho de grânulos de amido com um conjunto de formas.
Os tamanhos do grânulo de amido também foram definidos usando muitos parâmetros. Muitas vezes foram descritos simplistamente por diâmetros médios, que em alguns casos foram os meios aritméticos dos comprimentos máximos microscopicamente medidos de imagens 2D12,20ou médias de diâmetros equivalentes da esfera3. Em outros casos, as distribuições de tamanho do grânulo foram especificadas utilizando-se faixas de tamanho21,22, o volume médio de distribuição ou diâmetro médio (equivalente de esfera, ponderado por número, volume ou área de superfície) assumindo uma distribuição normal14,23,24,25,26. Estes descritores de tamanhos de grânulo de amido de várias análises são de natureza muito diferente, e não estritamente comparáveis. Poderia ser muito enganoso se esses “tamanhos” de grânulos de amido de diferentes espécies ou mesmo os mesmos tecidos da mesma espécie fossem diretamente comparados. Além disso, o parâmetro de propagação (ou forma) das distribuições normais presumidas, ou seja, o desvio padrão σ (ou desvio padrão gráfico σg) medindo a largura da distribuição (ou seja, a disseminação dos tamanhos), tem sido ignorado na maioria dos estudos.
Para resolver os problemas críticos acima mencionados frente às análises de dimensionamento do grânulo de amido, delineamos um procedimento para determinações reprodutíveis e estatisticamente válidas das distribuições de tamanho de grânulo de amostras de amido usando a técnica ESZ, e para especificar adequadamente as distribuições de tamanho periculoso de granulo determinado usando uma forma multiplicativa de dois parametradosadotadas 27 com melhor precisão e comparabilidade. Para validação e demonstração, realizamos análises de dimensionamento de grânulos de réplica de amostras de amido de doce de pote usando o procedimento, e especificamos as distribuições de volume-volume-diâmetro de volume-quantidade equivalente de volume-equivalente de volume-equivalente lognormal usando seus meios 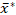 geométricos gráficos e desvios padrão multiplicativos s* em uma forma
geométricos gráficos e desvios padrão multiplicativos s* em uma forma 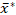 x/ (multiplique e divida) s*
x/ (multiplique e divida) s*
Protocol
Representative Results
Discussion
O procedimento delineado resolveu algumas questões críticas em vários métodos existentes para análises de tamanho de grânulo de amido, incluindo dimensionamento 1D ou 2D inadequado de grânulos 3D, distorção das medidas de dimensionamento devido a formas de grânulo não uniforme, baixa reprodutibilidade e validade estatística duvidosa devido a tamanhos limitados de amostra de granulo, especificações imprecisas ou inadequadas (especialmente o uso do tamanho médio) de tamanhos de grânulo na presença de forma…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho é parcialmente apoiado pelo Centro de Pesquisa agropecuária cooperativa e pelo Centro Integrado de Pesquisa em Segurança Alimentar da Faculdade de Agricultura e Ciências Humanas da Prairie View A&M University. Agradecemos a Hua Tian por seu apoio técnico.
Materials
| Analytical beaker | Beckman Coulter Life Sciences | A35595 | Smart-Technology (ST) beaker |
| Aperture tube, 100 µm | Beckman Coulter Life Sciences | A36394 | For the MS4E, , 1000 µm |
| Disposable transfer pipettor, | Fisher Scientific (Fishersci.com) | 13-711-9AM | Other disposable transfer pipettors with similar orifice can also be used. |
| Fisherbrand Conical Polypropylene Centrifuge Tubes, 50 ml | Fisher Scientific (Fishersci.com) | 05-539-13 | Any other similar types of tubes can be used. |
| Glass beakers, 150 to 250 ml | Fisher Scientific (Fishersci.com) | 02-540K | These beakers are used to contain methanol for washing the aperture tube and stirer between runs. |
| LiCl | Fisher Chemical | L121-100 | |
| Methanol | Fisher Chemical | A412-500 | Buy in bulk as the analysis uses a large quantity of methanol. |
| Mettler Toledo ML-T Precision Balances | Mettler Toledo | 30243412 | Any other precision balance with a readablity 0.01 g to 1 mg will work. |
| Multisizer 4e Coulter Counter | Beckman Coulter Life Sciences | B23005 | The old model, Multisizer 3 can also be used with slight adjustment of parameters. The 4e model comes with a 100 μm aperture tube. Other aperture tubes of different diameter can be purchased separately from the company. |
| Ultrasonic processor UP50H | Hielscher Ultrasound Technology | UP50H | Other laborator sonicator having a low-power (<50 Watt) output can be also used. Both MS1 and MS2 sonotrodes for the particular sonicator can be used to disperse starch granules in 5 ml methanol. Always use the lowest setting first, 20% amplitude and 0.1 or 0.2 cycle, and raise the setting if aggregates persist in suspension. |
References
- Shannon, J. C., Garwood, D. L., Boyer, C. D., BeMiller, J., Whistler, R. . Starch:Chemistry and Technology Food Science and Technology. , 23-82 (2009).
- Singh, N., Singh, J., Kaur, L., Singh Sodhi, N., Singh Gill, B. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chemistry. 81 (2), 219-231 (2003).
- Lindeboom, N., Chang, P. R., Tyler, R. T. Analytical, biochemical and physicochemical aspects of starch granule size, with emphasis on small granule starches: a review. Starch – Stärke. 56 (34), 89-99 (2004).
- Baldwin, P. M., Davies, M. C., Melia, C. D. Starch granule surface imaging using low-voltage scanning electron microscopy and atomic force microscopy. International Journal of Biological Macromolecules. 21 (1-2), 103-107 (1997).
- Jane, J. L., Kasemsuwan, T., Leas, S., Zobel, H., Robyt, J. F. Anthology of starch granule morphology by scanning electron microscopy. Starch-Stärke. 46 (4), 121-129 (1994).
- Matsushima, R., Nakamura, Y. . Starch: Metabolism and Structure. , 425-441 (2015).
- Wang, S. -. q., Wanf, L. -. l., Fan, W. -. h., Cao, H., Cao, B. -. s. Morphological analysis of common edible starch granules by scanning electron microscopy. Food Science. 32 (15), 74-79 (2011).
- Baldwin, P. M., Adler, J., Davies, M. C., Melia, C. D. Holes in starch granules: confocal, SEM and light microscopy studies of starch granule structure. Starch-Stärke. 46 (9), 341-346 (1994).
- Chakraborty, I., Pallen, S., Shetty, Y., Roy, N., Mazumder, N. Advanced microscopy techniques for revealing molecular structure of starch granules. Biophysical Reviews. 12 (1), 105-122 (2020).
- Bechtel, D. B., Wilson, J. D. Amyloplast formation and starch granule development in hard red winter wheat. Cereal Chemistry. 80 (2), 175-183 (2003).
- Evers, A. Scanning electron microscopy of wheat starch. III. Granule development in the endosperm. Starch-Stärke. 23 (5), 157-162 (1971).
- Wang, Y. J., White, P., Pollak, L., Jane, J. L. Characterization of starch structures of 17 maize endosperm mutant genotypes with Oh43 inbred line background. Cereal Chemistry. 70, 171-179 (1993).
- Peng, M., Gao, M., Abdel-Aal, E. S. M., Hucl, P., Chibbar, R. N. Separation and characterization of A-and B-type starch granules in wheat endosperm. Cereal Chemistry. 76, 375-379 (1999).
- Wilson, J. D., Bechtel, D. B., Todd, T. C., Seib, P. A. Measurement of wheat starch granule size distribution using image analysis and laser diffraction technology. Cereal Chemistry. 83 (3), 259-268 (2006).
- Liu, Q., Weber, E., Currie, V., Yada, R. Physicochemical properties of starches during potato growth. Carbohydrate Polymers. 51 (2), 213-221 (2003).
- Chmelik, J., et al. Comparison of size characterization of barley starch granules determined by electron and optical microscopy, low angle laser light scattering and gravitational field-flow fractionation. Journal of the Institute of Brewing. 107 (1), 11-17 (2001).
- Moon, M. H., Giddings, J. C. Rapid separation and measurement of particle size distribution of starch granules by sedimentation/steric field-flow fractionation. Journal of Food Science. 58 (5), 1166-1171 (1993).
- Wriedt, T., Wolfram, H., Wriedt, T. . The Mie Theory: Basics and Applications. , 53-71 (2012).
- Schuerman, D. W., Wang, R. T., Gustafson, B. &. #. 1. 9. 7. ;. S., Schaefer, R. W. Systematic studies of light scattering. 1: Particle shape. Applied Optics. 20 (23), 4039-4050 (1981).
- Goering, K. J., Fritts, D. H., Eslick, R. F. A study of starch granule size and distribution in 29 barley varieties. Starch-Stärke. 25 (9), 297-302 (1973).
- Chen, Z., Schols, H. A., Voragen, A. G. J. Starch granule size strongly determines starch noodle processing and noodle quality. Journal of Food Sciences. 68 (5), 1584-1589 (2003).
- Dai, Z. M. Starch granule size distribution in grains at different positions on the spike of wheat (Triticum aestivum L.). Starch-Starke. 61 (10), 582-589 (2009).
- Edwards, M. A., Osborne, B. G., Henry, R. J. Effect of endosperm starch granule size distribution on milling yield in hard wheat. Journal of Cereal Science. 48 (1), 180-192 (2008).
- Karlsson, R., Olered, R., Eliasson, A. C. Changes in starch granule size distribution and starch gelatinization properties during development and maturation of wheat, barley and rye. Starch – Starke. 35 (10), 335-340 (1983).
- Li, W. -. Y., et al. Comparison of starch granule size distribution between hard and soft wheat cultivars in Eastern China. Agricultural Sciences China. 7 (8), 907-914 (2008).
- Park, S. H., Wilson, J. D., Seabourn, B. W. Starch granule size distribution of hard red winter and hard red spring wheat: Its effects on mixing and breadmaking quality. Journal of Cereal Science. 49 (1), 98-105 (2009).
- Limpert, E., Stahel, W. A., Abbt, M. Log-normal distributions across the sciences: keys and clues. Bioscience. 51 (5), 341-352 (2001).
- Gao, M., et al. Self-preserving lognormal volume-size distributions of starch granules in developing sweetpotatoes and modulation of their scale parameters by a starch synthase II (SSII). Acta Physiologiae Plantarum. 38 (11), 259 (2016).
- Wattebled, F., et al. STA11, a Chlamydomonas reinhardtii locus required for normal starch granule biogenesis, encodes disproportionating enzyme. Further evidence for a function of alpha-1,4 glucanotransferases during starch granule biosynthesis in green algae. Plant Physiology. 132 (1), 137-145 (2003).
- Ji, Y., Seetharaman, K., White, P. J. Optimizing a Small-Scale Corn-Starch Extraction Method for Use in the Laboratory. Cereal Chemistry. 81 (1), 55-58 (2004).
- Halloy, S., Whigham, P. The lognormal as universal descriptor of unconstrained complex systems: a unifying theory for complexity. Proceedings of the 7th Asia-Pacific Complex Systems Conference. , 309-320 (2004).
- Furusawa, C., Suzuki, T., Kashiwagi, A., Yomo, T., Kaneko, K. Ubiquity of log-normal distributions in intra-cellular reaction dynamics. Biophysics (Nagoya-shi). 1, 25-31 (2005).

