En proinflammatorisk, degenerativ organkulturmodel til at simulere tidlig intervertebrale diskose.
Summary
Denne protokol præsenterer en ny eksperimentel model af proinflammatorisk, degenerativ kvægorgankultur for at simulere tidlig intervertebral diskdegeneration.
Abstract
Symptomatisk intervertebrale disk (IVD) degeneration (IDD) er en stor socioøkonomisk byrde og er kendetegnet ved betændelse og vævsforringelse. På grund af manglen på årsagssammenhænge er der et presserende behov for innovative eksperimentelle organkulturmodeller for at studere de mekanismer, der er involveret i sygdommens progression, finde terapeutiske mål og reducere behovet for dyremodeller. Vi præsenterer her en ny, tredimensionel organkulturmodelprotokol, der efterligner det proinflammatoriske og kataboliske mikromiljø, som er til stede under IDD.
I første omgang blev kvæg kaudale IVD’er dissekeret, renset og dyrket i vævskulturmediet. Dynamisk fysiologisk eller patologisk belastning blev anvendt i en specialfremstillet bioreaktor i 2 timer om dagen. IVD’er blev tildelt en kontrolgruppe (høj glukosemedium, fysiologisk belastning, fosfatbufferet saltvandsindsprøjtning) og en patologisk gruppe (lavt glukosemedium, patologisk belastning, tumornekrosefaktor-alfainjektion) i fire dage. Der blev udført analyse af genekspression fra indsamlede kernen pulposusceller i IVD’erne og enzymrelateret immunosorbentanalyse af de betingede organkulturmedier.
Vores data afslørede et højere udtryk for inflammatoriske markører og reducerede skivehøjder efter indlæsning i den patologiske gruppe sammenlignet med kontrolgruppen. Denne protokol er pålidelig til at simulere IVD inflammation og degeneration og kan udvides yderligere for at udvide dens anvendelsesområde.
Introduction
Lbp (Low Back Pain) kan påvirke personer i alle aldre og er en af de vigtigste årsager til handicap på verdensplan1,2,3. De samlede omkostninger forbundet med LBP overstiger 100 mia. Symptomatisk intervertebrale disk (IVD) degeneration (IDD), en tilstand karakteriseret ved betændelse og vævsforringelse, er en væsentlig årsag til LBP6,7. Specifikt er IDD karakteriseret ved en gradvist udviklende nedbrydning af IVD’s ekstracellulære matrix (ECM), induceret og udløst af flere faktorer, der fører til en accelereret patologi, neurologiske lidelser og i sidste ende handicap. Desuden er IDD forbundet med frigivelsen af proinflammatoriske cytokiner, ændrede rygsøjlebiomekanik, angiogenese og nerveindvækst, hvilket øger smertefornemmelse, der helt forårsager kronisk LBP (aktiv discopati)6,8. Til dato omfatter behandlingsmuligheder discektomi og efterfølgende fusion af de tilstødende hvirvler, implantation af en IVD-protese eller ikke-kirurgiske tilgange, såsom ikke-steroide antiinflammatoriske lægemidler, opioider og muskelafslappende midler til patienter med IDD9. Begge nuværende standard terapeutiske muligheder, kirurgiske og ikke-kirurgiske, er kun delvist effektive og undlader at løse det underliggende biologiske problem9,10. Tidlig degenerativ disk disease er karakteriseret ved en indledende inflammatorisk vævsrespons, især en stigning i tumornekrosefaktor-alpha (TNF-alpha) udtryk11. Disse tidlige diskændringer sker primært på celleniveau uden at forstyrre diskarkitekturen og kan tidligere efterlignes af ernæringsmæssig mangel under proinflammatoriske tilstande12. Derfor er præcis simulering af in vivo-situationen for at undersøge disse degenerationsmekanismer og finde passende terapeutiske mål afgørende. Derudover spiller diskens mekaniske belastningsmiljø en central rolle i patologiske og fysiologiske ændringer af IVD. Derfor ville en kombination af disse tilgange bringe os et skridt fremad for at efterligne det komplekse mikromiljø af ivds in vivo. Der er i øjeblikket ingen undersøgelser i betragtning af aspektet af dynamisk belastning sammen med de proinflammatoriske og ernæringsmæssige omgivelser efter vores bedste viden.
Selv om store dyremodeller gør det muligt at undersøge potentielle relevante in vivo-interaktioner, er de dyre og arbejdsintensive. Da brugen af dyremodeller i forskning længe har været genstand for kontroverser, er reduktionen af antallet af dyr, der er nødvendige for at besvare vigtige forskningsspørgsmål, af stor interesse. Endelig er der i øjeblikket ingen ideel dyremodel til at efterligne IDD i IVD forskning13,14. Derfor er det nødvendigt at etablere en omkostningseffektiv og pålidelig udskiftning, såsom en organkulturmodel for at simulere IDD og tilknyttede inflammatoriske og degenerative processer. For nylig gav anvendelsen af denne protokol om oprettelse af en proinflammatorisk og degenerativ organkulturmodel til simulerer tidlig intervertebrale disk disease os mulighed for at undersøge effekten af antiinflammatoriske lægemidler i IDD-organkulturen15.
Her beskriver vi, hvordan man opnår kvæg intervertebral diske og fremkalde tilstanden af tidlige fase IDD via en katabolsk og proinflammatorisk mikromiljø forårsaget af direkte intradiscal injektion af tumor nekrose faktor-alpha (TNF-α) og degenerativ belastning i en bioreaktor under lav næringsrige medium betingelser. Figur 1 illustrerer forsøgsmodellen og viser den bioreaktor, der anvendes til at simulere degenerative og fysiologiske belastningsforhold.
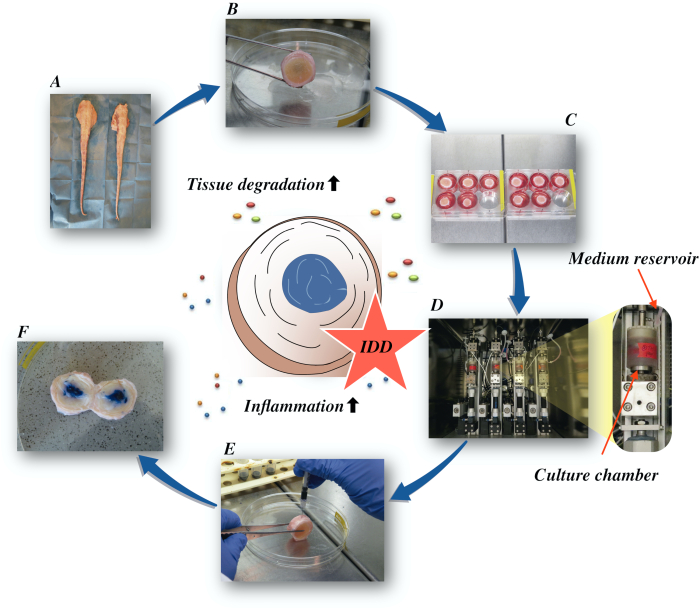
Figur 1: Illustration af den eksperimentelle opsætning. A: kvæghale; B: dissekeret mellemdiske diske af kvæg; C: overførsel af skiven til en brøndplade med dyrkningsmedium; D: indlæsning af simuleringen i en bioreaktor E: intradiscal injektionsteknik; F: IVD efter injektion af PBS/trypan blå farvestof for at afsløre distributionen. IDD: intervertebral disk degeneration. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Vi leverede her en detaljeret protokol til at simulere degenerativ og inflammatorisk IVDD. Denne protokol kan anvendes til detaljerede undersøgelser af inflammatoriske veje, der fører til de destruktive virkninger på disken. Desuden kan protokollen bidrage til at bestemme lovende terapeutiske mål, der er involveret i sygdommens progression.
Vi har for nylig vist, at human rekombinant TNF-α kunne fremkalde betændelse i både kvæg og humane NP celler21, som er i ov…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af AO Foundation og AOSpine International. Babak Saravi modtog stipendium støtte fra den tyske Spine Foundation og den tyske Slidgigt Foundation. Gernot Lang blev støttet af Berta-Ottenstein-programmet for forskere fra avancerede klinikere, Det Sundhedsvidenskabelige Fakultet, Universitetet i Freiburg, Tyskland.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
References
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

