En proinflammatorisk, degenerativ organkulturmodell for å simulere mellomvirvelskivesykdom i tidlig fase.
Summary
Denne protokollen presenterer en ny eksperimentell modell av proinflammatorisk, degenerativ bovinorgankultur for å simulere mellomvirvelskivedegenerering i tidlig fase.
Abstract
Symptomatisk intervertebrale plate (IVD) degenerasjon (IDD) er en stor sosioøkonomisk byrde og er preget av betennelse og vevsforringelse. På grunn av mangel på årsakssammenhenger er det et presserende behov for innovative eksperimentelle organkulturmodeller for å studere mekanismene som er involvert i sykdomsprogresjonen, finne terapeutiske mål og redusere behovet for dyremodeller. Vi presenterer her en ny, tredimensjonal organkulturmodellprotokoll som etterligner det proinflammatoriske og katabolske mikromiljøet, som er til stede under IDD.
I utgangspunktet ble bovine kaudale IVDer dissekert, rengjort og dyrket i vevskulturmediet. Dynamisk fysiologisk eller patologisk lasting ble brukt i en skreddersydd bioreaktor i 2 timer per dag. IVDer ble tildelt en kontrollgruppe (høyt glukosemedium, fysiologisk belastning, fosfatbufret saltvannsinjeksjon) og en patologisk gruppe (lavt glukosemedium, patologisk belastning, tumornekrosefaktor-alfainjeksjon) i fire dager. Genuttrykksanalyse fra innsamlede massosusceller av IVD-er og enzymbundet immunosorbentanalyse av de betingede organkulturmediene ble utført.
Våre data avdekket et høyere uttrykk for inflammatoriske markører og reduserte skivehøyder etter lasting i den patologiske gruppen sammenlignet med kontrollgruppen. Denne protokollen er pålitelig for å simulere IVD-betennelse og degenerasjon og kan utvides ytterligere for å utvide applikasjonsomfanget.
Introduction
Ryggsmerter (LBP) kan påvirke individer i alle aldre og er en ledende årsak til funksjonshemming over hele verden1,2,3. Den totale kostnaden forbundet med LBP overstiger $ 100 milliarder per år4,5. Symptomatisk intervertebrale plate (IVD) degenerasjon (IDD), en tilstand preget av betennelse og vevsforringelse, er en viktig årsak til LBP6,7. Spesielt er IDD preget av en gradvis utviklende nedbrytning av IVDs ekstracellulære matrise (ECM), indusert og utløst av flere faktorer som fører til en akselerert patologi, nevrologiske lidelser og til slutt funksjonshemming. Videre er IDD forbundet med frigjøring av proinflammatoriske cytokiner, endret ryggbiomekanikk, angiogenese og nervevekst, noe som øker smertefølelsen, og til sammen forårsaker kronisk LBP (aktiv diskopati)6,8. Til dags dato inkluderer behandlingsalternativer diskektomi og påfølgende fusjon av tilstøtende ryggvirvler, implantasjon av en IVD-protese eller ikke-kirurgiske tilnærminger, for eksempel ikke-steroide antiinflammatoriske legemidler, opioider og muskelavslappende midler for pasienter med IDD9. Både nåværende standard terapeutiske alternativer, kirurgiske og ikke-kirurgiske, er bare delvis effektive og unnlater å løse det underliggende biologiske problemet9,10. Tidlig degenerasjons skivesykdom er preget av en innledende inflammatorisk vevsrespons, spesielt en økning i tumornekrosefaktor-alfa (TNF-alfa) uttrykk11. Disse tidlige plateendringene skjer hovedsakelig på cellenivå uten å forstyrre platearkitekturen og kan tidligere etterlignes av ernæringsmessig mangel under proinflammatoriske forhold12. Derfor er presis simulering av in vivo-situasjonen for å undersøke disse degenerasjonsmekanismene og finne egnede terapeutiske mål avgjørende. I tillegg, til disse simuleringene av molekylære egenskaper, spiller det mekaniske lastemiljøet til platene en nøkkelrolle i patologiske og fysiologiske endringer av IVD. Følgelig vil det å kombinere disse tilnærmingene bringe oss et skritt fremover for å etterligne det komplekse mikromiljøet av IVDer in vivo. Det er for tiden ingen studier som vurderer aspektet av dynamisk lasting sammen med den proinflammatoriske og ernæringsmessige innstillingen etter beste evne.
Selv om store dyremodeller tillater undersøkelse av potensielle relevante in vivo-interaksjoner, er de kostbare og arbeidsintensive. Ettersom bruk av dyremodeller i forskning lenge har vært et spørsmål om kontrovers, er reduksjonen av antall dyr som trengs for å svare på viktige forskningsspørsmål av stor interesse. Til slutt er det for øyeblikket ingen ideell dyremodell for å etterligne IDD i IVD-forskning13,14. Derfor er det nødvendig å etablere en kostnadseffektiv og pålitelig erstatning, for eksempel en organkulturmodell for å simulere IDD og tilhørende inflammatoriske og degenerative prosesser. Nylig tillot anvendelsen av den nåværende protokollen om etablering av en proinflammatorisk og degenerativ organkulturmodell for å simulere mellomvirvelskivesykdom i tidlig fase oss å undersøke effekten av antiinflammatoriske legemidler i IDD-organkulturen15.
Her beskriver vi hvordan du oppnår bovine intervertebrale plater og induserer tilstanden til tidlig stadium IDD via en katabolsk og proinflammatorisk mikromiljø forårsaket av direkte intradiskal injeksjon av tumornekrosefaktor-alfa (TNF-α) og degenerativ belastning i en bioreaktor under lave næringsrike middels forhold. Figur 1 illustrerer den eksperimentelle modellen og viser bioreaktoren som brukes til å simulere degenerative og fysiologiske belastningsforhold.
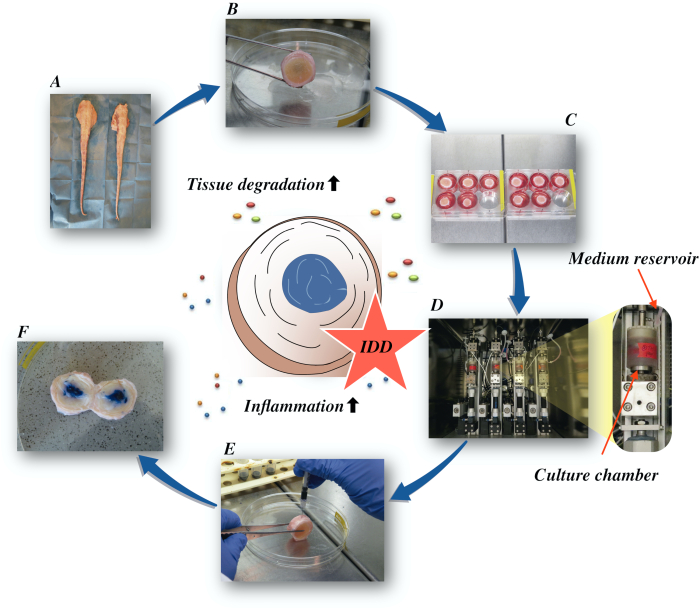
Figur 1: Illustrasjon av det eksperimentelle oppsettet. A: bovin hale; B: dissekerte bovine intervertebrale plater; C: overføring av platen til en brønnplate med kulturmedium; D: laste simuleringen i en bioreaktor; E: intradiskal injeksjonsteknikk; F: IVD etter injeksjon av PBS/trypan blå fargestoff for å avsløre distribusjon. IDD: mellomvirvelskive degenerasjon. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Vi har her gitt en detaljert protokoll for å simulere degenerativ og inflammatorisk IVDD. Denne protokollen kan brukes til detaljerte undersøkelser av inflammatoriske veier som fører til de ødeleggende effektene på platen. Videre kan protokollen bidra til å bestemme lovende terapeutiske mål involvert i sykdomsprogresjonen.
Vi viste nylig at human rekombinant TNF-α kunne indusere betennelse i både storfe og humane NP-celler21, som er i samsvar med andre studier …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av AO Foundation og AOSpine International. Babak Saravi fikk stipendstøtte fra den tyske ryggstiftelsen og den tyske osteoartrittstiftelsen. Gernot Lang ble støttet av Berta-Ottenstein-programmet for avanserte klinikerforskere, Det medisinske fakultet, Universitetet i Freiburg, Tyskland.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
References
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

