En proinflammatorisk, degenerativ organkulturmodell för att simulera intervertebral disc disease i ett tidigt skede.
Summary
Detta protokoll presenterar en ny experimentell modell av proinflammatoriska, degenerativa nötkreatur organ kultur att simulera tidigt stadium intervertebral skiva degeneration.
Abstract
Symptomatiskt intervertebral skiva (IVD) degeneration (IDD) är en stor socioekonomisk börda och kännetecknas av inflammation och vävnad nedbrytning. På grund av bristen på orsakssambehandlingar finns det ett akut behov av innovativa experimentella organkulturmodeller för att studera mekanismerna i sjukdomsförloppet, hitta terapeutiska mål och minska behovet av djurmodeller. Vi presenterar här ett nytt, tredimensionellt organkulturmodellprotokoll som efterliknar den proinflammatoriska och katabola mikromiljön, som finns under IDD.
Ursprungligen dissekerades, rengjordes och odlades nötkreatur caudal IVDs i vävnad kultur medium. Dynamiska fysiologiska eller patologiskt belastning tillämpades i en skräddarsydd bioreaktor i 2 timmar per dag. IVDs tilldelades en kontrollgrupp (hög glukos medium, fysiologisk belastning, fosfat-buffrad saltlösning injektion) och en patologisk grupp (låg glukos medium, patologiska belastning, tumör nekros faktor-alfa injektion) i fyra dagar. Genuttryck analys från insamlade kärnan pulposus celler i IVDs och enzym-linked immunosorbent analys av de betingade organ kultur medier utfördes.
Våra data visade ett högre uttryck för inflammatoriska markörer och minskade skivhöjder efter laddning i den patologiska gruppen jämfört med kontrollgruppen. Detta protokoll är tillförlitligt för att simulera IVD inflammation och degeneration och kan utökas ytterligare för att bredda dess tillämpningsomfång.
Introduction
Låg ryggsmärta (LBP) kan påverka individer i alla åldrar och är en ledande orsak till funktionshinder överhela världen 1,2,3. Den totala kostnaden i samband med LBP överstiger 100 miljarder USD per år4,5. Symptomatiskt intervertebral skiva (IVD) degeneration (IDD), ett tillstånd som kännetecknas av inflammation och vävnad nedbrytning, är en viktig orsak till LBP6,7. Specifikt kännetecknas IDD av en gradvis utvecklande nedbrytning av IVD: s extracellulära matris (ECM), inducerad och utlöst av flera faktorer som leder till en accelererad patologi, neurologiska störningar och så småningom funktionshinder. Dessutom är IDD förknippat med frisättning av proinflammatoriska cytokiner, förändrad ryggradsbiomekanik, angiogenes och nervväxt, vilket ökar smärtsensationen, vilket helt orsakar kronisk LBP (aktiv discopati)6,8. Hittills inkluderar behandlingsalternativ diskektomi och efterföljande fusion av angränsande ryggkotor, implantation av en IVD-protes eller icke-kirurgiska metoder, såsom icke-steroida antiinflammatoriska läkemedel, opioider och muskelavslappnande medel för patienter med IDD9. Båda nuvarande standard terapeutiska alternativ, kirurgiska och icke-kirurgiska, är bara delvis effektiva och misslyckas med att ta itu med det underliggande biologiskaproblemet 9,10. Tidig degenerativ skivsjukdom kännetecknas av en första inflammatorisk vävnad svar, särskilt en ökning av tumör nekros faktor-alfa (TNF-alfa) uttryck11. Dessa tidiga skivförändringar sker främst på cellnivå utan att störa skivarkitekturen och kan tidigare efterliknas av näringsbrist under proinflammatoriska tillstånd12. Därför är exakt simulering av in vivo-situationen för att undersöka dessa degenerationsmekanismer och hitta lämpliga terapeutiska mål avgörande. Dessutom, till dessa simuleringar av molekylära egenskaper, spelar den mekaniska laddningsmiljön för skivorna en nyckelroll i patologiska och fysiologiska förändringar av IVD. Att kombinera dessa tillvägagångssätt skulle därför föra oss ett steg framåt för att efterlikna den komplexa mikromiljön för IVD-ämnen in vivo. Det finns för närvarande inga studier som tar hänsyn till aspekten av dynamisk lastning tillsammans med den proinflammatoriska och näringsmässiga inställningen efter bästa kunskap.
Även om stora djurmodeller gör det möjligt att undersökning av potentiella relevanta in vivo-interaktioner, är de kostsamma och arbetsintensiva. Eftersom användningen av djurmodeller i forskning länge har varit en tvistefråga är minskningen av antalet djur som behövs för att besvara viktiga forskningsfrågor av stort intresse. Slutligen finns det för närvarande ingen idealisk djurmodell för att efterlikna IDD i IVD-forskning13,14. Därför är det nödvändigt att upprätta en kostnadseffektiv och pålitlig ersättning, till exempel en organkulturmodell för att simulera IDD och tillhörande inflammatoriska och degenerativa processer. Nyligen tillät tillämpningen av det nuvarande protokollet om upprättandet av en proinflammatorisk och degenerativ organkulturmodell för att simulera intervertebral disc disease i ett tidigt skede oss att undersöka effekten av antiinflammatoriska läkemedel i IDD organkultur15.
Här beskriver vi hur man får nötkreatur intervertebral skivor och inducera tillståndet av tidiga IDD via en katabol och proinflammatory microenvironment orsakas av direkt intradiscal injektion av tumör nekros faktor-alfa (TNF-α) och degenerativ belastning i en bioreaktor under låga näringsrika medium villkor. Figur 1 illustrerar den experimentella modellen och visar den bioreaktor som används för att simulera degenerativa och fysiologiska belastningsförhållanden.
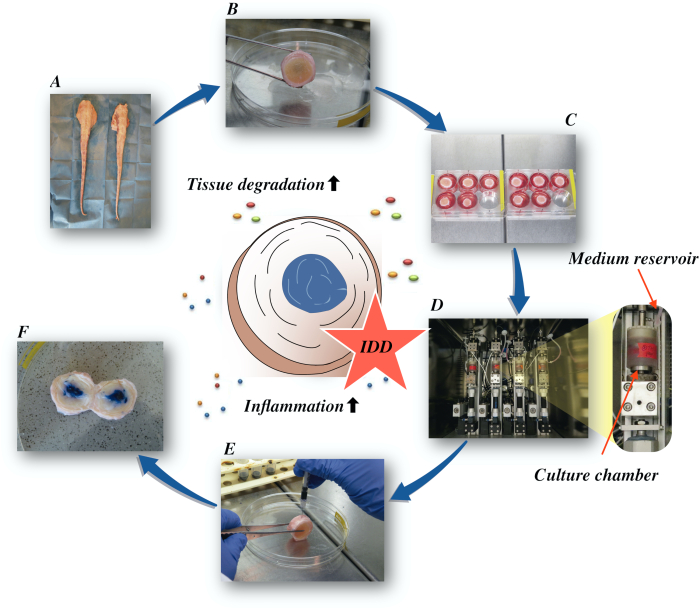
Bild 1: Illustration av den experimentella inställningen. A: nötkreaturssvans. B: dissekerade bovina intervertebral skivor, C: överföring av skivan till en brunnsplatta med odlingsmedium; D: Lastning av simuleringen i en bioreaktor. E: intradiscal injektionsteknik; F: IVD efter injektion av PBS/trypan blå färgämne för att avslöja distribution. IDD: degenerering av intervertebral skiva. Klicka här om du vill visa en större version av den här figuren.
Protocol
Representative Results
Discussion
Vi här tillhandahöll ett detaljerat protokoll för att simulera degenerativ och inflammatorisk IVDD. Detta protokoll kan tillämpas för detaljerade undersökningar av inflammatoriska vägar som leder till de destruktiva effekterna på skivan. Dessutom kan protokollet hjälpa till att bestämma lovande terapeutiska mål som är involverade i sjukdomsförloppet.
Vi visade nyligen att mänskliga rekombinanta TNF-α kan inducera inflammation i både nötkreatur och mänskligaN…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av AO Foundation och AOSpine International. Babak Saravi fick stipendiestöd från tyska Ryggradsstiftelsen och tyska Artrosstiftelsen. Gernot Lang stöddes av Berta-Ottenstein-programmet för avancerade kliniker, medicinska fakulteten, universitetet i Freiburg, Tyskland.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
References
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

