Erken Evre Intervertebral Disk Hastalığını Simüle Etmek için Proinflamatuar, Dejeneratif Organ Kültürü Modeli.
Summary
Bu protokol, erken evre intervertebral disk dejenerasyonunu simüle etmek için proinflamatuar, dejeneratif sığır organ kültürünün yeni bir deneysel modelini sunar.
Abstract
Semptomatik intervertebral disk (IVD) dejenerasyonu (IDD) önemli bir sosyoekonomik yüktür ve iltihaplanma ve doku bozulması ile karakterizedir. Nedensel tedavilerin eksikliği nedeniyle, hastalığın ilerlemesinde rol oynayan mekanizmaları incelemek, terapötik hedefler bulmak ve hayvan modellerine olan ihtiyacı azaltmak için yenilikçi deneysel organ kültürü modellerine acil ihtiyaç vardır. Burada, IDD sırasında mevcut olan proinflamatuar ve katabolik mikroçevrimini taklit eden yeni, üç boyutlu bir organ kültürü modeli protokolü sunuyoruz.
Başlangıçta, sığır kaudal IVD’leri doku kültürü ortamında parçalandı, temizlendi ve kültürlendi. Özel yapım bir biyoreaktörde günde 2 saat dinamik fizyolojik veya patolojik yükleme uygulandı. IVD’ler dört gün boyunca bir kontrol grubuna (yüksek glikoz ortamı, fizyolojik yükleme, fosfat tamponlu salin enjeksiyonu) ve patolojik bir gruba (düşük glikoz ortamı, patolojik yükleme, tümör nekroz faktörü-alfa enjeksiyonu) atandı. IVD’lerin toplanan çekirdek pulposus hücrelerinden gen ekspresyon analizi ve şartlandırılmış organ kültürü medyasının enzime bağlı immünosorbent tahlili yapıldı.
Verilerimiz, kontrol grubuna kıyasla patolojik gruba yüklendikten sonra enflamatuar belirteçlerin daha yüksek bir ekspresyonunun ve disk yüksekliklerinin azaldığını ortaya koydu. Bu protokol IVD inflamasyon ve dejenerasyon simüle etmek için güvenilirdir ve uygulama kapsamını genişletmek için daha da genişletilebilir.
Introduction
Bel ağrısı (LBP) her yaştan bireyi etkileyebilir ve dünya çapında engellilik için önde gelen bir nedendir1,2,3. LBP ile ilişkili toplam maliyet yılda 100 milyar doları aşıyor4,5. Semptomatik intervertebral disk (IVD) dejenerasyonu (IDD), iltihaplanma ve doku bozulması ile karakterize bir durum, LBP6,7’ninönemli bir nedenidir. Özellikle, IDD, IVD’nin hücre dışı matrisinin (ECM) giderek gelişen bir kırılımı ile karakterizedir, hızlandırılmış bir patolojiye, nörolojik bozukluklara ve sonunda sakatlığa yol açan birden fazla faktör tarafından indüklenir ve tetiklenir. Ayrıca, IDD proinflamatuar sitokinlerin, değiştirilmiş omurga biyomekaniklerinin, anjiogenezin ve sinir büyümesinin salınmasıyla ilişkilidir, bu da ağrı hissini arttırır, tamamen kronik LBP’ye (aktif diskopati) neden olur6,8. Bugüne kadar, tedavi seçenekleri arasında diskektomi ve bitişik omurların sonraki füzyonu, IVD protezinin implantasyonu veya IDD9hastaları için steroidal olmayan antienflamatuar ilaçlar, opioidler ve kas gevşeticiler gibi cerrahi olmayan yaklaşımlar yer almaktadır. Cerrahi ve cerrahi olmayan mevcut standart terapötik seçenekler sadece kısmen etkilidir ve alttaki biyolojik sorunu ele alamaz9,10. Erken evre dejeneratif disk hastalığı, ilk inflamatuar doku yanıtı, özellikle tümör nekroz faktörü-alfa (TNF-alfa) ifadesindeki artış ile karakterizedir11. Bu erken disk değişiklikleri öncelikle disk mimarisini bozmadan hücresel düzeyde meydana gelir ve daha önce pro-enflamatuar koşullar altında beslenme eksikliği ile taklit edilebilir12. Bu nedenle, bu dejenerasyon mekanizmalarını araştırmak ve uygun terapötik hedefleri bulmak için in vivo durumun hassas simülasyonu çok önemlidir. Ek olarak, moleküler özelliklerin bu simülasyonlarında, disklerin mekanik yükleme ortamı IVD’nin patolojik ve fizyolojik değişimlerinde önemli bir rol oynar. Sonuç olarak, bu yaklaşımları birleştirmek, ivd’lerin karmaşık mikroçevrimini taklit etmek için bizi bir adım öne çıkaracaktır. Şu anda, en iyi bilgimiz olan pro-enflamatuar ve beslenme ayarı ile birlikte dinamik yüklemenin yönü göz önünde bulundurularak herhangi bir çalışma bulunmamaktadır.
Büyük hayvan modelleri potansiyel ilgili in vivo etkileşimlerinin araştırılmasına izin verse de, maliyetlidir ve yoğun çalışırlar. Ayrıca, hayvan modellerinin araştırmada kullanılması uzun zamandır tartışma konusu olduğundan, önemli araştırma sorularını yanıtlamak için gereken hayvan sayısının azaltılması büyük ilgi görüyor. Son olarak, şu anda IVD araştırmasında kimliği taklit etmek için ideal bir hayvan modeli yoktur13,14. Bu nedenle, IDD ve ilişkili enflamatuar ve dejeneratif süreçleri simüle etmek için bir organ kültürü modeli gibi uygun maliyetli ve güvenilir bir değiştirme oluşturmak gerekir. Son zamanlarda, erken evre intervertebral disk hastalığını simüle etmek için proinflamatuar ve dejeneratif bir organ kültürü modelinin kurulmasına ilişkin mevcut protokolün uygulanması, anti-enflamatuar ilaçların IDD organ kültüründeki etkisini araştırmamıza izin verdi15.
Burada, düşük besleyici ortam koşullarında tümör nekroz faktör-alfanın (TNF-α) doğrudan intradiskal enjeksiyonu ve bir biyoreaktörde dejeneratif yüklemenin neden olduğu katabolik ve proinflamatuar bir mikroçevre yoluyla sığırlar arası disklerin nasıl elde edildiğini ve erken evre IDD durumunun nasıl teşvik edildiğini açıklıyoruz. Şekil 1 deneysel modeli gösterir ve dejeneratif ve fizyolojik yükleme koşullarını simüle etmek için kullanılan biyoreaktörü gösterir.
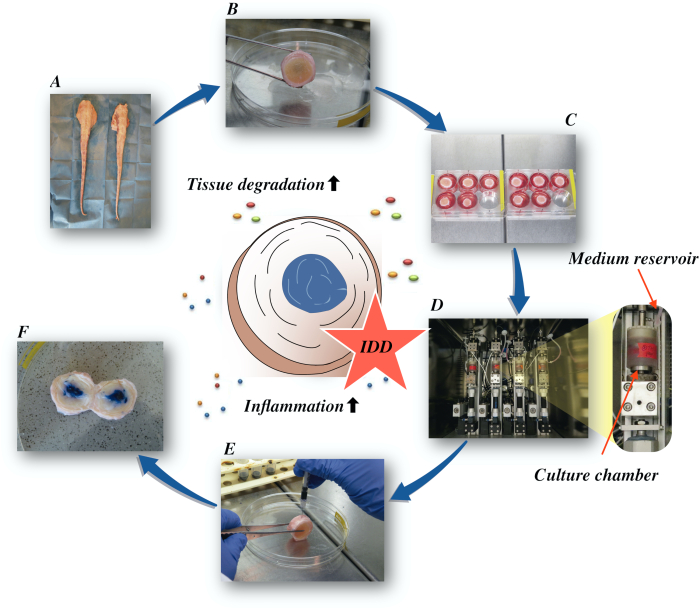
Şekil 1: Deneysel kurulumun illüstrasyonu. A: sığır kuyruğu; B: parçalanmış sığır intervertebral diskler; C: diskin kültür ortamına sahip iyi bir plakaya aktarılması; D: simülasyonun bir biyoreaktöre yüklenmesi; E: intradiskal enjeksiyon tekniği; F: DAĞıTıMı ORTAYA ÇıKARMAK İçİn PBS/trypan mavi boya enjeksiyonundan sonra IVD. IDD: intervertebral disk dejenerasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Burada dejeneratif ve inflamatuar IVDD’yi simüle etmek için ayrıntılı bir protokol sağladık. Bu protokol, disk üzerindeki yıkıcı etkilere yol açan enflamatuar yolların ayrıntılı muayeneleri için uygulanabilir. Ayrıca, protokol hastalığın ilerlemesinde rol oynayan umut verici terapötik hedefleri belirlemeye yardımcı olabilir.
Son zamanlarda gösterdik ki insan rekombinant TNF-α hem sığır hem de insan NP hücrelerinde iltihaplanmaya neden olabilir21<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma AO Foundation ve AOSpine International tarafından desteklendi. Babak Saravi, Alman Omurga Vakfı ve Alman Osteoartrit Vakfı’ndan burs desteği aldı. Gernot Lang, Almanya Freiburg Üniversitesi Tıp Fakültesi İleri Klinisyen Bilim adamları için Berta-Ottenstein-Programı tarafından desteklendi.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
References
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

