استخدام جهاز مساعدة البطين عن طريق الجلد / الأذين الأيسر إلى نظام تجاوز الشريان الفخذي للصدمة القلبية
Summary
توضح المقالة التالية الإجراء التدريجي لوضع جهاز (مثل Tandemheart) في صدمة القلب (CS) وهو جهاز مساعدة البطين الأيسر عن طريق الجلد (pLVAD) ونظام تجاوز الشريان الفخذي الأيسر (LAFAB) الذي يتجاوز البطين الأيسر (LV) في CS ويدعمه.
Abstract
نظام تجاوز الشريان الأذيني الأيسر إلى الشريان الفخذي (LAFAB) هو جهاز دعم الدورة الدموية الميكانيكي (MCS) المستخدم في صدمة القلب (CS) الذي يتجاوز البطين الأيسر عن طريق تصريف الدم من الأذين الأيسر (LA) وإعادته إلى الدورة الدموية الشريانية الجهازية عبر الشريان الفخذي. ويمكن أن توفر تدفقات تتراوح بين 2.5-5 لتر / دقيقة اعتمادا على حجم القنية. هنا ، نناقش آلية عمل LAFAB ، والبيانات السريرية المتاحة ، ومؤشرات لاستخدامه في صدمة القلب ، وخطوات الزرع ، والرعاية بعد الإجراءات ، والمضاعفات المرتبطة باستخدام هذا الجهاز وإدارته.
كما نقدم فيديو موجزا للمكون الإجرائي للعلاج بالجهاز، بما في ذلك إعداد ما قبل التنسيب، ووضع الجهاز عن طريق ثقب عبر الجلد تحت التوجيه صدى القلب وإدارة معلمات الجهاز بعد الجراحة.
Introduction
صدمة القلب (CS) هي حالة نقص التروية في الأنسجة مع أو بدون انخفاض ضغط الدم المصاحب ، حيث لا يستطيع القلب تقديم ما يكفي من الدم والأوكسجين لتلبية متطلبات الجسم ، مما يؤدي إلى فشل الأعضاء. وتصنفه جمعية تصوير الأوعية الدموية القلبية الوعائية والتدخلات (SCAI): المرحلة A – المرضى المعرضين لخطر الإصابة ب CS؛ المرحلة A- 2000- 2003. المرحلة B – المرضى في المرحلة الأولى من CS مع انخفاض ضغط الدم أو عدم دقات القلب دون نقص التروية. المرحلة C – CS الكلاسيكية مع النمط الظاهري الباردة والرطبة التي تتطلب inotropes / فاسوبريسورس أو الدعم الميكانيكي للحفاظ على التغلغل؛ المرحلة D – تدهور الدعم الطبي أو الميكانيكي الحالي الذي يتطلب تصعيدا للأجهزة الأكثر تقدما؛ والمرحلة E – تشمل المرضى الذين يعانون من انهيار الدورة الدموية وعدم انتظام ضربات القلب الحراري الذين يعانون بنشاط من توقف القلب مع الإنعاش القلبي الرئوي المستمر1. الأسباب الأكثر شيوعا ل CS هي MI الحاد (AMI) التي تمثل 81٪ من الحالات في تحليل تم الإبلاغ عنه مؤخرا2 ، وفشل القلب الحاد المعوض (ADHF). يتميز CS تقليديا بالاحتقان وضعف التشوه ، والذي يتجلى في ضغوط التعبئة المرتفعة (ضغط إسفين الشعيرات الدموية الرئوية [PCWP] ، والضغط البطيني الأيسر النهائي الانبساطي [LVEDP] ، والضغط الوريدي المركزي [CVP] ، والضغط الانبساطي البطيني الأيمن [RVEDP]) ، وانخفاض الناتج القلبي (CO) ، ومؤشر القلب (CI) ، وإخراج الطاقة القلبية (CPO) ، وعطل الجهاز النهائي3 . في الماضي ، كانت العلاجات الوحيدة المتاحة ل AMI المعقدة بسبب CS هي إعادة الأوعية الدموية المبكرة والإدارة الطبية مع inotropes و / أو vasopressors4. وفي الآونة الأخيرة، ومع ظهور أجهزة دعم الدورة الدموية الميكانيكية والاعتراف بأن تصاعد أجهزة ضغط الأوعية يرتبط بزيادة معدل الوفيات، حدث تحول نموذجي في علاج كل من AMI و ADHF CS5،6 ذات الصلة.
في العصر الحالي من أجهزة المساعدة البطينية عن طريق الجلد (pVAD) ، هناك عدد من منصات /تكوينات أجهزة MCS المتاحة ، والتي توفر دعما أحادي البطين أو ثنائي البطين والدورة البطينية مع وبدون القدرة على الأوكسجين7. وعلى الرغم من الزيادات المطردة في استخدام ال PVADs لعلاج كل من AMI و ADHF CS، ظلت معدلات الوفيات دون تغيير إلى حد كبير5. مع ظهور أدلة على الفوائد السريرية المحتملة لتفريغ البطين الأيسر (LV) في AMI8 والاستخدام المبكر ل MCS في AMI CS9 ، يستمر استخدام MCS في الزيادة.
يتجاوز جهاز MCS Atrial to Femoral Arter Bypass (LAFAB) الأيسر الأذين عن طريق تصريف الدم من الأذين الأيسر (LA) وإعادته إلى الدورة الدموية الشريانية الجهازية عبر الشريان الفخذي (الشكل 1). وهو مدعوم بمضخة طرد مركزي خارجية توفر تدفق 2.5-5.0 لتر في الدقيقة (L/m) (مضخة الجيل الجديد ، المعينة باسم LifeSPARC ، قادرة على تدفق يصل إلى 8 لتر / متر) اعتمادا على حجم القنية. بمجرد استخراج الدم من لوس انجليس عن طريق القنية الوريدية عبر الصفاز ، فإنه يمر عبر مضخة الطرد المركزي الخارجية التي تعيد تدوير الدم مرة أخرى إلى جسم المريض عن طريق القنية الشريانية الموضوعة في الشريان الفخذي.
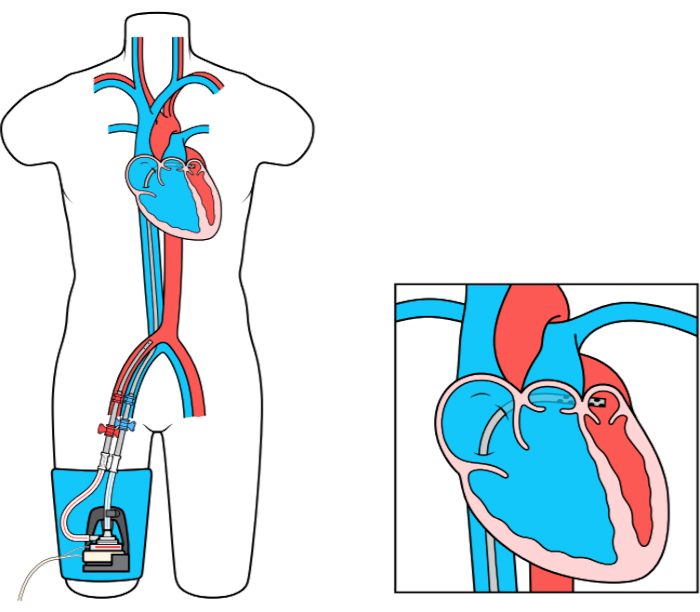
الشكل 1: إعداد LAFAB. صورة مجاملة من TandemLife ، وهي شركة تابعة مملوكة بالكامل لشركة LivaNova US Inc. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
الديناميكا الدموية لجهاز LAFAB:
يتميز الملف الشخصي الديناميكي الدموي لجهاز LAFAB عن pVADs الأخرى. عن طريق استنزاف الدم مباشرة من لوس انجليس وإعادته إلى الشريان الفخذي، والجهاز يتجاوز LV تماما. في القيام بذلك، فإنه يقلل من LV نهاية حجم الانبساطي والضغط، والمساهمة في تحسين هندسة …
Disclosures
The authors have nothing to disclose.
Acknowledgements
إلى فريق تاندمهارت في لايفسببارك.
Materials
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
References
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction–etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O’Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).

