Использование чрескожного желудочкового вспомогательного устройства / левого предсердия до системы шунтирования бедренной артерии для кардиогенного шока
Summary
В следующей статье описывается пошаговая процедура размещения устройства (например, Tandemheart) при кардиогенном шоке (CS), которое представляет собой чрескожное вспомогательное устройство левого желудочка (pLVAD) и систему шунтирования левого предсердия в бедренную артерию (LAFAB), которая обходит и поддерживает левый желудочек (LV) в CS.
Abstract
Система шунтирования левого предсердия в бедренную артерию (LAFAB) представляет собой механическое устройство поддержки кровообращения (MCS), используемое при кардиогенном шоке (CS), которое обходит левый желудочек путем дренирования крови из левого предсердия (LA) и возвращения ее в системное артериальное кровообращение через бедренную артерию. Он может обеспечивать потоки в диапазоне от 2,5-5 л/мин в зависимости от размера канюли. Здесь мы обсудим механизм действия LAFAB, имеющиеся клинические данные, показания к его применению при кардиогенном шоке, этапы имплантации, постпроцедурный уход, а также осложнения, связанные с использованием данного аппарата и управлением ими.
Мы также предоставляем краткое видео процедурной составляющей аппаратной терапии, включая подготовку перед размещением, чрескожное размещение устройства с помощью транссептической пункции под эхокардиографическим руководством и послеоперационное управление параметрами устройства.
Introduction
Кардиогенный шок (КС) — это состояние гипоперфузии тканей с сопутствующей гипотензией или без нее, при котором сердце не в состоянии доставить достаточное количество крови и кислорода для удовлетворения потребностей организма, что приводит к органной недостаточности. Он классифицируется на стадии от А до Е Обществом сердечно-сосудистой ангиографии и вмешательств (SCAI): стадия А – пациенты с риском КС; стадия В – пациенты на начальной стадии КС с гипотензией или тахикардией без гипоперфузии; стадия С – классическая КС с холодным и влажным фенотипом, требующим инотропов/вазопрессоров или механической поддержки для поддержания перфузии; стадия D – ухудшение текущего медицинского или механического обеспечения, требующего перехода на более совершенные устройства; и стадия Е – включает пациентов с коллапсом кровообращения и рефрактерными аритмиями, которые активно испытывают остановку сердца при продолжающейся сердечно-легочной реанимации1. Наиболее распространенными причинами КС являются острый ИМ (ОИМ), составляющий 81% случаев в недавно опубликованном анализе2, и острая декомпенсированная сердечная недостаточность (АДГФ). CS классически характеризуется застойными явлениями и нарушением перфузии, проявляющимся повышенным давлением наполнения (давление легочного капиллярного клина [PCWP], левожелудочковое конечное диастолическое давление [LVEDP], центральное венозное давление [CVP] и правожелудочковое конечное диастолическое давление [RVEDP]), снижение сердечного выброса (CO), сердечного индекса (CI), сердечного выброса (CPO) и сбоя в работе конечного органа3 . В прошлом единственными доступными методами лечения ОИМ, осложненными КС, были ранняя реваскуляризация и медицинское лечение инотропами и /или вазопрессорами4. Совсем недавно, с появлением механических устройств поддержки кровообращения (MCS) и признанием того, что эскалация вазопрессоров связана с увеличением смертности, произошел сдвиг парадигмы в лечении как AMI, так и ADHF, связанных с CS5,6.
В нынешнюю эпоху чрескожных желудочковых вспомогательных устройств (pVAD) существует ряд платформ / конфигураций устройств MCS, которые обеспечивают одновентрикулярную или бивентрикулярную поддержку кровообращения и желудочков с возможностью оксигенации и без нее7. Несмотря на устойчивый рост использования пВАД для лечения как ОИМ, так и АДГФ КС, показатели смертности остались в основном неизменными5. С появлением доказательств возможных клинических преимуществ ранней разгрузки левого желудочка (LV) в AMI8 и раннего использования MCS в AMI CS9, использование MCS продолжает расти.
Устройство MCS для шунтирования левой предсердной и бедренной артерии (LAFAB) обходит ЛЖ, дренируя кровь из левого предсердия (LA) и возвращая ее в системное артериальное кровообращение через бедренную артерию (рисунок 1). Он поддерживается внешним центробежным насосом, который обеспечивает поток 2,5-5,0 литров в минуту (л / м) (насос нового поколения, обозначенный как LifeSPARC, способный к потоку до 8 л / м) в зависимости от размера канюль. Как только кровь извлекается из ЛА через транссептальную венозную канюлю, она проходит через внешний центробежный насос, который рециркулирует кровь обратно в тело пациента через артериальную канюлю, помещенную в бедренную артерию.
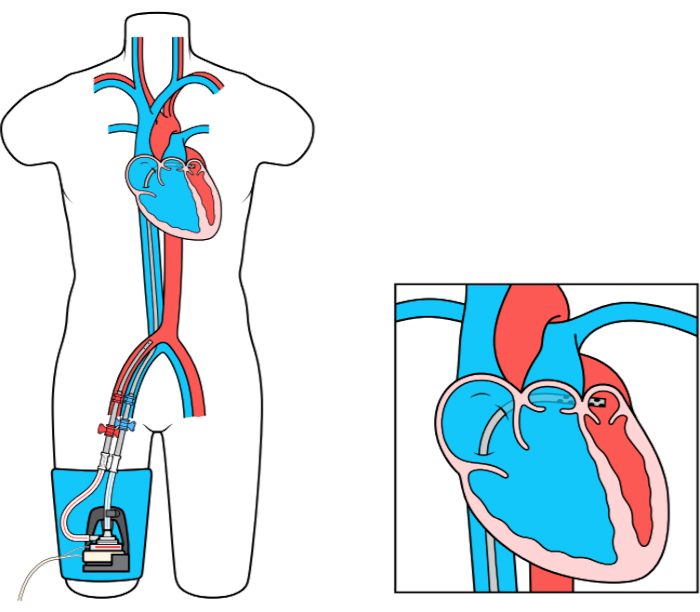
Рисунок 1: Настройка LAFAB. Изображение любезно предоставлено TandemLife, дочерней компанией LivaNova US Inc. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Гемодинамика аппарата LAFAB:
Гемодинамический профиль устройства LAFAB отличается от других пВАД. Дренируя кровь непосредственно из ЛОС и возвращая ее в бедренную артерию, устройство полностью обходит ЛЖ. При этом он уменьшает диастолический объем и давление на конце Р?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Команде TandemHeart в LifeSparc.
Materials
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
References
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction–etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O’Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).

